山东近海高眼鲽种群结构及资源分布
2020-05-23衷思剑王晶刘淑德王四杰任一平
衷思剑,王晶,刘淑德,王四杰,任一平,3*
(1. 中国海洋大学 水产学院,山东 青岛 266003;2. 山东省水生生物资源养护管理中心,山东 烟台 264003;3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071)
1 引言
高眼鲽(Cleisthenes herzensteini)为近海冷温性底层鱼类,属于鲽形目(Pleuronectiformes)、鲽科(Pleuronectidae)、高眼鲽属(Cleisthenes),分布于西北太平洋的广阔水域,在我国则分布于渤海、黄海和东海,从浙江大陈岛至鸭绿江口均有出现,常见于33°N以北的海域[1-2],是黄、渤海鲆鲽鱼类中资源量较多的种类之一[3],具有重要的经济价值。高眼鲽通常栖息于砂泥底质海域的底部,营养级较高,以小型鱼类、甲壳类和瓣鳃类为主要捕食对象[4],在黄海食物网和生态系统中占有重要地位[5]。由于捕捞强度的过大,产卵场和越冬场等栖息地的破坏,以及气候变化等因素的影响,许多传统经济鱼类处于资源萎缩之中,其中就包括高眼鲽[6]。近年来,有研究表明,高眼鲽的种群结构已经简单化,个体小型化现象明显,资源量呈下降的趋势[5]。为了高眼鲽资源的保护、管理和长期利用,对该鱼种进行全面而深入的研究显得十分有必要。
目前,国内外学者对高眼鲽的研究不多,且主要涉及于摄食[3,7-8]、发育[9-10]和基因[11-12]等方面,而关于其种群结构和资源量方面的报道较少。Shan等[5]研究了黄海中南部高眼鲽1985—2010年各个季节的资源动态和生物学特征,发现高眼鲽种群呈向北移动和集中化的趋势,且其优势体长正在逐年减小。山东省海域面积辽阔,海岸线绵延3 345 km,河口、海湾和岩礁广布[13],有烟威、石岛和连青石等众多渔场,是小黄鱼(Larimichthys polyactis)、蓝点马鲛(Scomberomorus niphonius)和星康吉鳗(Conger myriaster)等经济鱼类重要的繁衍育肥场所,也是高眼鲽的主要分布区之一[14-15],然而迄今未有对整个山东海域高眼鲽的研究报道。因此,本文根据在山东近海进行的4个航次的底拖网调查数据,对高眼鲽的种群结构和相对资源密度的分布状况等方面进行研究,旨在为深入了解该鱼类的种群特征提供基础资料,为修复与合理利用山东近海高眼鲽资源提供科学依据。
2 材料与方法
2.1 数据来源
高眼鲽样品采自秋(2016年10月)、冬(2017年1月)、春(2017年 5月)和夏(2017年 8月)4个季节在山东近海海域进行的底拖网调查。按照季节,将整个调查分为4个航次,所有航次均设置177个调查站位(图1),其中有52个站位在至少1个航次中采到高眼鲽,共计793尾。使用的渔业调查船功率为220 kW,作业方式为单拖网,尺寸为1 380目×4.67 cm,网口的高度和宽度分别约为7.53 m和15 m。根据《海洋调查规范》[16]的技术要求,将捕捞上来的样品先经过冷冻保存处理,在实验室解冻后,测定体长、体质量、纯体质量和性腺成熟度等生物学参数。长度和质量的测量分别精确到0.1 cm和0.01 g。每站起网后用CTD仪测量该调查站位的水深、底层盐度和水温等环境数据。
2.2 数据分析
高眼鲽体长和体质量的拟合关系式[17]:

式中,W和L分别为体质量(单位:g)和体长(单位:cm),a为条件因子,b为异速生长因子。当b值为3时,个体为等速生长,即体长、体高和体宽的增长速率相等;当b值大于3时,个体为正异速生长,即体高和体宽的增长速率快于体长;当b值小于3时,个体为负异速生长[18]。参数b的值与3的差异运用t检验。使用协方差分析检验各季节雌雄个体体长-体质量关系的差异显著性,若有显著差异,则雌雄分开各自拟合关系式,反之则合并分析。
高眼鲽的生长采用von Bertalanffy生长方程来拟合[19]:
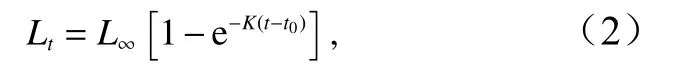
式中,Lt是年龄t(单位:a)时的平均体长(单位:cm);L∞是渐近体长(单位:cm);K是生长系数,即生长曲线的平均曲率,表示个体体长趋向于其渐近值的相对速率;t0是理论上体长为0时的年龄。本研究以1 cm为间隔,将高眼鲽样品划分为27个体长组,使用电子体长频率分析(Electronic Length Frequency Analysis,ELEFAN)[20]方法估算生长参数L∞、K、t0,并根据Pauly经验公式估算理论初始年龄t0[21]:
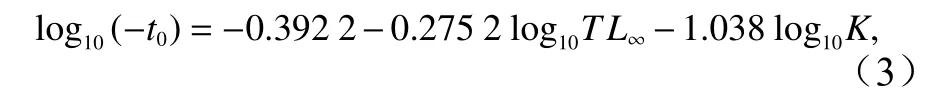
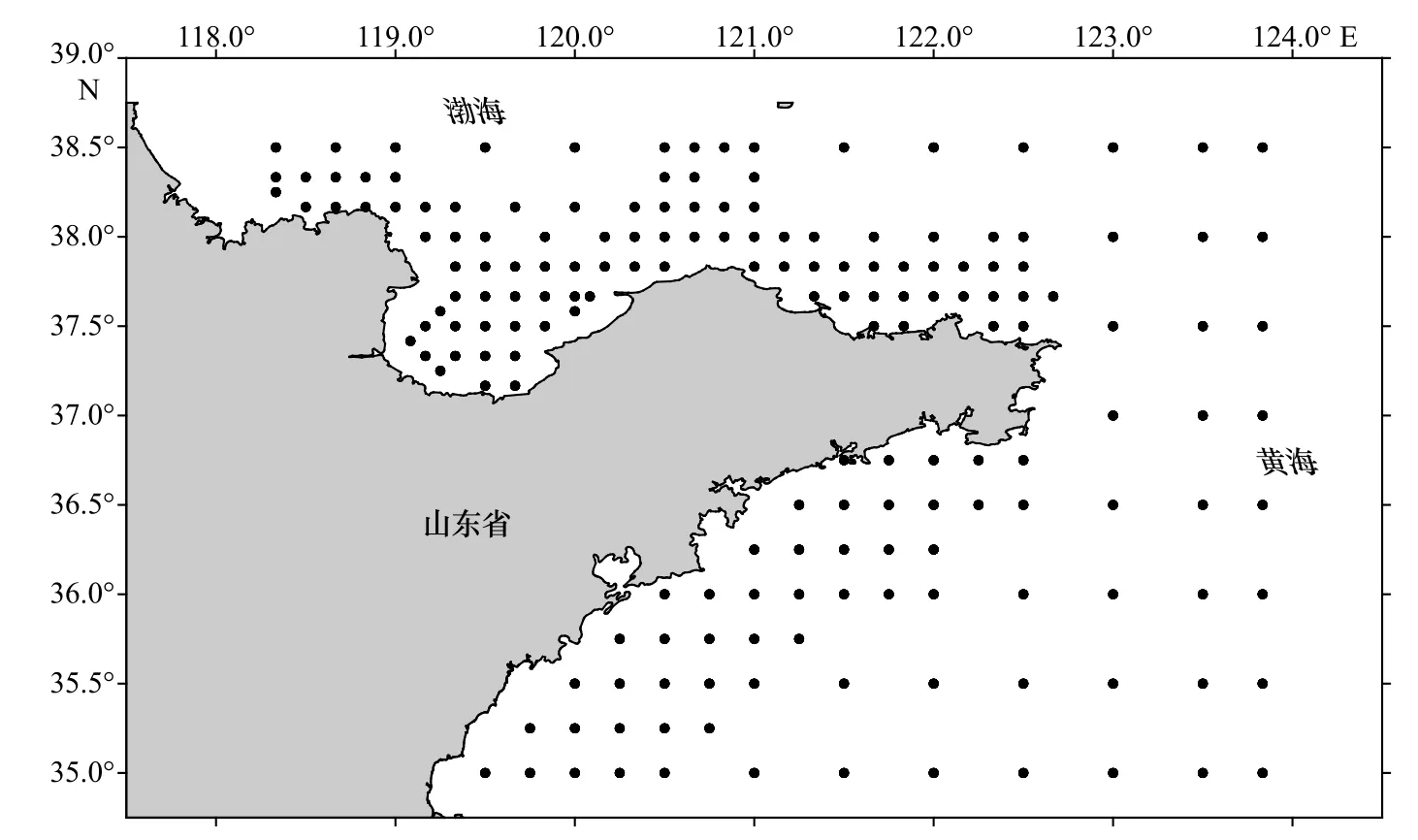
图1 山东近海调查站位Fig. 1 Sampling stations in Shandong coastal waters
式中,TL∞为渐近全长,故需将渐近体长(L∞)换算为渐近全长。因此,根据高眼鲽样品的全长和体长数据,经线性拟合得到全长和体长的关系式,从而求得该鱼的渐近全长。最后,根据R软件生成的生长曲线图,通过彼得生(Peterson)鱼体自然长度分布曲线法得出高眼鲽样品的年龄[22]。
捕捞死亡系数(F)通过总死亡系数(Z)和自然死亡系数(M)的差值来求得,Z通过体长转换的渔获曲线计算[23],M采用Pauly经验公式计算[24]:

式中,T为生长环境的平均水温(单位,℃),依据本次山东近海的调查数据,平均底层水温设为14.92℃。开发率(E)为F和Z的比值。根据渔获曲线方程推算捕捞选择性系数(S)[25],S为0.5时的年龄即为开捕年龄,对应的体长为开捕体长。
运用χ2检验比较高眼鲽的性比(♀:♂)与1∶1的差异[23]:
式中,O为实际观察尾数,E为理论尾数。
性成熟变化以性成熟系数(Gonadal Somatic Index,GSI)表示[26]:
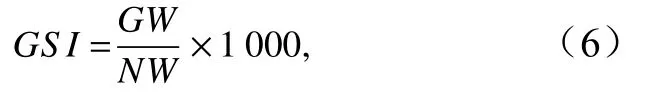
式中,GW为性腺质量(单位:g),NW为去除性腺和胃肠的纯体质量(单位:g)。
性腺成熟度采用目测等级法,性腺发育程度按照Ⅰ~Ⅵ期进行划分[27],Ⅳ期以上(Ⅳ~Ⅵ期)即为性成熟。以2 cm为间隔划分体长组,利用各体长组的性成熟个体百分比拟合逻辑斯缔(Logistic)曲线,并推算高眼鲽的50%性成熟体长[28]:
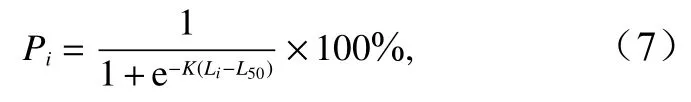
式中,Pi为性成熟个体占组内样本总数的百分比,K为瞬时性成熟速率,Li为各体长组的组中值(单位:cm),L50为 50% 性成熟体长(单位:cm)。
各站位的拖网时间均标准化为1 h,拖网速度均标准化为3 kn。以单位时间渔获量(单位:kg/h)表示各站位高眼鲽的相对资源密度,以平均渔获量(单位:kg/h)、贡献率和出现频率表示各航次高眼鲽的相对资源密度。由于高眼鲽为贴近海底泥沙生活的鱼类,因此本研究采用底层水温、底层盐度和水深等环境因子分析高眼鲽的栖息环境。
3 结果
3.1 体长和体质量的组成
山东近海此次调查所得高眼鲽样品的体长范围为3.8~29.6 cm(表1),平均体长为13.61 cm,优势体长组为6~18 cm,占总数的88.90%。秋季采集的高眼鲽平均体长最大,其次是冬季个体,而春、夏季的个体较小。秋、冬季的体长频率均为单峰型(图2),峰值为14~15 cm。春季体长频率为双峰型,峰值为5~7 cm和14~15 cm。夏季体长频率为单峰型,峰值为8~9 cm。体质量范围为0.96~487.50 g(表1),平均体质量为48.12 g,优势体质量组为0~70 g,占总数的78.18%。夏、秋季采集的高眼鲽平均体质量较大,而冬、春季的个体较小。
3.2 体长-体质量关系
协方差分析表明,在任何季节,高眼鲽雌雄群体之间的体长-体质量关系参数无显著差异(p>0.05),因此,将每个季节的雌雄群体合并用于分析。参数a在春季和秋季较大(表2),在冬季和夏季较小;b值在夏季最大,其次是冬季和秋季,而春季最小。经t检验,b值与3存在显著差异(p<0.05)。在体长为0~15 cm时,高眼鲽的体质量季节差异很小(图3);当体长大于15 cm时,体质量则呈现较大的季节变化。体质量增长率在夏季较大,其次是冬季,而春季和秋季较小且几乎相等。
3.3 生长、死亡、开捕体长和年龄
采用von Bertalanffy生长方程描述高眼鲽的生长特征,应用ELEFAN技术拟合高眼鲽的生长方程,得出其生长曲线(图4)。估算出各生长参数为L∞=37.85 cm,K=0.28,根据Pauly经验公式得出t0=-0.57,由此得出其生长方程为:Lt=37.85×[1-e-0.28(t+0.57)]。
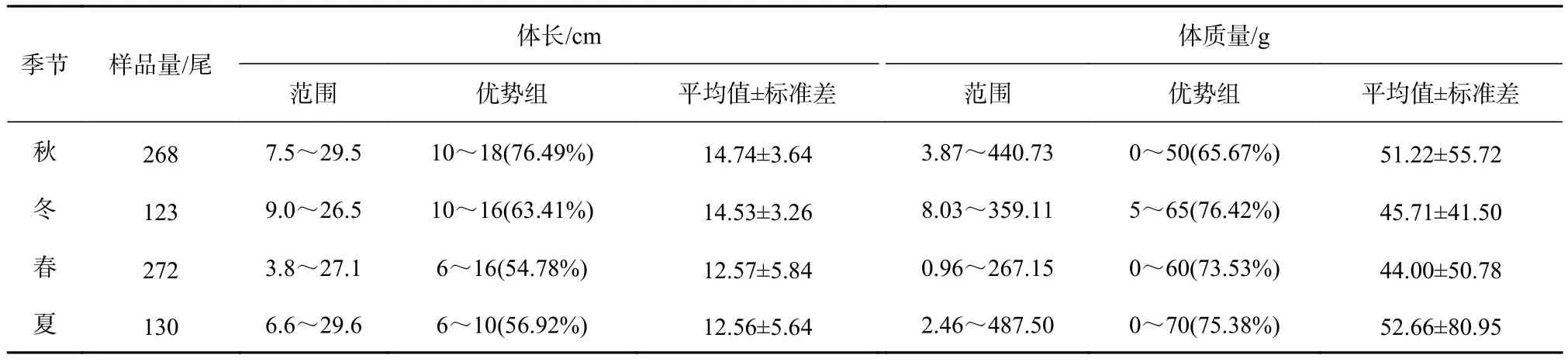
表1 山东近海高眼鲽体长和体质量组成的季节变化Table 1 Seasonal variations in length and mass of Cleisthenes herzensteini in Shandong coastal waters
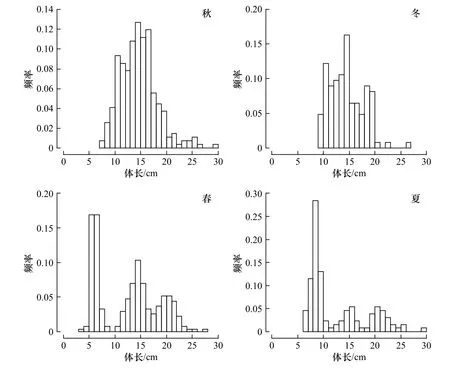
图2 山东近海高眼鲽体长分布Fig. 2 Length distributions of Cleisthenes herzensteini in Shandong coastal waters
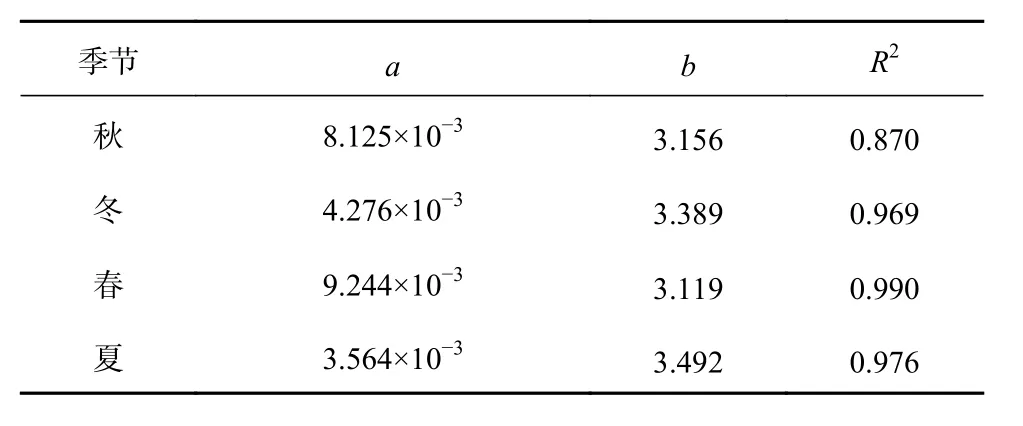
表2 山东近海高眼鲽体长-体质量关系参数Table 2 Parameters of length-mass relationships for Cleisthenes herzensteini in Shandong coastal waters
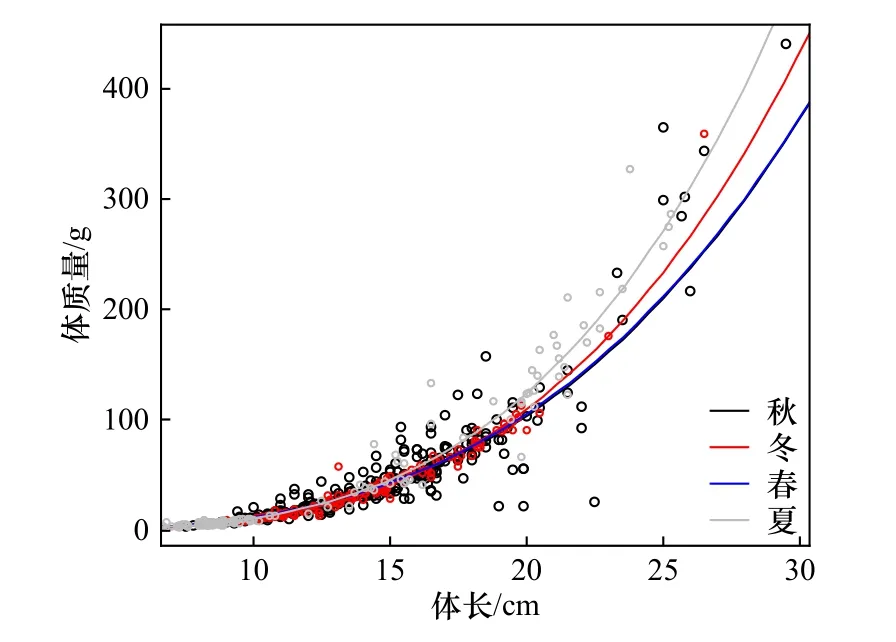
图3 山东近海高眼鲽在不同季节的体长-体质量关系差异Fig. 3 Variations of length-mass relationships for Cleisthenes herzensteini among seasons in Shandong coastal waters
通过体长频率求得渔获曲线(图5),选择最后14个点进行线性回归,其回归曲线的斜率的绝对值即高眼鲽的总死亡系数,为1.69。通过渔获曲线求得捕捞选择性(图6),其开捕年龄为1.48龄,对应的开捕体长为12.68 cm。根据总死亡系数和Pauly经验公式算出的自然死亡系数(0.54),求得捕捞死亡系数为1.15,开发率为68.05%。
利用彼得生鱼体自然长度分布曲线法,得出该群体年龄组成为1~5龄(图7),优势年龄为1龄与2龄,其所占总数的百分比分别为45.15%与40.23%。其他年龄组个体较少,3、4和5龄所占百分比分别为12.61%、1.64%和0.38%。雌性群体的年龄组成为1~5龄,其平均年龄为2.48龄;雄性个体的年龄组成1~4龄,平均年龄为1.84龄。
3.4 性比和性成熟
χ2检验的结果显示(表3),各季节中,只有夏季样品的雌雄性比与1∶1差异显著(p<0.05),且雌性的数量显著多于雄性。体长小于10 cm的样品仅能鉴别出一尾为雌性;在体长为10~15 cm的样品中,只有在秋季性比与1∶1存在显著差异(p<0.05),此时雌性数量相比雄性显著偏少;而体长大于15 cm的样品性比与1∶1均无显著差异,且春季和夏季大于20 cm的样品仅存在雌性个体。
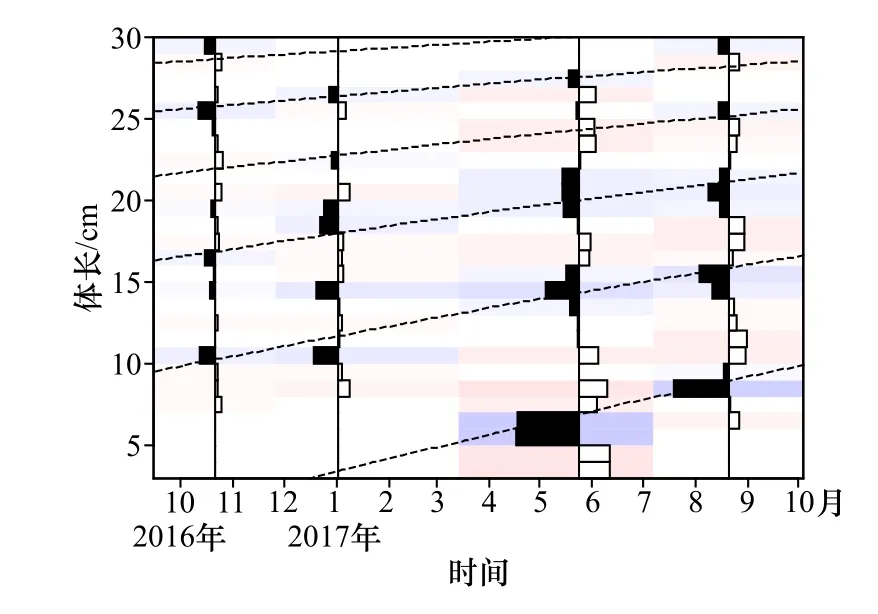
图4 山东近海高眼鲽的体长频率分布和使用ELEFAN拟合的生长曲线Fig. 4 Length frequency distributions and growth curves estimated by ELEFAN of Cleisthenes herzensteini in Shandong coastal waters
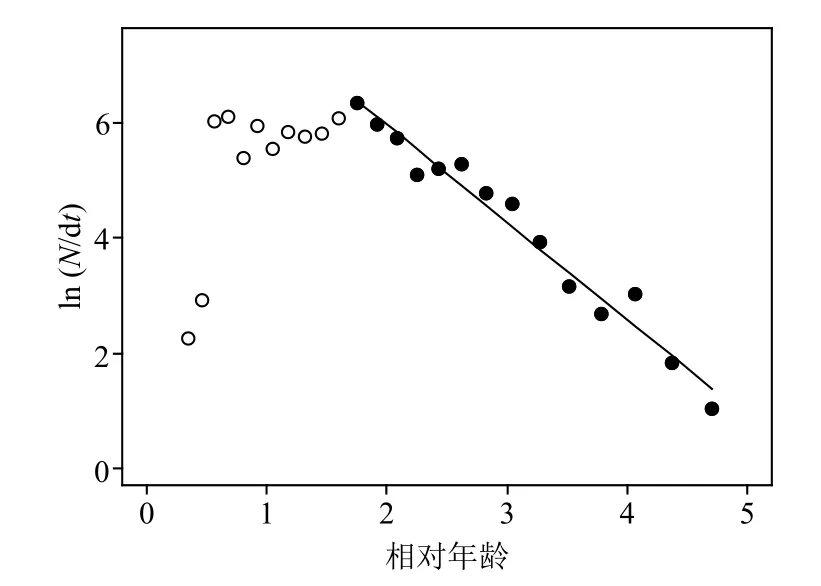
图5 山东近海高眼鲽体长转化的渔获曲线Fig. 5 The length-converted catch curve of Cleisthenes herzensteini in Shandong coastal waters
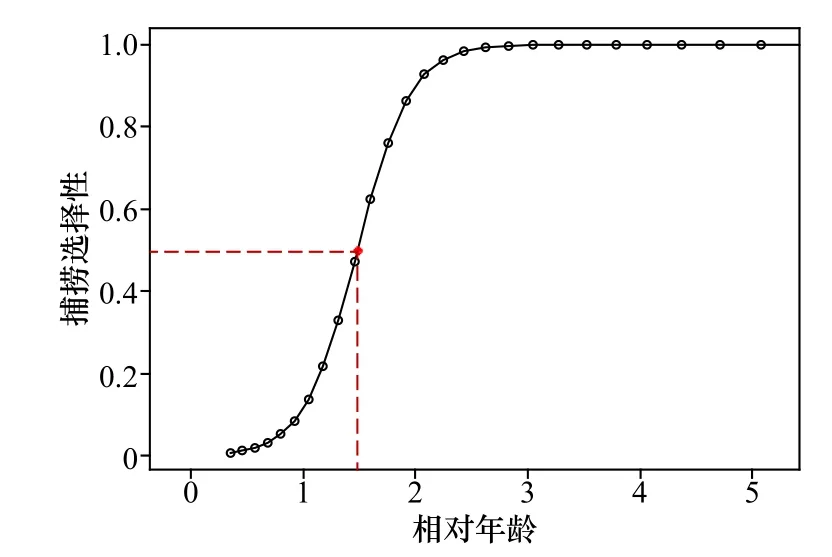
图6 山东近海高眼鲽的捕捞选择性曲线Fig. 6 The catch selectivity curve of Cleisthenes herzensteini in Shandong coastal waters
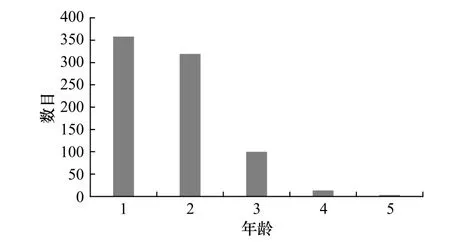
图7 山东近海高眼鲽年龄结构Fig. 7 The age structure of population of Cleisthenes herzensteini in Shandong coastal waters
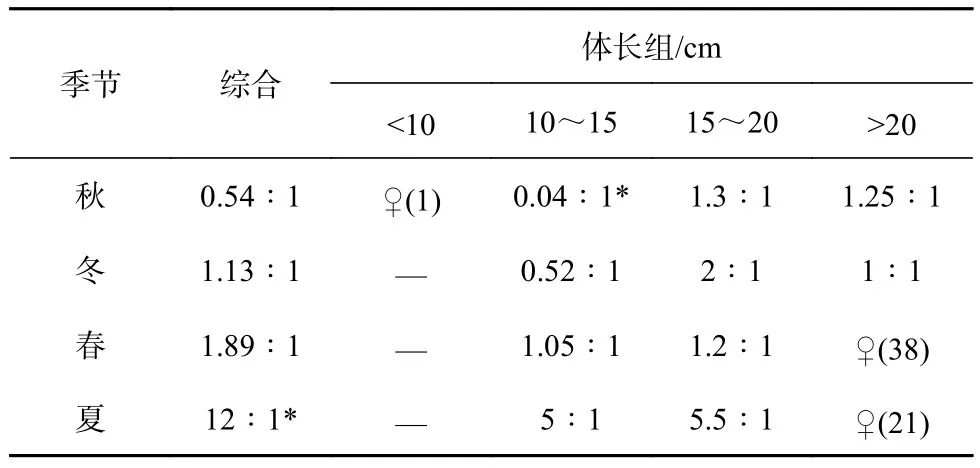
表3 山东近海高眼鲽性比的季节变化Table 3 Seasonal variations in sex ratios (♀:♂) of Cleisthenes herzensteini in Shandong coastal waters
在秋季,高眼鲽样品的性腺以Ⅱ期为主(图8),而性成熟个体(Ⅳ期及以上)较少,占总数的11.96%;冬季Ⅱ、Ⅲ期占优势,无性成熟个体;春季样品的性腺主要为Ⅲ期,性成熟个体所占比例仅为11.81%;性成熟比例最高的季节出现在夏季,扩大至57.69%。从秋季到夏季,Ⅱ期比例明显减小,Ⅲ期先升后降,而Ⅳ期从春季开始呈逐渐上升趋势。
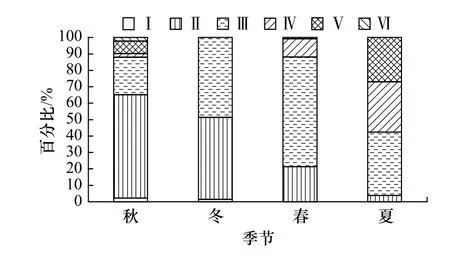
图8 山东近海高眼鲽性腺成熟度各期百分比组成Fig. 8 Percentage of gonad developmental stage of Cleisthenes herzensteini in Shandong coastal waters
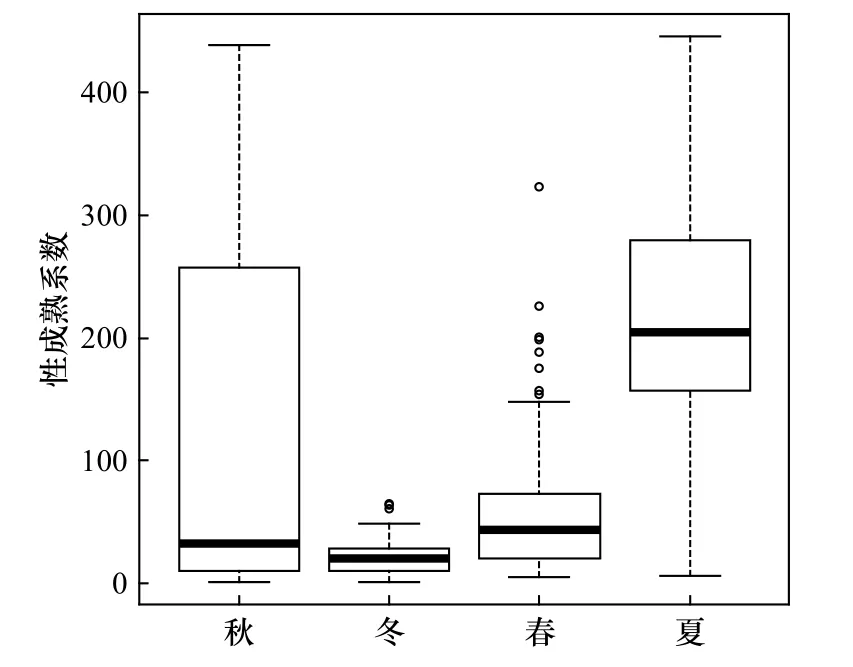
图9 山东近海高眼鲽性成熟系数变化Fig. 9 Variations in gonadal somatic index of Cleisthenes herzensteini in Shandong coastal waters
高眼鲽GSI的分布范围在秋季较大(图9),为1~278.9;其次是夏季和春季,分别为5.5~277.7和4.8~229.3;而冬季最小,为1.3~56.9。平均性成熟系数在夏季较大,而在其他季节差别很小,顺序由大至小依次为夏季、春季、秋季、冬季。
方差分析的结果显示,高眼鲽性成熟个体百分比与体长的关系无显著的雌雄差异(p>0.05)。因此,将雌、雄个体合并拟合其性成熟个体百分比与体长的关系曲线(图10),符合逻辑斯缔曲线关系,得出50%性成熟体长为22.35 cm。
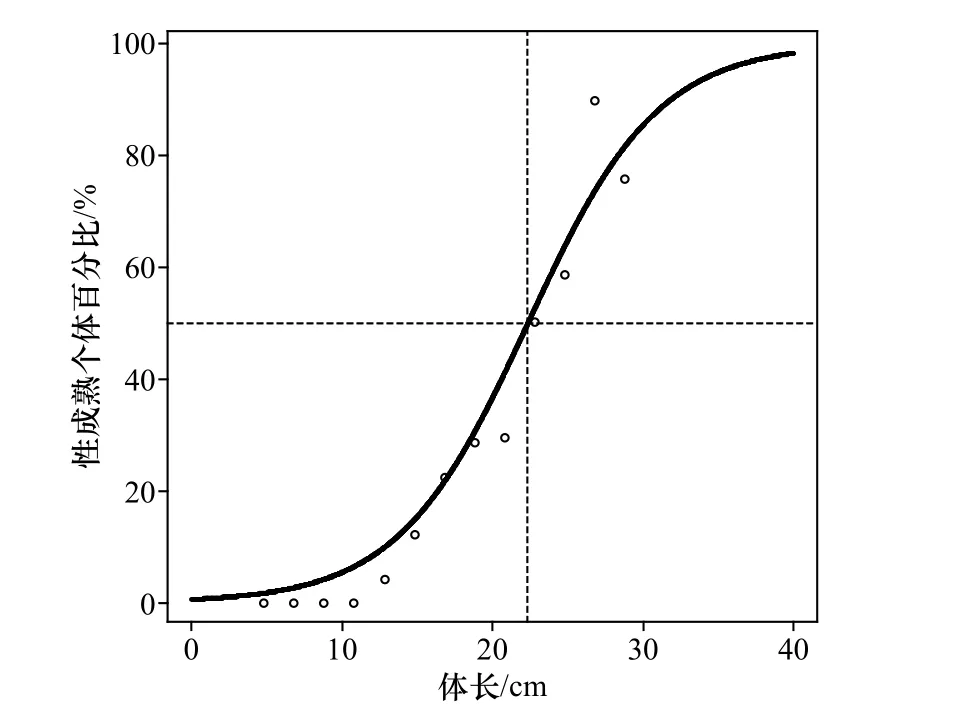
图10 山东近海高眼鲽性成熟与体长的关系曲线Fig. 10 Sexual maturity in relation to length for Cleisthenes herzensteini in Shandong coastal waters
3.5 相对资源密度及其时空分布特征
在4个航次的调查中,高眼鲽的平均渔获量在秋季远多于其他季节(表4),在冬季骤然下降,随后在春、夏季缓慢上升。贡献率也是在秋季最大,之后逐渐下降,直至夏季降至最低。从秋季到夏季,站位出现频率呈现先降后升再降的趋势,且在春季达到最高。
高眼鲽分布区底层水温范围为6.45~24.21℃(表5),主要集中在6.45~19.06℃的水域;分布区底层盐度范围为19.77~33.26,密集区在31.82~33.10的水域。

表4 山东近海高眼鲽平均渔获量、贡献率和出现频率的季节变化Table 4 Mean catch, the percentage in the total catch by mass and the occurrence frequency of Cleisthenes herzensteini in Shandong coastal waters.
研究发现,高眼鲽主要分布在50 m等深线以深的水域(图11),其次为30~50 m的水深区域,而30 m等深线以浅水域的资源量很低。高眼鲽相对资源密度的空间分布特征呈现明显的季节变化,其中,秋季的高眼鲽在东北部海域分布较多,而冬、春季则主要分布于山东近海东南部。与冬季相比,春季的高眼鲽有向近岸移动的趋势,且分布较为分散,在各个海域几乎均有分布。在夏季,南北海域的高眼鲽资源分布相差不大,且主要分布于50 m等深线以深的水域,最高值出现在山东近海东北部。
4 讨论
4.1 高眼鲽种群结构的季节变化
本研究调查采集到的高眼鲽样品体长范围为3.8~29.6 cm,而Shan等[5]在1985—2010年黄海中南部采集的高眼鲽体长范围为3.8~51.0 cm。鱼类的体长分布随生活环境的变化而变化,鱼类的体长分布越宽,越有助于水体中食饵的充分利用,从而有助于鱼类数量的可持续补充[29]。本研究得出的生长系数K为0.28,略快于1978—1985年中国海域高眼鲽的生长系数K(0.22)[30]。多年来的过度捕捞,使得高眼鲽中的大个体难以存活,体长分布变窄,且较高的水温会导致鱼类生长加快、个体小型化和肥满度升高[31-32]。张波和唐启升[33]在2000年10—11月和2001年4月对黄海36°N以南海域的调查中,捕获的高眼鲽体长范围为9~28 cm,平均体长为15.32 cm,与本研究秋季和春季所获的样品相比,范围近乎一致,但平均体长却均大于本研究相应季节的测量值,进一步反映了高眼鲽小型化的趋势。在本研究中,高眼鲽的捕捞死亡系数(1.15)是自然死亡系数(0.54)的2倍多,表明山东近海高眼鲽资源的开发程度较高,开发率高达68.05%,已处于过度开发的状态。
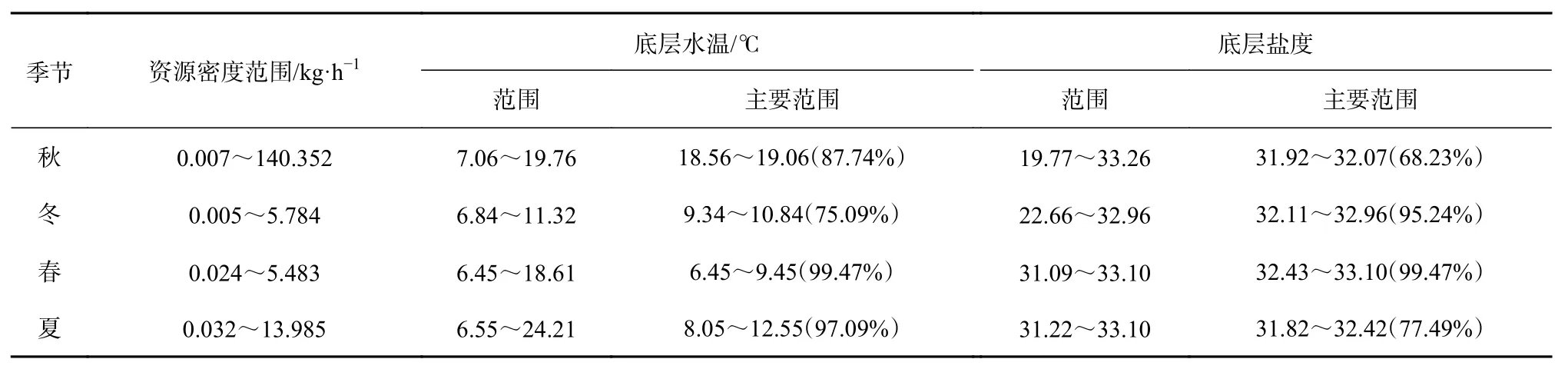
表5 山东近海高眼鲽相对资源密度及其温盐分布的季节变化Table 5 Seasonal variations in the relative stock density, temperature and salinity of the distribution area of Cleisthenes herzensteini in Shandong coastal waters
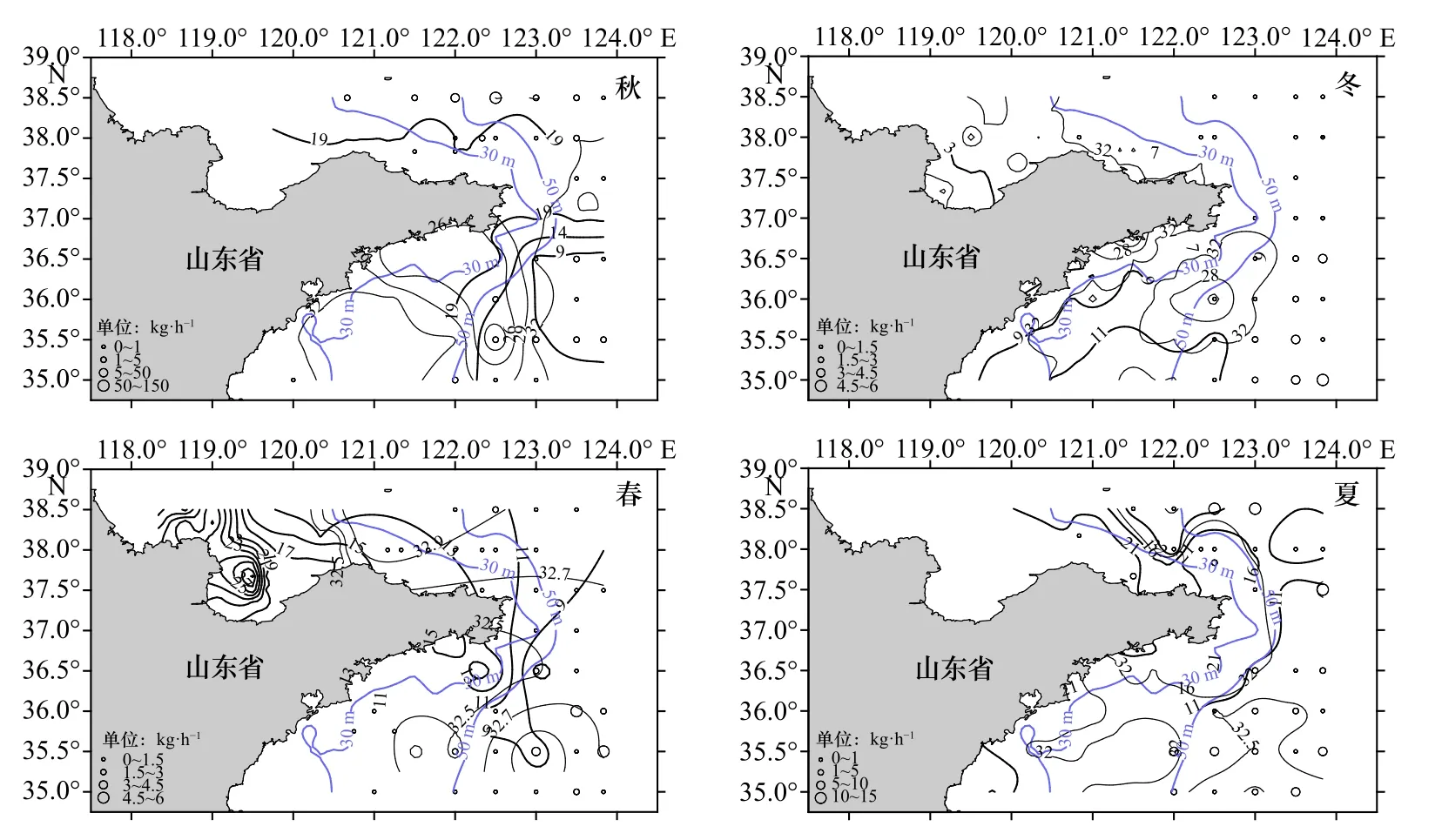
图11 山东近海高眼鲽相对资源密度的空间分布Fig. 11 Spatial distributions of the relative stock density of Cleisthenes herzensteini in Shandong coastal waters
在春季和夏季,高眼鲽的体长分布均存在3个波峰,可能是因为群体组成中存在3个年龄组,即1龄、2龄和3龄组。根据计算得出的生长方程,发现各年龄组对应的体长范围与体长分布图中的波峰基本吻合,说明本研究得出的各生长参数是较为准确的。
世界鱼类数据库(Fishbase)对高眼鲽的贝叶斯分析显示,其条件因子a和异速生长因子b的值分别为8.51×10-3(5.44×10-3~13.31×10-3)和 3.02(2.89~3.15)[34]。在本研究的结果中,a和b值分别为3.564×10-3~9.244×10-3和3.119~3.492,与世界鱼类数据库中的数值相比,a值偏小,b值偏大,但总范围大体一致。a值可以反映鱼类种群所处生境的优良程度[35],从本研究得出的较小的a值,或许可以看出山东近海目前的环境状况欠佳。在饵料供应、水文等环境条件好的时候,a值较大,此时鱼类的索饵行为更为活跃,且a的大小也受产卵的影响,产卵后a值会减小,在性腺发育成熟时达到最高[36],本研究中的a值在春、秋季较大,而在冬、夏季较小与这一规律是相符的。高眼鲽的b值显著大于3,表示山东近海2016年10月至2017年8月的高眼鲽为正异速生长,即体周增长率大于体长增长率,身体趋于肥胖。天敌数量的下降,可以使鱼类的异速生长因子提高[37],这可能是高眼鲽呈现正异速生长的原因之一。
高眼鲽在春季至秋季产卵,其中4月下旬至5月中旬为主要产卵期[2],而本研究的结果却是高眼鲽在夏季的8月性成熟比例和程度最高,可以得出其繁殖期有向后推迟的现象。这可能是饵料不足等环境条件的恶化引起的。在饵料生物的供应状况较差时,鱼类的生长就会减缓,从而造成性成熟和繁殖期的延迟[22]。上世纪80年代,高眼鲽主要以鳀(Engraulis japonicas)和玉筋鱼(Ammodytes personatus)为食[3],然而在本世纪初,其优势饵料物种就已经变为太平洋磷虾(Euphausia pacifica)、脊腹褐虾(Crangon affinis)和红明樱蛤(Moerella rutile)等[7],鱼类在捕食成分中所占比例相对较低。高眼鲽对优质饵料摄入的减少会影响能量的获得,从而改变其生长和资源量[7]。性比的变化是种群结构的一种反映,也是种群进行自然调节的一种方式[38],性比的季节差异可能与环境和繁殖有关[39]。在本研究中,夏季高眼鲽的性腺发育最成熟,且雌性个体远多于雄性个体,据此可以推测出夏季可能为主要产卵期。
4.2 高眼鲽的相对资源密度与分布
本研究调查的渤海区域,只有秋季和春季的各1个站位采集到高眼鲽,所在水深分别为35.00 m和17.65 m。山东近海渤海区的高眼鲽稀少,可能是高眼鲽的生活习性决定的。历史资料显示,高眼鲽产卵场位于辽东半岛附近的海域,以及山东半岛南部的青海和连青石渔场[2],与本研究的结果大体一致,只是本研究发现烟威渔场可能也是高眼鲽的产卵分布区之一。高眼鲽1—3月在石岛东部海域越冬,纬度范围约为 34°~39°N,水深主要为70~80 m,约3月开始生殖洄游,产卵后主要分散于30~60 m的深水区索饵,秋末冬初返回越冬地[2]。渤海区除了4个站位的水深为30~35 m,其余50个站位的水深均小于30 m。秋季有1个站位采到高眼鲽,可能是因为处于部分高眼鲽的索饵场。至于春季在黄河口浅水区捕到的3尾样品,或许是因为高眼鲽所产的卵为浮性卵,刚孵化后的幼鱼不具备游泳能力,需要经历数天的浮游生活[9],此阶段容易受到季风、洋流和风暴的影响,少量个体会漂流至传统栖息地以外的海域。Dou[40]在1984年对渤海鲆鲽类生活史的调查中发现,5月在黄河口和滦河口附近有高眼鲽鱼卵分布,而王娇等[41-42]关于黄河口的调查则未采到高眼鲽个体,这反映出高眼鲽在生命早期阶段具有潜在的扩散能力,黄河口及其邻近海域是高眼鲽的潜在分布区。冬季,在水深50 m以浅的海域,仍有4个站位有高眼鲽分布,其中2个站位的水深甚至小于30 m,自西向东这4个站的底层水温分别为6.84℃、8.40℃、8.59℃和8.85℃,均低于该季节高眼鲽分布的主要底温范围,这些站位的高眼鲽可能正处于向深水区进行越冬迁移的途中。
秋季高眼鲽的平均渔获量和贡献率均高于其他季节,这可能与休渔制度有关。在2016年,35°N以北海域的伏季休渔期为6—8月,涵盖了整个夏季,这一时间段水温较高,饵料生物丰富,是高眼鲽生长旺盛的时期,且有大量的当年生补充群体索饵和育肥,因此高眼鲽的相对资源密度在秋季达到最高。休渔期之后,经过大规模的捕捞,高眼鲽的资源量迅速下降,直至冬季降至最低。而随着35°N以北海域2017年休渔期(5—8月)的到来,对高眼鲽的捕捞行为基本终止,其资源量又开始逐渐上升。
综上所述,山东近海高眼鲽的种群特征表现为体长分布狭窄、饵料条件恶化、产卵期延迟和过度捕捞等现象。饵料供应不足会导致相对资源密度的下降,且本研究显示休渔期前后高眼鲽资源量变化剧烈,捕捞强度的过大可能会加剧资源结构的脆弱程度,严重制约伏季休渔制度对资源恢复的长期生态效应[43]。鉴于此,在未来应进一步研究繁殖力、年际变化和饵料生物供应等特征,为山东近海高眼鲽资源的可持续利用提供科学参考,并且应加强对资源的管控,以维护高眼鲽种群的健康及稳定。
