意大利蜜蜂哺育蜂学习记忆相关基因的转录组学分析
2020-05-22朱雅楠王雪妍李秋方苏松坤聂红毅
高 艳, 朱雅楠, 张 威, 王雪妍, 李秋方, 苏松坤, 聂红毅
(福建农林大学动物科学学院(蜂学学院), 福州 350002)
蜂群一般由一头蜂王、上百头雄蜂和上万头工蜂组成 (Page and Peng, 2001),随着日龄的增加,工蜂的劳动分工也逐渐从巢内转向巢外(Robinson, 1992)。青年工蜂主要在巢内活动,负责幼虫和蜂王的饲喂与照料、巢房的清理等;老年工蜂主要在巢外活动,负责采粉、采蜜、采水、采胶等(Johnson, 2010)。哺育蜂在巢房内不仅分泌蜂王浆饲喂蜂王和3日龄以内的幼虫,而且还能够传播蜂王信息物质(Velthuis, 1972; Seely, 1979)。
哺育蜂哺育行为与蜂王浆分泌密切相关,目前基于哺育行为展开大量的分子生物学方面研究以期从分子角度阐明蜂王浆分泌机制(Fengetal., 2009; Uenoetal., 2009; Lietal., 2010; Liuetal., 2013);此外工蜂在蜂群中的劳动分工也离不开哺育蜂哺育行为,从分子角度阐述蜂群劳动分工中相关基因的研究报道也不在少数(Shapiraetal., 2001; Kucharski and Maleszka, 2002; Tsuchimotoetal., 2004; Garciaetal., 2009; Johnson, 2010; Zannietal., 2018)。自然蜂群中,10日龄工蜂通常从事巢内哺育活动,21日龄工蜂主要从事巢外采集活动;同时蜂群中工蜂的劳动分工具有可塑性(Robinson,1992; Behrendsetal., 2008),当巢内缺少适龄哺育蜂时,老年采集蜂可以再次转变为哺育蜂,以维持蜂群的群势。
哺育蜂哺育行为与其生理健康方面的研究也有涉及,如瓦螨感染哺育蜂后对哺育行为产生许多不利影响,感染的哺育蜂相对于未感染的哺育蜂表现出更差的学习能力(Zannietal., 2018)。已有研究不同日龄条件下哺育蜂、采集蜂学习记忆方面的差异,Behrends和Scheiner(2010)通过测试对比6周的夏季蜜蜂(包括哺育蜂和采集蜂)和6个月的冬季蜜蜂(采集蜂)采集活动对学习表现的影响,发现冬季蜜蜂的日龄虽然很大,但它们的学习和辨别能力并没有随着日龄的增长而下降。
基于蜜蜂嗅觉学习的喙伸反应(proboscis extension reflex, PER)已成为训练蜜蜂学习记忆的经典方法。借助PER手段,能够更好地建立哺育蜂与其学习记忆之间的联系。目前,关于蜜蜂学习记忆过程中的相关基因也有报道。Fiala等(1999)发现,利用RNA干扰降低蛋白激酶A(protein kinase A, Pka)基因的表达后,导致蜜蜂在训练后24 h长期记忆受到损伤,这表明Pka的激活能够诱导蜜蜂24 h长期记忆的形成;Dacher和Gauthier(2008)等通过注射拮抗剂发现,尼古丁受体和一氧化氮合成酶参与了蜜蜂长期记忆的形成;其他基因,如Pka催化亚基基因(Pka-R1,Pka-R2)(Eisenhardtetal., 2001)、腺苷酸环化酶(adenylyl cyclase, AC)基因(Wachtenetal., 2006)等在其他生物中被报道参与学习记忆,同时也在西方蜜蜂体内克隆出它们的同源体,推测这些基因可能参与蜜蜂的学习记忆过程。此外,已报道一些蛋白如钙调素(calmodulin, CaM)、鸟苷酸结合蛋白、蛋白激酶C(protein kinase C, PKC)、腺苷酸环化酶(adenylate cyclase, AC)、Ras(rat sarcoma)相关蛋白、cAMP(环磷酸腺苷cyclic adenosine monophosphate)-依赖性蛋白激酶A(cAMP-dependent protein kinase A)等与蜜蜂的学习记忆相关(Nishiyamaetal., 2003; Eisenhardt, 2006; 孟丽峰, 2018)。在蜜蜂嗅觉调节过程中,cAMP-依赖性蛋白激酶A的激活对于蜜蜂记忆形成至关重要,该基因的下调表达可能削弱蜜蜂条件反应的敏感性(Müller, 2000; 蔚添添, 2019)。
蜜蜂个体间的信息交流主要依赖敏锐的嗅觉,其敏锐的嗅觉系统能够感知蜂群内外环境中化学信号的变化(Conteetal., 2001)。在黑暗的巢房中,哺育蜂能够辨别饥饿幼虫与已饲喂幼虫,对亟待哺育的幼虫进行精确地饲喂;哺育蜂在人工组建蜂群中同样也会承担着清理巢房、酿造蜂粮等工作。这些重要的生理过程均离不开脑部学习记忆相关网络机制的调控,因此,研究哺育蜂的学习记忆在探讨蜜蜂幼虫生长发育、维护蜂群稳定等方面发挥重要的意义。目前尚未有对哺育蜂脑部形成学习记忆的分子调节网络机制的详细报道。
在本研究中,我们组建意大利蜜蜂Apismelliferaligustica人工蜂群,收集10日龄哺育蜂、21日龄哺育蜂和21日龄采集蜂;通过气味联想性学习记忆测定意大利工蜂在不同行为和不同日龄条件下学习记忆能力的差异;利用RNA-seq技术筛选出哺育蜂学习记忆相关的差异表达基因(differentially expressed genes, DEGs)。本研究旨在利用RNA-seq技术分析哺育蜂脑部学习中调控哺育蜂学习行为的相关DEGs,为深入研究哺育蜂学习行为相关调控的分子机制提供重要的理论参考,同时也为提高蜂群中工蜂哺育行为的学习效率提供新的视角。
1 材料与方法
1.1 实验蜂种
本实验所用的“蜂强1号”意大利蜜蜂蜂种来自福建农林大学动物科学学院(蜂学学院)蜂场(隶属亚热带季风气候,119°30′E, 26°08′N,海拔600~1 000 m)。
1.2 主要仪器及试剂
体视显微镜,冷光源仪器。DEPC水(上海生工生物公司);SYBR®Premix Ex TaqTMII (Tli RNaseH Plus)(TaKaRa公司)。75%酒精,干冰,碎冰,以及用水和蔗糖自行配制的50%蔗糖溶液。
1.3 标记蜜蜂及收集样品
实验所用蜂群为正常健康的5群强群,每群蜂中至少含有2~3张即将出房的封盖子脾。在组建新的蜂群之前,去除封盖子脾上的蜜蜂,放于恒温恒湿培养箱(温度34.5℃,相对湿度60%)中,每隔24 h用不同颜色的记号笔在刚出房的蜜蜂胸部或腹部做好标记,连续标记10 d,每天标记刚出房工蜂数目大约为3 000~5 000头。标记后投入由1头蜂王、1张蜜粉脾和1张幼虫脾组建的人工蜂群。
标记的工蜂发育到第10和21天时,收集头部伸到有幼虫巢房且持续时间超过10 s的工蜂作为哺育蜂;第21天时,在巢门口收集后足花粉筐中载有花粉的外勤蜂,将其作为采集蜂。按照这个要求,收集10日龄哺育蜂、21日龄哺育蜂和21日龄采集蜂。每次收集工蜂后对其进行PER实验。
1.4 PER实验
参考Frost等(2012)、Matsumoto等(2012)和蔚添添等(2017)的PER实验操作,将5~10头蜜蜂分别装入小玻璃瓶中,并冰浴处理。待蜜蜂冻晕后,快速固定于蔚添添等(2017)使用的固定装置中,用50%的蔗糖溶液碰触蜜蜂触角确保吻部能自由活动的个体用于后续实验。为了减少固定对蜜蜂的影响,将固定后的蜜蜂在恒温恒湿培养箱(温度30℃,相对湿度40%)中黑暗放置2 h。PER测定时,先给予1-壬醇气味刺激(2 s),然后再给予1-壬醇气味刺激同时用50%蔗糖溶液碰触蜜蜂触角(2 s),最后糖水奖励伸喙蜜蜂(2 s);而对照组气味学习时,只给予己醇气味刺激,没有50%蔗糖碰触触角,也没有糖水奖励。同时为了排除学习顺序对学习的影响,每组蜜蜂依次按照1-壬醇(实验学习)和己醇(对照学习)、1-壬醇和己醇、己醇和1-壬醇、己醇和1-壬醇、1-壬醇和己醇的顺序重复学习5次,分别记为C1, C2, C3, C4和C5。每次学习行为训练结束后,间隔10 min,再进行下次学习行为训练。在5次学习中,在前2 s只给予气味刺激,并记录蜜蜂伸喙状况,对1-壬醇气味刺激表现出喙伸反应的蜜蜂,表明已建立1-壬醇气味与50%蔗糖溶液之间的关联性学习,反之表明未建立。理论上己醇气味刺激的蜜蜂不出现喙伸反应。蜜蜂5次学习完成后,在黑暗环境下恢复2 h后测定记忆,1-壬醇气味刺激后,蜜蜂表现出喙伸反应,则表明该蜜蜂对1-壬醇气味具有记忆能力;反之则表明不具有。
统计每个采样点样本在C1, C2, C3, C4和C5的5次重复实验中蜜蜂对1-壬醇气味及2 h后对1-壬醇气味的伸喙情况,喙伸反应率(%)=(发生喙伸反应的蜜蜂数/受试蜜蜂数)×100。
1.5 哺育蜂脑部学习记忆相关DEGs的表达水平分析
1.5.1样品采集:按上述1.4节PER实验结束后,统计每头蜜蜂5次重复实验的学习情况,学会3次及以上个体认为该头蜜蜂已经具有学习能力;1次都没有学会的认为不具有学习能力。将具有学习能力的10日龄哺育蜂(L_10d)、不具有学习能力的10日龄哺育蜂(NL_10d)、具有学习能力的21日龄哺育蜂(L_21d)、不具有学习能力的21日龄哺育蜂(NL_21d)4组样品收集,用于后续RNA-seq。
1.5.2大脑解剖:参考赵元洪等(2014)解剖蜜蜂大脑方法,解剖上述4组样品的脑部,每组解剖10~15头蜜蜂的大脑,每组均设置3个生物学重复。放入-80℃,待后续使用。
1.5.3实验组样品cDNA文库构建及Illumina测序:L_10d的3个生物学重复分别为L_10d_1, L_10d_2和L_10d_3; NL_10d的3个生物学重复分别为NL_10d_1, NL_10d_2和NL_10d_3; L_21d的3个生物学重复分别为L_21d_1, L_21d_2和L_21d_3; NL_21d的3个生物学重复分别为NL_21d_1, NL_21d_2和NL_21d_3。委托北京诺禾致源生物有限公司开展总RNA质量控制、cDNA文库构建和Illumina测序。
1.5.4哺育蜂学习记忆相关DEGs:根据FPKM(fragments per kilobase of exon per million fragments mapped)值法计算每个基因在4组样本中的表达量。 利用DESeq2软件分析DEGs,筛选标准为P<0.05(Anders and Huber, 2010),其中log2Fold change>0和log2Fold change<0分别作为筛选上调和下调DEGs的标准。首先分别比较10日龄哺育蜂中具有学习能力(L_10d)和不具有学习能力(NL_10d)个体、21日龄哺育蜂中有学习能力(L_21d)和不具有学习能力(NL_21d)个体、10日龄和21日龄哺育蜂中具有学习能力(L_10和L_21d)的个体、10日龄和21日龄哺育蜂中不具有学习能力(NL_10d和NL_21d)个体之间的DEGs。为了筛选与哺育蜂学习记忆相关的DEGs,我们利用韦恩图分析L_10dvsNL_10d和L_21dvsNL_21d之间共有DEGs,同时去除L_10dvsL_21d和NL_10dvsNL_21d这两组中包含的DEGs,剩余的DEGs便是与哺育蜂学习记忆密切相关的基因。
1.5.5qPCR分析:在DEGs中随机选取3个基因。利用Primer Premier 6设计特异性引物(表1),qPCR验证。反应体系: SYBR Premix Ex Taq Ⅱ 5 μL, 上下游引物(2 μmol/L)各1 μL, 模板(500 ng/μL) 2 μL, ddH2O补充至10 μL。PCR程序: 95℃预变性30 s; 95℃变性5 s, 60℃退火30 s, 共 40个循环; 65℃开始,每5 s上升0.5℃,直至上升到95℃。整个反应程序在荧光定量PCR仪(Bio-Rad公司)上进行,按照说明书进行操作。以2-△△Ct法计算哺育蜂脑部DEGs的相对表达量,其中以Actin(GenBank登录号: NM_001185146.1)作为内参基因。
1.6 数据分析
采用SPSS20.0软件对数据进行处理,实验结果采用平均值±标准误表示。蜜蜂的喙伸反应率(PER%)的测定采用卡方测验(χ2test)进行显著性统计分析,P<0.05表示差异显著,P<0.01表示差异极显著。采用单因素方差分析(ANOVA)qPCR中哺育蜂脑部TpnCⅢa,MED23和Pkc基因在不同样本中表达量的差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。

表1 引物列表Table 1 Primer list
2 结果
2.1 意大利蜜蜂不同日龄工蜂学习记忆能力的比较
随着训练次数的增加,10日龄哺育蜂(n=71)和21日龄采集蜂(n=74)经5次训练(C1, C2, C3, C4和C5)对1-壬醇气味的喙伸反应率整体呈现上升趋势,且10日龄哺育蜂经过2次训练后的喙伸反应率均显著低于21日龄采集蜂(C2: χ2=17.14,P=0.017<0.05; C3: χ2=24.97,P=0.015<0.05; C4: χ2=32.81,P=0.003 <0.01; C5: χ2=34.28,P=0.000<0.001)(图1: A)。随着训练次数的增加,10日龄哺育蜂和21日龄哺育蜂(n=87)经训练后对1-壬醇气味的喙伸反应率逐渐上升,且经过5次训练后21日龄哺育蜂的喙伸反应率显著高于10日龄哺育蜂(C1: χ2=3.15,P=0.014<0.05; C5: χ2=35.05,P=0.001<0.01),表明日龄因素显著影响哺育蜂的学习能力(图1: A)。同样地,随着训练次数的增加, 21日龄哺育蜂和21日龄采集蜂经训练后对1-壬醇气味的喙伸反应率逐渐上升, 经过二次学习后, 21日龄采集蜂的喙伸反应率均高于21日龄哺育蜂,但只有在第2次学习后21日龄采集蜂的喙伸反应率显著高于21日龄哺育蜂(C2: χ2=18.39,P=0.04<0.05),而经过第3-5次学习后均没有显著差异,表明行为(哺育/采集)没有显著影响蜜蜂学习能力(图1: A)。
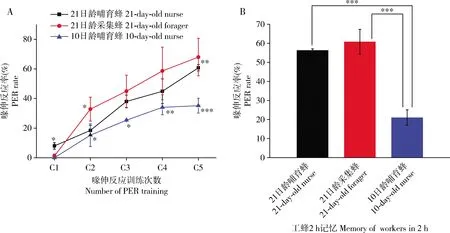
图1 意大利蜜蜂不同日龄工蜂学习(A)和记忆(B)能力的比较Fig. 1 Comparison of learning (A) and memory (B) abilities of Apis mellifera ligustica workers at different day-oldC1-C5: 表示喙伸反应训练次数Number of proboscis extension reflex (PER) training. 红色星号表示21日龄哺育蜂和21日龄采集蜂喙伸反应率差异显著;绿色星号表示21日龄哺育蜂和10日龄哺育蜂喙伸反应率差异显著;蓝色星号表示10日龄哺育蜂和21日龄采集蜂喙伸反应率差异显著。图中数据为平均值±标准误,星号、双星号和三星号分别表示P<0.05, P<0.01和P<0.001水平差异显著(卡方测验)。Red asterisk indicates significant difference in the PER rate between the 21-day-old nurses and the 21-day-old foragers. Green asterisk indicates significant difference in the PER rate between the 21-day-old and the 10-day-old nurses. Blue asterisk indicates significant difference in the PER rate between the 10-day-old nurses and the 21-day-old foragers. Data in the figure are mean±SE. The asterisk, double asterisk and tri-asterisk indicate significant differences at P<0.05, P<0.01 and P<0.001, respectively (χ2 test).
学习后2 h后,10日龄哺育蜂的记忆能力低于21日龄采集蜂,且两者之间差异显著(χ2=29.38,P=0.000<0.001);21日龄哺育蜂的记忆能力显著高于10日龄哺育蜂(χ2=28.76,P=0.000<0.001),而21日龄哺育蜂的记忆能力低于21日龄采集蜂,但两者之间无差异显著性,表明日龄是影响哺育蜂记忆能力的重要因素(图1: B)。
2.2 具有或不具有学习能力的意大利蜜蜂哺育蜂脑部RNA-seq测序数据概述
为了全面分析意大利蜜蜂哺育蜂中具有学习能力个体与不具有学习能力个体脑中基因的表达变化,我们根据PER结果,将样本分为4组: L_10d, NL_10d, L_21d, NL_21d,并解剖取其大脑组织,进行RNA-seq测序,有效读段数为50 252 002-67 617 298之间,样本的单一匹配率均在83%以上,Q30值也都在92%以上,说明RNA-seq数据质量较好,测序数据可靠性高(表2)。
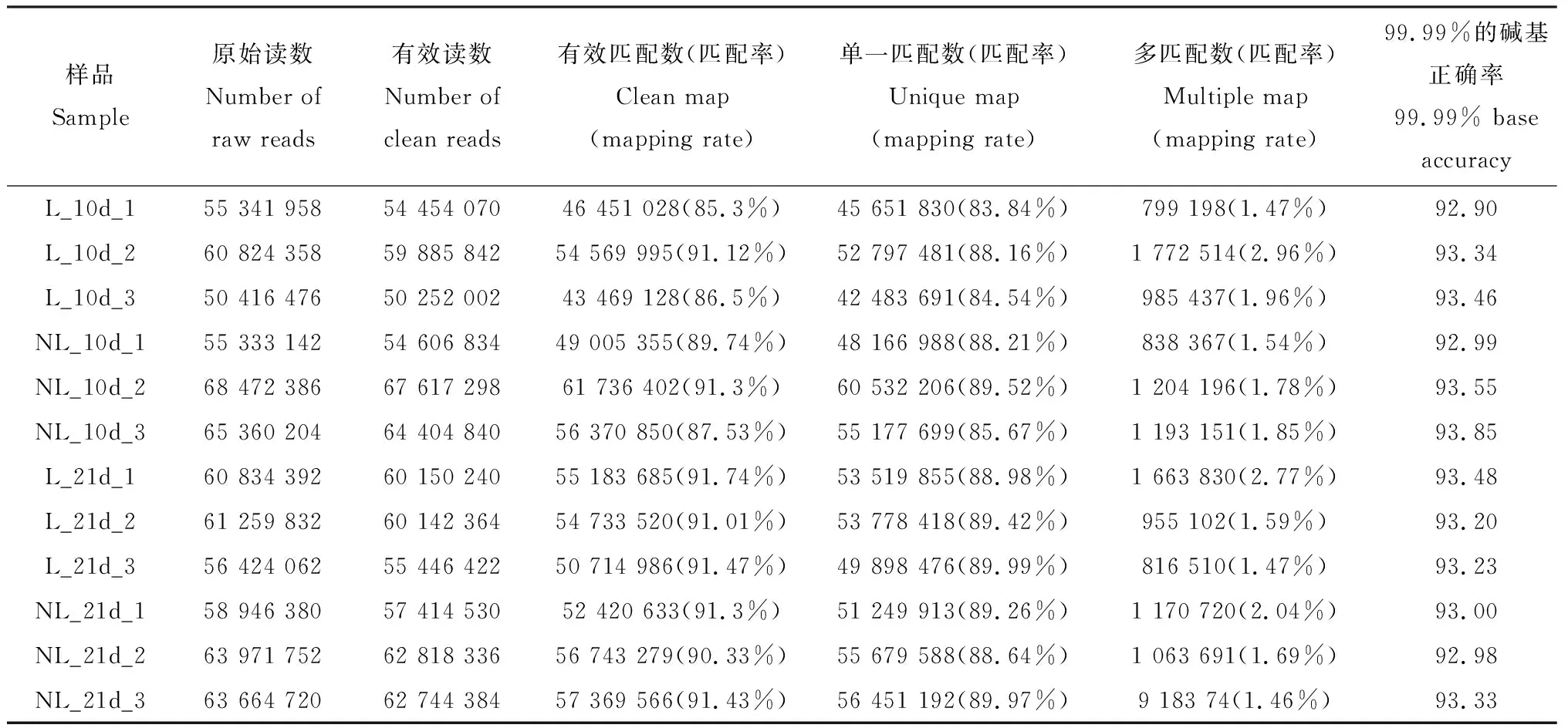
表2 具有或不具有学习能力的意大利蜜蜂哺育蜂脑部转录组数据质量统计Table 2 Quality statistics of the brain transcriptome data of Apis mellifera ligustica nurses with or without learning ability
L_10d_1-3: 分别表示10日龄哺育蜂具有学习能力组的3个生物学重复Three biological replications of 10-day-old nurses with learning ability, respectively; NL_10d_1-3: 分别表示10日龄哺育蜂不具有学习能力组的3个生物学重复Three biological replications of 10-day-old nurses without learning ability, respectively; L_21d_1-3: 分别表示21日龄哺育蜂具有学习能力组的3个生物学重复Three biological replications of 21-day-old nurses with learning ability, respectively; NL_21d_1-3: 分别表示21日龄哺育蜂不具有学习能力组的3个生物学重复Three biological replications of 21-day-old nurses without learning ability, respectively. 下同The same below.
2.3 意大利蜜蜂哺育蜂脑中学习记忆相关DEGs的筛选及趋势分析
韦恩图分析发现:10日龄哺育蜂脑中具有学习能力和不具有学习能力个体之间(L_10dvsNL_10d)有366个DEGs;21日龄哺育蜂中有学习能力和不具有学习能力个体之间(L_21dvsNL_21d)有876个DEGs;10日龄和21日龄哺育蜂中具有学习能力的个体(L_10dvsL_21d)之间有1 237个DEGs;10日龄和21日龄哺育蜂中不具有学习能力个体(NL_10dvsNL_21d)之间有341个DEGs。L_10dvsNL_10d和L_21dvsNL_21d共有135个DEGs。这135个共有DEGs可能与哺育蜂的发育日龄、学习记忆等有关。为了排除发育日龄的影响,我们去除L_10dvsL_21d和NL_10dvsNL_21d两组中与135个DEGs也存在交集的47个DEGs,最终我们筛到88个可能与哺育蜂学习记忆密切相关的基因(图2: A)。
聚类分析发现88个DEGs中,在哺育蜂脑中上调的基因有18个,下调的基因有70个(图2: A),其中高量表达的DEGs集中在NL_10d和NL_21d,而在L_10d和L_21d中高量表达的DEGs相对较少(图2: B)。在上调DEGs中发现编码肌钙蛋白基因TpnⅠ和TpnCⅢa,下调DEGs中发现Pkc,Pka-R1以及编码C3-岩藻糖基转移酶A的基因Fucta。
2个上调基因TpnI和TpnCⅢa在L_10d中的表达量显著性高于NL_10d中的,其中TpnI上调4倍左右,而TpnCⅢa在L_10d和NL_10d两组样本中表达量较高(18 3个下调基因Pkc,Pka-R1和Fucta在L_10d中的表达量显著性低于NL_10d中的,Pkc在这2组样品中的表达量较大(31 此外,我们在上调DEGs中发现到一个微量表达的基因Exn(神经细胞鸟苷酸置换因子)(3.57 图2 意大利蜜蜂哺育蜂脑中学习记忆相关DEGs表达趋势分析图Fig. 2 Expression trend of DEGs related to learning and memory in the brain of Apis mellifera ligustica nursesA: 不同样本间DEGs的韦恩图Venn diagram of DEGs among different samples; B: 88个DEGs表达量聚类热图Expression clustering hot map of 88 DEGs. 图中上箭头代表上调;下箭头代表下调。In the figure, the upward arrow means up-regulated, while the downward means down-regulated. 图3 意大利蜜蜂哺育蜂脑中学习记忆相关差异表达基因(DEGs)的GO和KEGG功能富集分析Fig. 3 GO and KEGG functional enrichment analysis of differentially expressed genes (DEGs) related to learning and memory in the brain of Apis mellifera ligustica nursesA, B: 分别为上调和下调DEGs的GO富集分类 GO enrichment classification of up-regulated and down-regulated DEGs, respectively; C, D: 分别为上调和下调DEGs的KEGG富集通路KEGG enrichment pathway of up-regulated and down-regulated DEGs, respectively. 图中只列出了GO富集功能上排名前30位的通路。Only the top 30 pathways in GO enrichment function were listed in the figure. DEGs功能主要集中在细胞组分、生物学进程和分子功能。在细胞组分分类中,上调DEGs(图3: A)主要富集在细胞骨架和细胞器相关,如肌动蛋白细胞骨架、细胞骨架组分、细胞内非膜结合细胞器、细胞内细胞器组分、细胞器组分等;下调DEGs(图3: B)主要富集在细胞器相关,如细胞内膜结合细胞器、膜结合的细胞器、细胞器包膜等。在生物学进程分类中,上调DEGs(图3: A)主要富集在信号转导、蛋白质加工修饰相关,如Ras蛋白信号转导、调节Ras蛋白信号转导、调节细胞内信号转导、蛋白质磷酸化;下调DEGs(图3: B)富集在转录、信号转导、蛋白质生物合成相关,其中显著性富集在转录相关,如调控转录/DNA模板化、调节RNA代谢过程、调控核酸模板转录、RNA生物合成过程的调节等。在分子功能方面,上调DEGs(图3: A)主要富集在酶活性、离子结合相关,如蛋白激酶活性、金属离子结合、钙离子结合、阳离子结合等;下调DEGs(图3: B)主要富集在酶活性相关,如核苷-三磷酸酶活性、焦磷酸酶活性、作用于含磷酸酐中的水解酶活性、磷酸二酯水解酶活性、磷脂酶活性等。 通过KEGG富集分析,我们发现上调表达的DEGs显著性富集在嘌呤代谢、过氧化物酶体、药物代谢-其他酶这3个通路(图3: C);而下调表达的DEGs主要富集在吞噬、光转导、AGE-RAGE信号通路、肌醇磷酸代谢、磷脂酰肌醇信号系统、Wnt信号通路、蛋白质输出、鞘脂代谢、糖酵解/糖异生、Hippo信号通路、mTOR信号通路、内质网中的蛋白质加工、RNA转运,其中吞噬、光转导、AGE-RAGE信号通路为显著性富集(图3: D)。 为验证测序数据的准确性,从88个DEGs中选取2个上调基因(TpnCⅢa和MED23)和1个下调基因(Pkc),结果显示这些基因的表达水平的趋势变化与RNA-seq数据中的变化趋势一致(图4),证实了测序结果的可信性。 图4 意大利蜜蜂哺育蜂脑中学习记忆相关差异表达基因(DEGs)的表达分析Fig. 4 Expression analysis of differentially expressed genes (DEGs) related to learning and memory in the brain of Apis mellifera ligustica nursesA, B, C: 分别表示qPCR方法检测TpnCⅢa, MED23和Pkc在4组样本脑中的相对表达量Relative expression level of TpnCⅢa, MED23 and Pkc in four brain samples using qPCR, respectively; D, E, F: 分别表示RNA-seq中TpnCⅢa, MED23和Pkc在4组样本脑中的表达量Expression levels of TpnCⅢa, MED23 and Pkc in RNA-seq in four brain samples, respectively. 图中数据为平均值±标准误。Data in the figure are mean±SE. *P<0.05; **P<0.01; ***P<0.001 (单因素方差分析One-way ANOVA). PER实验大量用于监控杀虫剂(蔚添添等, 2017)、吗啡(Chenetal., 2014)等生物化学药品对蜜蜂的亚致死影响;PER实验也用于探究不同日龄采集蜂学习记忆能力的差异(Arenas and Farina, 2008),但鲜有关于利用PER实验开展哺育蜂脑部学习记忆相关基因表达变化的研究报道。本研究利用从人工组建蜂群中收集的10日龄哺育蜂、21日龄哺育蜂、21日龄采集蜂展开PER实验,对比不同日龄不同行为条件下学习记忆能力的差异;利用RNA-seq技术筛选出与哺育蜂学习记忆密切相关的88个DEGs,结合GO功能富集和KEGG通路富集对这88个DEGs的表达模式也进行了分析。 我们的实验结果表明,21日龄采集蜂和21日龄哺育蜂的学习能力均显著高于10日龄哺育蜂,21日龄采集蜂的学习能力高于21日龄哺育蜂,但无显著差异;10日龄哺育蜂的记忆能力显著低于21日龄采集蜂和21日龄哺育蜂,而21日龄哺育蜂的记忆能力低于21日龄采集蜂,但无显著差异(图1)。本研究表明21日龄采集蜂的学习和记忆能力明显高于10日龄哺育蜂,两者之间的差异不仅由于21日龄采集蜂的神经系统发育较10日龄哺育蜂的相对完善之外,也可能由于采集蜂外出采集寻找蜜粉源等巢外飞行经验(刘晰文等, 2014; 王超等, 2014);除哺育和采集等行为介导产生的学习记忆能力差异外,日龄也会对学习记忆能力产生差异,青年工蜂的学习能力较年长工蜂而言普遍较差(Ray and Ferneyhough, 1997; Laloietal., 2001),本研究结果显示21日龄哺育蜂的学习和记忆能力显著高于10日龄哺育蜂。 在果蝇Drosophila中,钙网蛋白在嗅觉系统功能和气味引导行为中起着关键作用(Stoltzfusetal., 2003),钙网蛋白对整合素介导的Ca2+信号结合而产生的钙信号传导和细胞黏附是必需的(Coppolinoetal., 1997);而Ca2+介导的信号传导是蜜蜂蘑菇体学习和记忆的基础(孟丽峰, 2018);Garcia等(2009)通过蛋白质组学比较分析哺育蜂和采集蜂脑部表达的相关蛋白,哺育蜂脑部检测到上调表达的钙网蛋白同源体1类似物,这一来自果蝇的同源蛋白很可能在哺育蜂脑部发挥嗅觉作用。意大利蜜蜂以及其他昆虫和脊椎动物中嗅小球的高浓度F-肌动蛋白最可能与高度突触和结构有关(Rössleretal., 2002; Grohetal., 2006),而突触的变化很可能在级型分化和日龄特异性的行为中起到因果作用(Garciaetal., 2009)。本研究在上调DEGs虽未发现钙网蛋白相关基因的表达,但在其GO分类中发现TpnCIIIa富集在Ca2+结合一类中,TpnI富集在肌动蛋白细胞骨架一类中,而TpnCIIIa和TpnI这两个基因在上调DEGs中的表达量相对较高,它们在L_10d中的表达量显著性高于NL_10d中的,在L_21d中的表达量显著性高于NL_21d中的(图4: A)。TpnI和TpnC都属于肌钙蛋白复合物的组分,TpnCIIIa属于TpnC基因型组中的一类基因型;TpnC感知细胞内钙水平的增加并诱导原肌球蛋白-肌钙蛋白复合物中的构象变化,从而引发收缩反应(Herranzetal., 2005)。学习和记忆过程需要将细胞外刺激转化为细胞内信号(Diaoetal., 2018),我们推测哺育蜂脑部TpnCIIIa介导Ca2+结合而产生钙信号传导激发其学习行为,同时TpnI基因介导的相关肌动蛋白,如F-肌动蛋白等,进一步改变哺育蜂脑部神经元细胞相关的突触结构变化,产生哺育蜂不同日龄的学习差异现象;肌钙蛋白在哺育蜂学习过程中的功能可能类似于钙网蛋白,可以通过动员细胞内外与联想记忆相关的Ca2+,从而促进哺育蜂的学习记忆能力。学习记忆过程需要把胞外刺激信号转变为胞内信号,这一过程需要信号的转导,而Ras相关蛋白与蜜蜂的学习记忆相关(王子龙等, 2017; 孟丽峰, 2018)。上调DEGs中发现Exn在GO分类中富集在信号传导功能一类上,其中包括Ras蛋白信号转导;Exn介导的信号转导过程在学习记忆形成过程可能发挥重要促进作用。据此,我们推测Ca2+与细胞内的相关靶蛋白结合,在信号转导相关条件催化下,激活蛋白质激酶,促进蛋白质酶磷酸化,从而刺激细胞收缩,引发学习行为。 cAMP/PKA/CREB信号通路与学习记忆之间有着重要的联系,cAMP与PKA结构亚基上的位点结合,具有催化活性的PKA调节亚基解离并进入核内,磷酸化CREB从而启动下游靶基因的转录,合成与学习记忆相关的蛋白(杨夏等, 2011)。学习记忆过程需要信号转导调节胞外刺激信号转变为胞内信号,长期记忆的形成涉及多条信号传递途径,其中包括cAMP-PKA途径,cAMP浓度升高激活PKA,是激素调控细胞代谢或基因表达的主要途径(王子龙等, 2017);cAMP能够激活蜜蜂脑部的PKA,从而调控与蜜蜂学习记忆相关蛋白质的合成(Menzel, 1999)。磷酸二酯酶4是cAMP的一种特异性水解酶,其可以调节cAMP/PKA/CREB信号通路,磷酸二酯酶4能够调节近端cAMP触发的活性,也能够调节远端cAMP活性以及PKA催化亚基向核内的迁移,导致细胞内参与学习记忆相关的蛋白质不能合成(杨夏等, 2011; O′Banionetal., 2019)。磷脂酰肌醇信号系统可激活下游PKA和PKC通路,通过调节转录和翻译的过程来调节学习和记忆能力(孟丽峰, 2018);光传导通路中的G-蛋白耦联受体通路也是蜜蜂蘑菇体学习和记忆的基础,GTPase激活蛋白GAP,增强小G蛋白的GTP酶活性,催化GTP水解为GDP,使小G蛋白失活,是负调控因子(孟丽峰, 2018)。我们在下调DEGs的KEGG通路中也发现Pkc和Fucta富集的磷脂酰肌醇信号;Pkc和Arp1均显著性富集在与学习记忆相关的光传导通路上,GO分类中LOC408782和LOC408388富集的GTPase活性可能增强光传导通路中GTPase的负调控强度。PKA和PKC两种激酶在蜜蜂学习记忆中发挥重要作用,而在具有学习能力的哺育蜂脑组织中Pkc和Pka-R1下调,暗示它们在哺育蜂学习过程中可能发挥负调控的作用。GO分析中发现Fucta富集在磷酸二酯水解酶活性这一功能上,推测在具有学习能力的哺育蜂脑组织中富集在磷酸二酯水解酶的相关基因下调表达,从而促进了细胞内与学习记忆相关蛋白合成,提高了具有学习能力哺育蜂的学习能力(Menzel, 1999; 杨夏等, 2011)。 我们通过RNA-seq技术发现TpnCIIIa,TpnI,Exn,Pkc和Pka-R1等在哺育蜂脑部差异表达,这为后续深入研究蜜蜂学习记忆相关分子机制方面提供理论参考价值。

2.4 意大利蜜蜂哺育蜂学习记忆相关DEGs的GO功能注释分析
2.5 意大利蜜蜂哺育蜂脑中学习记忆相关DEGs的KEGG调控网络分析
2.6 意大利蜜蜂哺育蜂脑中学习记忆相关DEGs的qPCR验证

3 讨论
