鲁西寒武系凝块石萜类生物标志物特征
2020-05-12韩作振刘凯旋宋志刚
韩作振,刘凯旋,任 祥,宋志刚
(1.山东科技大学 地球科学与工程学院,山东 青岛 266590; 2.海洋矿产资源实验室,青岛海洋科学与技术试点国家实验室,山东 青岛 266071)
凝块石作为微生物岩的一种重要类型,受到国内外学者的广泛关注。最初,Aitken[1]将凝块石定义为具有宏观凝块组构,并区别于其他具有显微凝块组构的微生物碳酸盐岩,但凝块状结构与叠层结构的混淆以及隐藻结构的不全面性问题并没有解决。Ruding等[2]定义了微生物碳酸盐岩,将凝块石与叠层石区分开来,与树形石、均一石一起划为微生物岩的四大类。自前寒武纪以来,大量微生物碳酸盐岩均由钙化微生物形成,但蓝绿藻等微生物大都不具有钙化骨骼,因此未留下实体化石,对于成岩微生物类型的研究造成一定困难。华北地台寒武系微生物碳酸盐岩中管状蓝细菌多为葛万菌(Girvanella),而凝块石中仅在镜下观察到蓝细菌活动痕迹或只能通过整体的沉积构造(如钙化丝状体、管状构造以及捕获得的沉积物)来识别,尚未有充足证据显示其他类型微生物参与成岩作用[3]。在现代实验室研究中,微生物等碳氢化合物在沉积成岩过程中会被其他微生物改造降解[4]。在微生物与沉积环境相互关系的研究中,有充足的微生物证据,才能对微生物岩做出科学的解释[5]。
蓝细菌因具钙化能力很难被其他微生物降解,实验证明难降解的有机基质中细菌易被捕获而留存[6]。随着现代分子生物学及有机化学检测技术的进步,生物标志化合物所具有的独特稳定性有助于发现无实体化石的微生物证据。本研究通过分析鲁西寒武系张夏组和炒米店组凝块石中生物标志物的类型、含量及其分布,探讨凝块石的沉积环境和参与成岩的微生物类型。
1 地质概况
研究区位于山东省临沂市沂水县马站镇(如图1),其所在的华北地台于早寒武世筇竹寺—龙王庙期开始接受沉积,寒武纪期间,基本没有大的构造沉降,属典型的陆表海潜水沉积盆地[7]。研究区所属的鲁西地块为华北板块东南部地质分区,位于郯庐断裂带以西,是一个独立断块,西侧边界为聊城—兰考断裂,北侧以齐河—广饶断裂为界,东南侧以安丘—营县断裂为界。该区寒武纪地层普遍发育较好、出露连续。凝块石产出于张夏组和炒米店组,尤以张夏组凝块石最为典型。
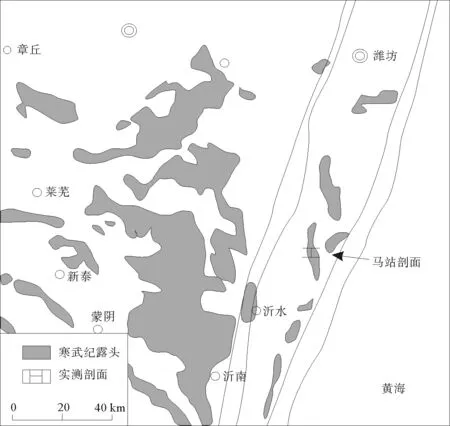
图1 临沂市沂水县马站镇剖面位置图
2 凝块石特征
实验所需凝块石采自沂水马站镇杨庄寒武系张夏组,呈无明显构造特征的块状构造、生物层构造和生物丘构造。具层状构造的凝块石,单层厚度一般为几厘米到十几厘米不等,由底到顶变化不大,分布较为稳定(如图2(a))。而生物丘构造则形态大小不一,整体呈同心弧向外发散,其高度和宽度大小相当,由几十厘米到几米不等块状构造(如图2(b))。具生物丘构造的凝块石生物丘之间呈相切、相交包裹等接触关系。研究区亦有巨厚层凝块灰岩出露,其厚度达3 m以上。

(a) 生物层构造凝块石; (b) 生物丘构造凝块石
通过样品观察,凝块石呈典型的凝块结构,由颜色较深的微生物团块与灰泥沉积物混杂构成(图3)。鲁西寒武系凝块石可划分为斑状凝块石、网状凝块石和树枝状凝块石[8]。本次实验选取的是张夏组与炒米店组最为典型的斑状凝块石(图4)。

(a) 抛光面图; (b) 野外露头观察图
结合野外剖面观察以及室内镜下分析,凝块石的深色团块是由蓝细菌及周围泥晶方解石凝结而成的(图5(a)、5(b))。团块之间为泥晶方解石或少量亮晶方解石和自形一半自形的白云石胶结(图5(c)、5(d))。另外,显微镜观察发现少量黄铁矿(FeS2),其特征为边缘不规则,在透色光下为黑色,反射光下呈浅黄铜色,边部被红褐色氧化铁或褐铁矿(FeO·OH·nH2O)包围(图6)。
3 样品处理方式及仪器测定
碳酸盐岩中有机质含量较低,甚至达不到抽提标准(总有机碳(total organic carbon,TOC)≥1%)。但若取得足够的岩石样品,生标参数对于生源、古环境等分析仍是可靠的依据[9]。为避免渗入岩石表面孔隙的现代微生物干扰,在室内将样品表面进行抛光处理,将表面风化的物质剥离,只保留其内部新鲜部分。同时将样品放入超声波清洗仪中进行初次清洗。为收集到足量的氯仿沥青“A”(据行业标准,色质实验样品15 mg),对岩样进行多次索氏抽提。
注:+号位置为采样地点标记
为获得准确的生标信息,碎样前用氯仿淋洗去因空气接触造成的微生物污染。样品在室温下自然晾干,粉碎至颗粒直径为0.09 mm以下,取50 g放入氯仿抽提用滤纸袋中,使用二氯甲烷和甲醇(体积比为2∶1)混合溶剂进行索氏抽提72 h。然后将抽提物蒸干,并采用不同极性的溶剂将其中的饱和烃、芳香烃和非烃馏分分别淋洗出,驱赶溶剂,称量并求得试样中各组分的含量。得到饱和烃、芳香烃、非烃及沥青质四种族组分物质。随后将饱和烃物质族分进行气相色谱—质谱联用仪(gas chromatography-mass spectrometer,GC-MS)分析。
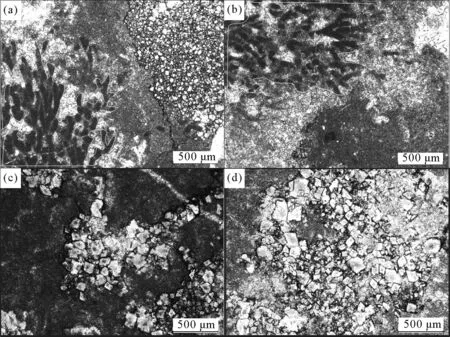
(a),(b)含附枝菌等蓝细菌的凝块石;(c),(d)裂隙充填白云石的凝块石

(a) 反射光; (b) 透射光

表1 样品氯仿沥青“A”中饱和烃含量
实验使用气相色谱质谱联用仪(安捷伦5977BMSD),检测标准为GB/T18606—2017气相色谱-质谱法测定沉积物中生物标志物。色谱柱规格为DB—5MS石英毛细管色谱柱(30 mm×0.25 mm×0.25 μm),载气为高纯He,恒流,流速为1.0 mL/min。质谱条件:电子轰击源(EI+),离子源温度为230 ℃。预先使用SCAN全扫描目标物的质谱信息,选择特征定性定量离子后用SIM模式检测。得出总离子流图(TIC),根据谱图的特征、相保留时间,结合系统自带NIST谱库进行化合物鉴定,根据色谱峰积分面积进行定量计算。
4 实验结果与分析
本研究选取鲁西寒武系张夏组较为典型的凝块石进行分析,分别抽提了4组样品,在氯仿沥青“A”族组分分离中用于色质分析的饱和烃提取量如表1所示。
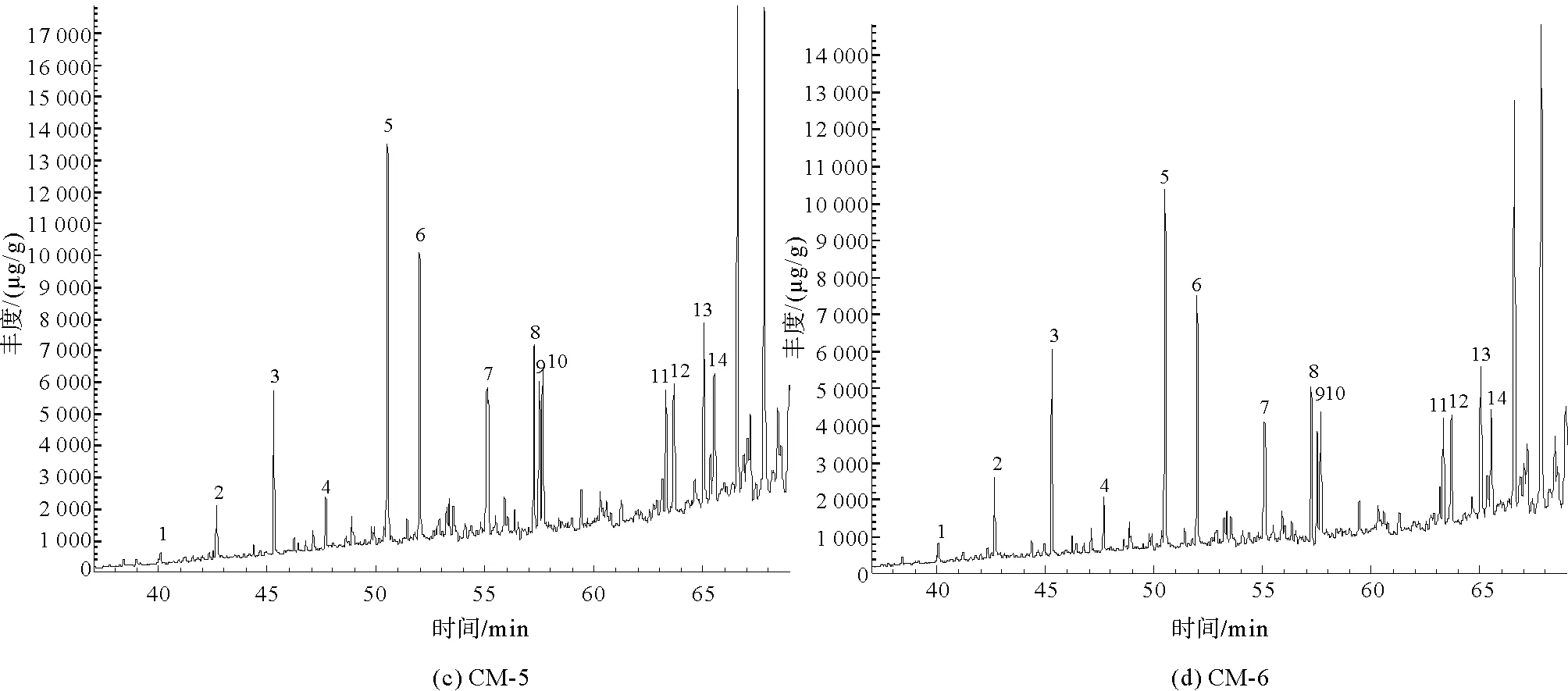
在进行GC-MS分析之后,4组样品在m/z=191的总离子流图如图7所示。
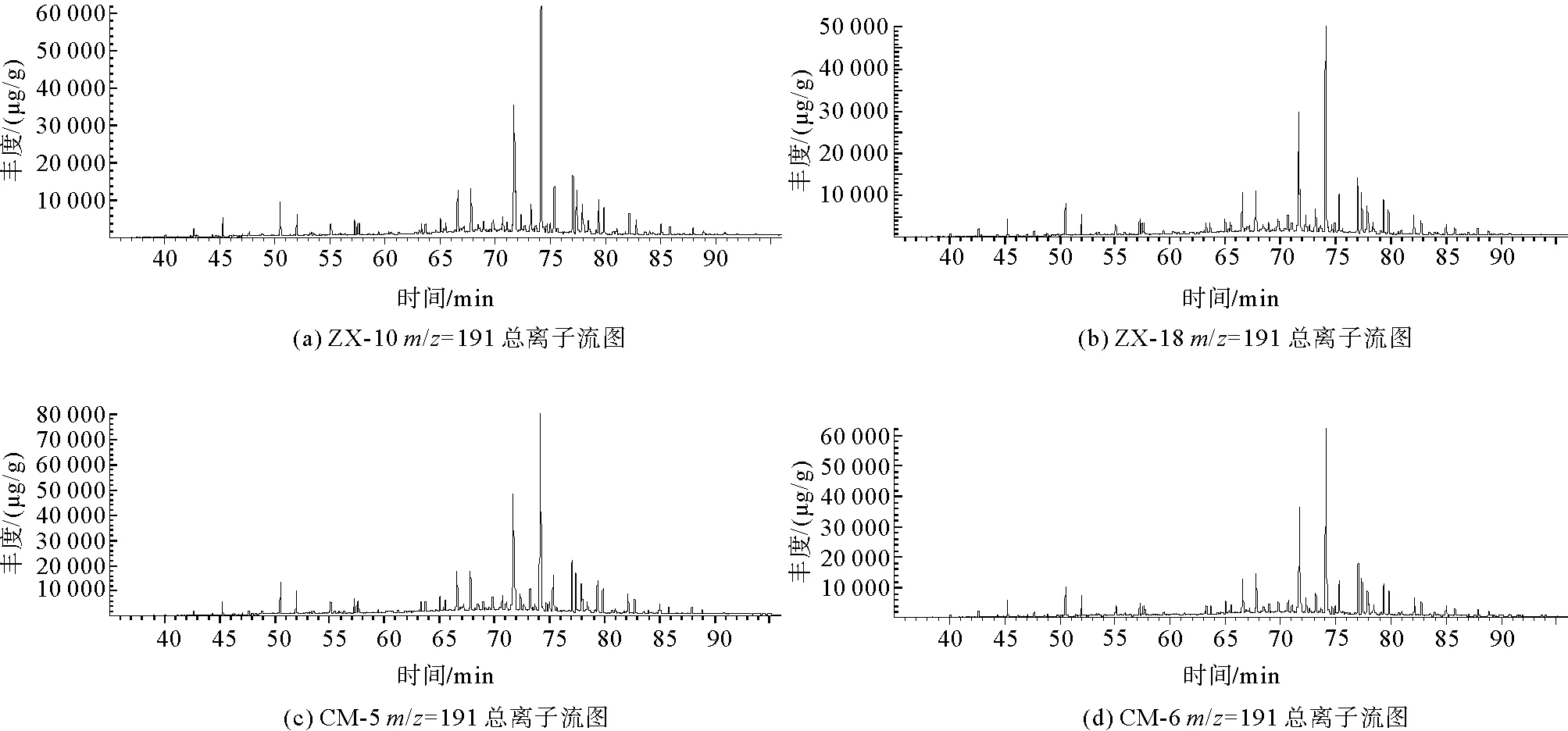
图7 凝块石GC-MS总离子流图(TIC)
经NIST谱库匹配计算后,m/z=191总离子流图中碳数主要分布在nC21~nC35之间,含有一定量的三环萜烷、降霍烷、霍烷及升霍烷等化合物。
4.1 三环萜类化合物分析
4.1.1 三环萜类化合物测定结果
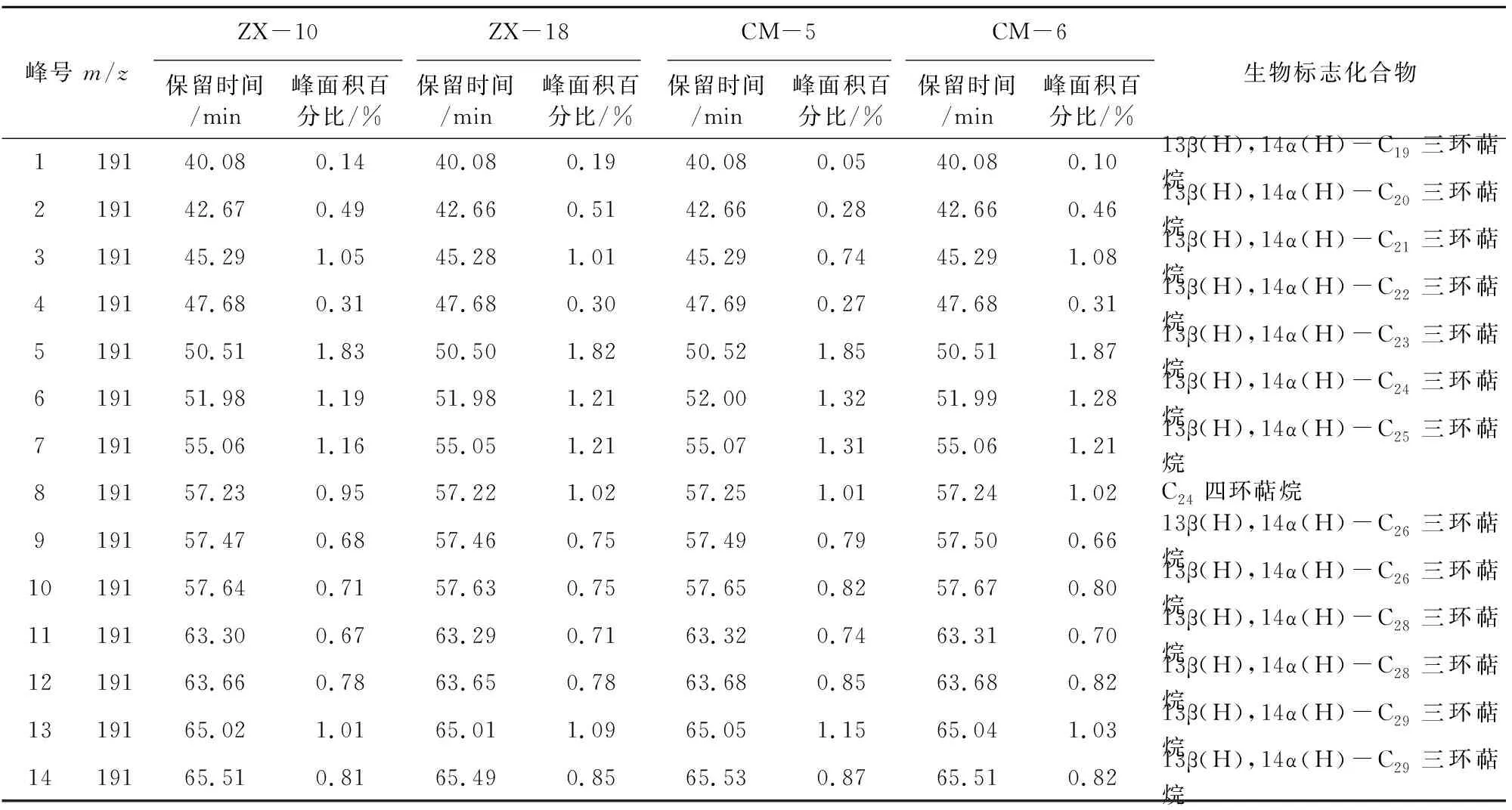
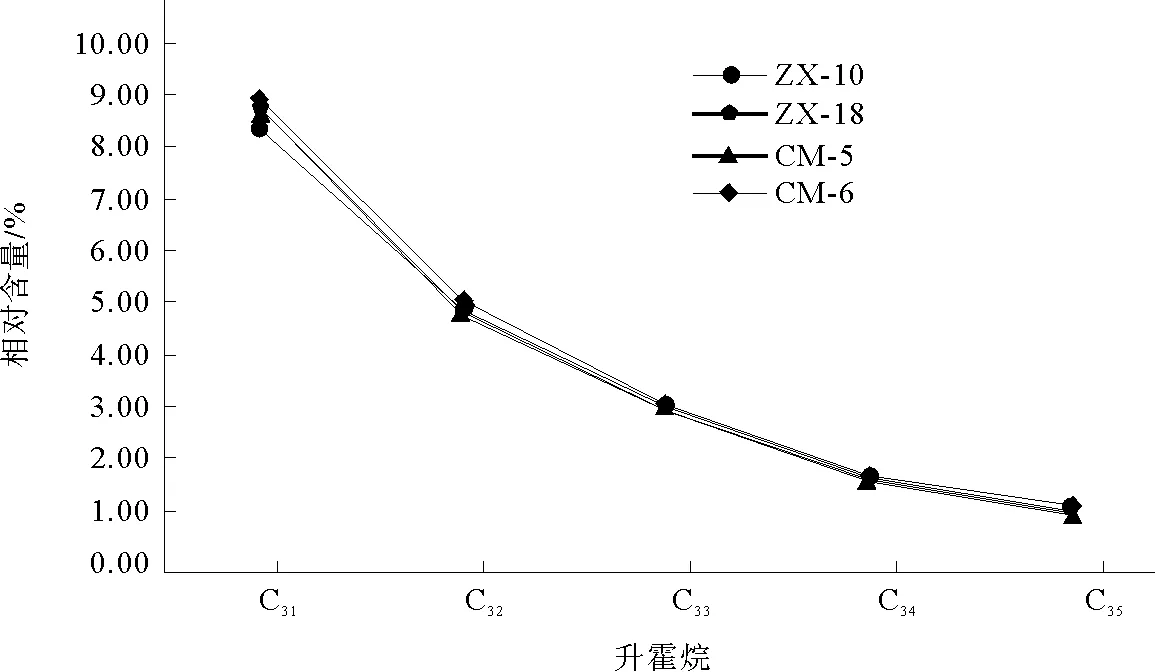
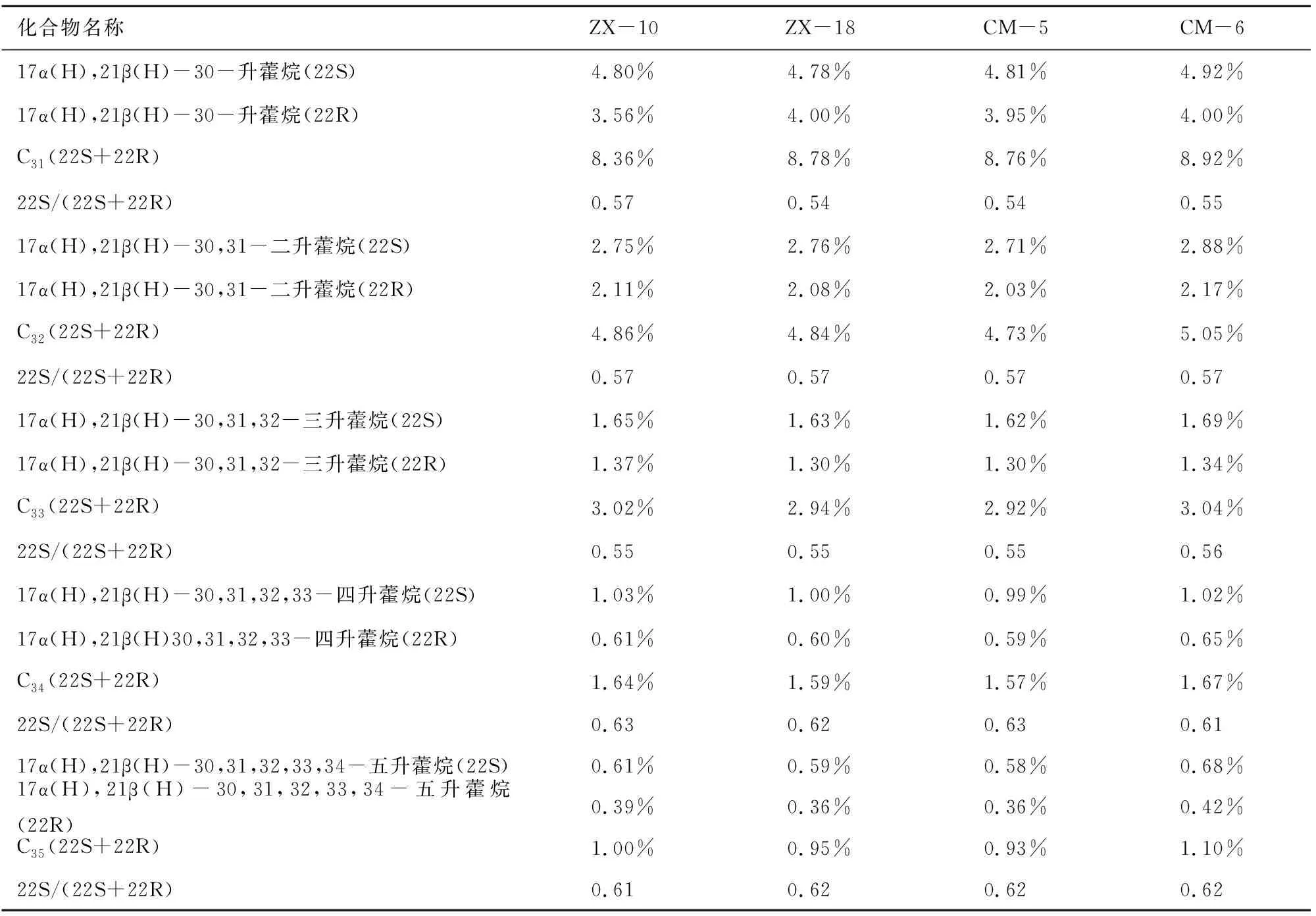
本次样品中萜烷皆为C19~C29三环萜烷和部分C24四环萜烷(图8),其化合物种类如表2所示。三环萜烷的前驱物为三环六异戊二烯醇,其分子特征表明其来源于原核生物的细胞膜[10]。另有研究称,因三环萜烷与类异戊二烯烷烃基侧链的关系,三环萜烷( 图8 三环萜烷C19~C29(m/z=191)质量色谱图 峰号 m/zZX-10ZX-18CM-5CM-6保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%生物标志化合物119140.08 0.1440.080.1940.080.0540.080.1013β(H),14α(H)-C19三环萜烷219142.670.4942.66 0.5142.66 0.2842.66 0.4613β(H),14α(H)-C20三环萜烷319145.291.0545.28 1.0145.29 0.7445.291.0813β(H),14α(H)-C21三环萜烷419147.68 0.3147.68 0.3047.69 0.2747.68 0.3113β(H),14α(H)-C22三环萜烷519150.511.8350.50 1.8250.521.8550.511.8713β(H),14α(H)-C23三环萜烷619151.98 1.1951.981.2152.001.3251.991.2813β(H),14α(H)-C24三环萜烷719155.061.1655.05 1.2155.071.3155.06 1.2113β(H),14α(H)-C25三环萜烷819157.23 0.9557.22 1.0257.251.0157.241.02C24四环萜烷919157.47 0.6857.46 0.7557.490.7957.50 0.6613β(H),14α(H)-C26三环萜烷1019157.640.7157.630.7557.65 0.8257.670.8013β(H),14α(H)-C26三环萜烷1119163.30 0.6763.290.7163.32 0.7463.31 0.7013β(H),14α(H)-C28三环萜烷1219163.66 0.7863.65 0.7863.68 0.8563.680.8213β(H),14α(H)-C28三环萜烷1319165.02 1.0165.01 1.0965.05 1.1565.041.0313β(H),14α(H)-C29三环萜烷1419165.510.8165.490.8565.53 0.8765.51 0.8213β(H),14α(H)-C29三环萜烷 表3 三环萜烷/17α(H)-霍烷比值 4.1.2 三环萜类化合物特征 三环萜烷/霍烷比值作为母源参数,用来比较细菌或藻类类脂体(三环萜烷)与不同原核生物(藻类中尚未检测出藿类化合物)的生物标志化合物(霍烷)输入。即比值越高,其沉积物有机质中非藻类原核生物含量越少(≥1)[9],反之越多。由表3可知,研究区内凝块石生源输入多为细菌等原核生物。 藿类化合物的前驱物一般为细菌细胞壁中的藿烯或者细菌霍烷四醇,藿烯的主要来源物为细菌或不同的原核类生物[9],而且藿类化合物被认为是由前驱物角鲨烯环化而成[13]。然而在实验室的藻类中并未发现此类化合物,说明此类化合物多来源于细菌[9]。 4.2.1 藿类化合物测定结果 实验发现样品中霍类化合物类型较为丰富,由谱图匹配分离出17α(H)、21β(H)-30-降霍烷、7β(H)、21β(H)-30-降霍烷、17α(H)、21β(H)霍烷、升霍烷(C31~C35)、17α(H)-重排霍烷(C30*)和18α(H)-降新霍烷(C29Ts)等化合物(图9)。 17α(H)、21β(H)-30-降霍烷在所有生标内相对含量较高,达10%左右,而17β(H)、21β(H)-30-降霍烷仅为1%,C31~C35升霍烷总量约为20%(如表4)。 图9 霍烷C27~C35(m/z=191)质量色谱图 峰号 m/zZX-10ZX-18CM-5CM-6保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%保留时间/min峰面积百分比/%生物标志化合物119166.562.8966.55 2.9166.59 3.0366.582.7518α(H)-22,29,30-三降藿烷(Ts)219167.803.3867.793.5267.833.3367.81 3.6417α(H)-22,29,30-三降藿烷(Tm)319171.7010.8371.6910.2071.73 10.7071.7110.7417α(H),21β(H)-30-降藿烷419171.812.9171.802.8071.852.8271.822.7618α(H)-30-降新藿烷(C29Ts)519172.321.5772.311.3672.34 1.5472.33 1.37重排藿烷-C30619173.212.5373.192.2273.232.0573.21 2.1517β(H),21α(H)-30-降莫烷719174.1417.1974.12 17.1674.1716.9774.15 16.7217α(H),21β(H)-藿烷819174.660.9574.650.7774.690.9374.670.69C30-五环三萜烷919174.971.1774.951.0974.991.1774.98 0.9517β(H),21β(H)-30-降藿烷1019175.333.8875.32 3.4575.363.3375.343.3217β(H),21α(H)-莫烷1119177.034.8077.014.7877.04 4.8177.034.9217α(H),21β(H)-30-升藿烷(22S)1219177.373.5677.364.0077.393.9577.384.0017α(H),21β(H)-30-升藿烷(22R)1319177.862.5277.85 2.5277.88 2.5777.872.54伽马蜡烷1419178.431.4178.41 1.2178.44 1.4278.43 1.2917β(H),21α(H)-30-升莫烷(22S+22R)1519179.372.7579.35 2.7679.382.7179.372.8817α(H),21β(H)-30,31-二升藿烷(22S)1619179.832.1179.81 2.0879.852.0379.83 2.1717α(H),21β(H)-30,31-二升藿烷(22R)1719182.121.6582.111.6382.131.6282.12 1.6917α(H),21β(H)-30,31,32-三升藿烷(22S)1819182.761.3782.751.3082.77 1.3082.76 1.3417α(H),21β(H)-30,31,32-三升藿烷(22R)1919185.041.0385.02 1.0085.04 0.9985.03 1.0217α(H),21β(H)-30,3132,33-四升藿烷(22S)2019185.830.6185.810.6085.83 0.5985.82 0.6517α(H),21β(H)30,31,32,33-四升藿烷(22R)2119187.920.6187.910.5987.930.5887.920.6817α(H),21β(H)-30,31,32,33,34-五升藿烷(22S)2219188.870.3988.860.3688.880.3688.870.4217α(H),21β(H)-30,31,32,33,34-五升藿烷(22R) 4.2.2 藿类化合物特征 受早期成岩过程中厌氧细菌氧化作用影响,17α(H),21β(H)-藿烷会转化为17α(H),21β(H)-30-降藿烷。在正常低温状态下,αβ构型降藿烷很难转化为ββ构型降藿烷,但在产甲烷菌存在的条件下,少量αβ构型降藿烷会转化为ββ构型降藿烷。由此,本次实验结果显示:降霍烷αβ/ββ高达10,可反映产甲烷古菌的厌氧氧化作用[14]。 升霍烷(C31~C35)来自于细菌霍烷四醇,或是存在于原核微生物内的C35霍烷类化合物[15]。在海相岩石中,升霍烷(C31~C35)17α(H)、21β(H)、22S和22R的异构体相对分布可指示沉积时氧化还原电位(Eh)指标[14]。17α(H)、21β(H)-五升霍烷主要指示还原到缺氧的沉积环境,较高的C35升霍烷则可能与沉积环境中强烈的细菌活动有关,较高丰度的C31、C34或C35升霍烷指示无有效游离氧的强还原(低Eh)海相沉积环境[9]。样品检测显示:从17α(H)、21β(H)-30-升霍烷到17α(H)、21β(H)-30-五升霍烷皆有分布。从所有构型的17α(H)、21β(H)升霍烷总量所占百分比丰度相对含量变化趋势来看(图10),总体特征为C31>C32>C33>C34>C35。随成熟度的增加,升霍烷指数(C35/C31~C35升霍烷)减小,而C31相对含量逐渐增大[16]。升霍烷22R的异构体比22S在生物降解中更易遗失,显然样品C31~C3522S异构体丰度大于22R(见表5),在源岩中有机质热演化至成熟,22S/(22S+22R)可升至0.5~0.6[17]。由此推测:C35升霍烷受生物降解热演化的影响而导致含量减少。C31~C35升霍烷的变化还与陆地或者河流有机质输送有关,而此种输送可能刺激微生物活动[18]。 图10 17α(H),21β(H)-(22S+22R)C31~C35升霍烷所占总量百分比变化趋势折线图 化合物名称 ZX-10ZX-18CM-5CM-617α(H),21β(H)-30-升藿烷(22S)4.80%4.78%4.81%4.92%17α(H),21β(H)-30-升藿烷(22R)3.56%4.00%3.95%4.00%C31(22S+22R)8.36%8.78%8.76%8.92%22S/(22S+22R)0.570.540.540.5517α(H),21β(H)-30,31-二升藿烷(22S)2.75%2.76%2.71%2.88%17α(H),21β(H)-30,31-二升藿烷(22R)2.11%2.08%2.03%2.17%C32(22S+22R)4.86%4.84%4.73%5.05%22S/(22S+22R)0.570.570.570.5717α(H),21β(H)-30,31,32-三升藿烷(22S)1.65%1.63%1.62%1.69%17α(H),21β(H)-30,31,32-三升藿烷(22R)1.37%1.30%1.30%1.34%C33(22S+22R)3.02%2.94%2.92%3.04%22S/(22S+22R)0.550.550.550.5617α(H),21β(H)-30,31,32,33-四升藿烷(22S)1.03%1.00%0.99%1.02%17α(H),21β(H)30,31,32,33-四升藿烷(22R)0.61%0.60%0.59%0.65%C34(22S+22R)1.64%1.59%1.57%1.67%22S/(22S+22R)0.630.620.630.6117α(H),21β(H)-30,31,32,33,34-五升藿烷(22S)0.61%0.59%0.58%0.68%17α(H),21β(H)-30,31,32,33,34-五升藿烷(22R)0.39%0.36%0.36%0.42%C35(22S+22R)1.00%0.95%0.93%1.10%22S/(22S+22R)0.610.620.620.62 表6 C30*/C29Ts 18α(H)-降新霍烷(C29Ts)主要来源于蓝藻细菌[16]。17α(H)-重排霍烷(C30*)多发现于陆相沉积物中,来源于沉积在氧化至亚氧化环境中的细菌有机质,并富含粘土,因此陆相源岩中C3017α(H)-重排霍烷含量较高[19]。某些实验室便将17α(H)-重排霍烷和18α(H)-降新霍烷的相对含量作为沉积环境分析的一种参数。若值相对较高(≥1),则有机质沉积于氧化至亚氧化的沉积环境之中[9]。由计算数值(见表6),C30*/C29Ts比值较低,因此可判断当时沉积环境为相对缺氧的还原环境。 综上分析,鲁西寒武系张夏组凝块灰岩沉积环境为还原、缺氧或无有效游离氧(水体平静的相对闭塞环境)且呈碱性的水体。 由前文数据计算可知,饱和烃主要呈现为细菌生源的输入[20],藿类化合物占总饱和烃提取量的比值达70%以上,结合当时的沉积环境,说明在沉积物后期成岩过程中,参与有机质改造的微生物中需氧至兼性菌到缺氧菌皆有。在生物界关于藻类与菌类的界定中,菌为无光合作用异养原核生物,藻多为光合作用自养的真核生物,其中也不乏蓝藻等原核生物。而前人研究对微生物岩中参与矿化的藻和菌的界定并不十分清晰。对于研究区无微生物实体化石的凝块石来说,无论是镜下观察到的深色团块物质,还是从有机质中检测到的17α(H)-重排霍烷(C30*)和18α(H)-降新霍烷(C29Ts),都表明蓝细菌的存在,证明凝块石在形成过程中微生物贡献多为原核生物。 C19~C36烷烃是有机质地质聚合物生成乙酸或发生甲烷生物降解的重要中间产物[21],角鲨烷作为多环三萜烷的前驱物,会随源岩有机质输入或沉积环境及其早期成岩作用影响而生成不同物质,在缺氧环境下,藿类化合物是由其前驱物角鲨烯经环化合成[13],结合凝块石中发现的黄铁矿分析当时环境为严格的缺氧还原环境。霍类化合物主要来源于厌氧环境,亦有研究将角鲨烷提议为产甲烷古菌标记物[22],而产甲烷古菌是严格的厌氧菌。三环萜以及发现的痕量类异戊二烯烃,也从侧面反映了产甲烷古菌的存在。降霍烷αβ/ββ比率的高数值则反映产甲烷古菌厌氧氧化作用的存在。因此,研究区凝块石在成岩过程中,产甲烷古菌参与并发生了厌氧氧化作用。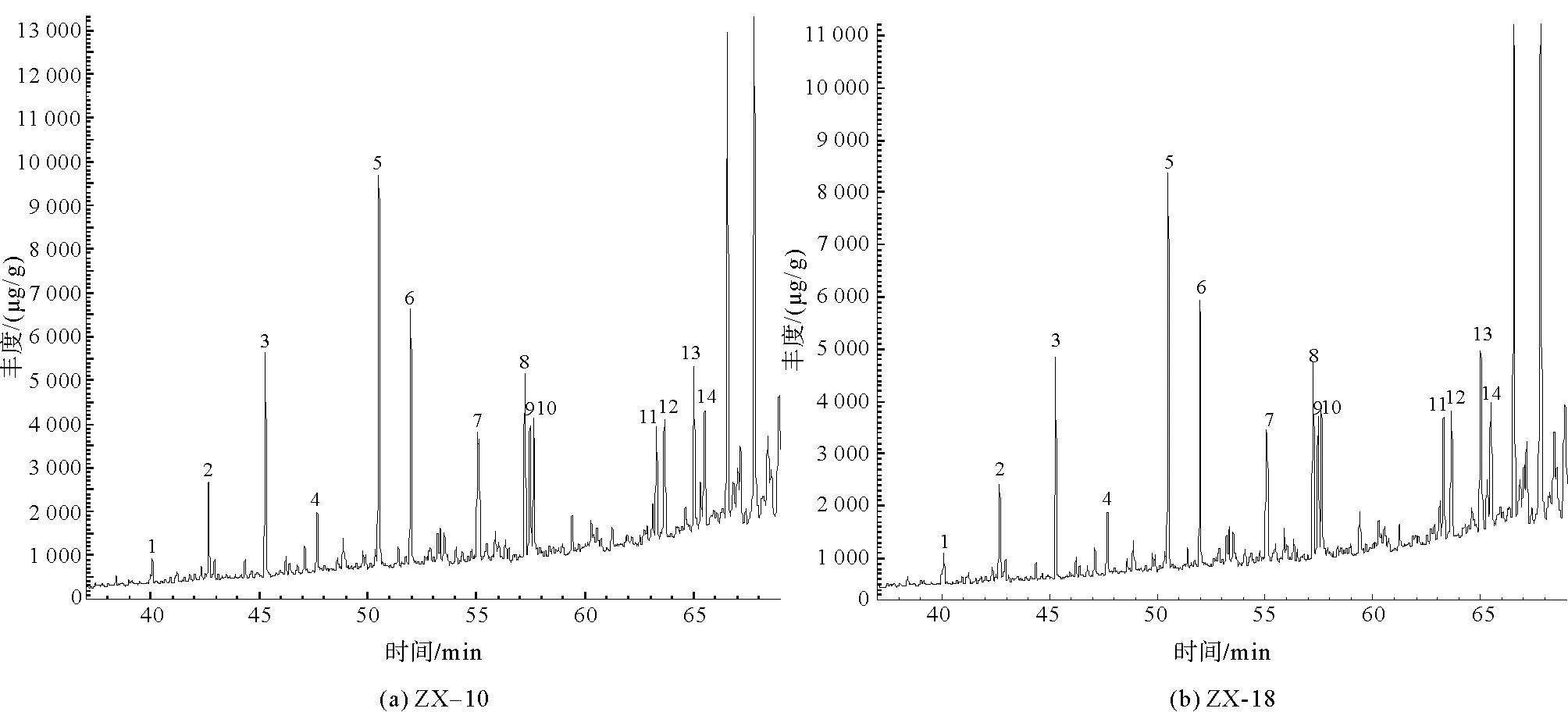

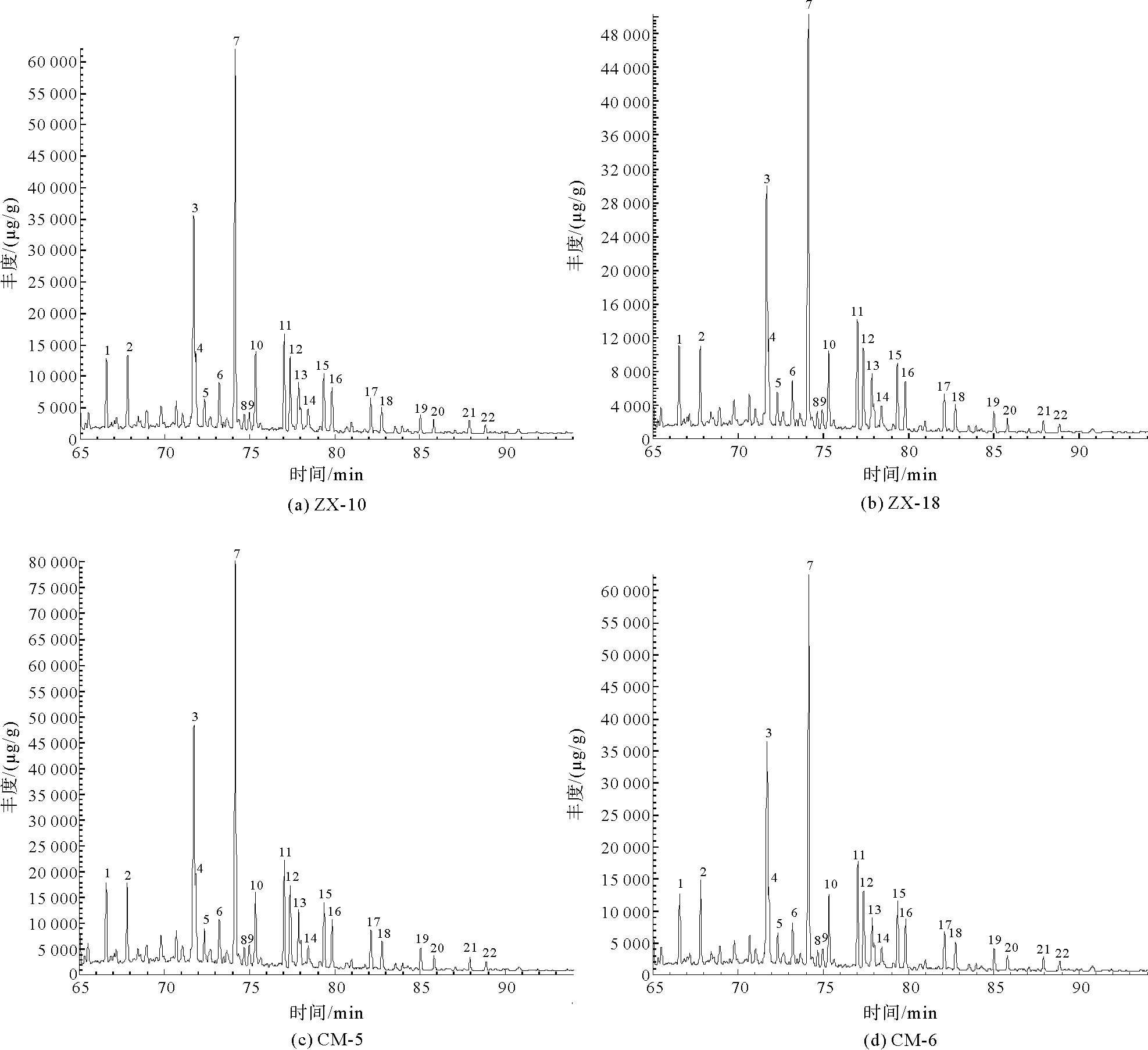
4.2 藿类化合物分析


5 结论与讨论
5.1 凝块石沉积环境分析及微生物群类型
5.2 产甲烷古菌与厌氧氧化作用
