垂体瘤的基因芯片数据生物信息学分析
2020-05-11胡昕倩余雅婕方明
胡昕倩 余雅婕 方明


摘要:目的 应用生物信息学技术筛选参与垂体瘤发生发展过程中的关键基因及通路,为垂体瘤治疗提供新靶点。方法 基于基因表达微阵列芯片数据集GSE51618及GSE26966,使用在线分析工具GEO2R筛选差异表达基因,利用GeneOntology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)对差异基因的功能进行富集分析,通过STRING及Cytoscape构建蛋白-蛋白相互作用网络并筛选出关键基因及预测关键转录因子。结果 共筛选到符合条件的差异表达基因354个,其中共同上调基因296个,共同下调基因58个。GO富集分析显示其主要参与细胞表面受体信号通路、细胞增殖等生物学过程。KEGG富集通路分析发现其富集于PI3K-Akt信號通路、催乳素信号通路、MAPK信号通路、多巴胺能神经突触、细胞周期调控等信号通路上。共筛选出RIPK4、POMC、ESR1、EGR1、GNB3、FOS、TF7个可能为诱导垂体瘤发生发展的关键基因,并预测出SP1、LHX3等调控差异基因的关键转录因子。结论 通过生物信息学对差异基因和关键基因进行分析,有助于揭示垂体瘤发生发展的重要分子机制,为其治疗提供新靶点。
关键词:垂体瘤;基因芯片;生物信息学
中图分类号:R736.4 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.06.026
文章编号:1006-1959(2020)06-0090-03
Abstract:Objective To apply bioinformatics technology to screen key genes and pathways involved in the occurrence and development of pituitary tumors, and to provide new targets for the treatment of pituitary tumors. Methods Based on the gene expression microarray chip datasets GSE51618 and GSE26966, the online analysis tool GEO2R was used to screen differentially expressed genes. GeneOntology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) were used to enrich the function of the differential genes. Through STRING and Cytoscape constructs a protein-protein interaction network and screens out key genes and predicts key transcription factors.Results In this study, a total of 354 eligible differentially expressed genes were screened, of which 296 genes were up-regulated and 58 genes were down-regulated. GO enrichment analysis showed that it was mainly involved in biological processes such as cell surface receptor signaling pathways and cell proliferation. Analysis of the KEGG enrichment pathway found that it was significantly enriched in signal pathways such as the PI3K-Akt signaling pathway, prolactin signaling pathway, MAPK signaling pathway, dopaminergic synapses, and cell cycle regulation. A total of RIPK4, POMC, ESR1, EGR1, GNB3, FOS, and TF7 were screened as key genes for inducing the development of pituitary tumors, and key transcription factors such as SP1 and LHX3 that regulate differential genes were predicted.Conclusion The analysis of differential genes and key genes through bioinformatics can help reveal the important molecular mechanism of pituitary tumor development and provide new targets for its treatment.
Key words:Pituitary tumor;Gene chip;Bioinformatics
垂体瘤(pituitary tumor)是一组从垂体前叶和后叶及颅咽管上皮残余细胞发生的肿瘤,是颅内常见肿瘤之一,其发病率约占颅内肿瘤的10%~15%,且发病率逐渐升高[1]。虽然垂体瘤大多为良性,但由于分泌过多的激素及局部压迫周围组织出现一系列临床症状和体征,严重影响患者的生活。虽然许多研究者开展大量的基础和临床实验来揭示垂体瘤发病的相关分子机制,但大部分的垂体瘤的发病机制存在争议,为了揭示垂体瘤发生发展过程中关键基因和通路,本研究拟通过生物信息学的方法,将垂体瘤和正常垂体组织所产生的基因表达进行比较,筛查出两者差异表达的基因,并进一步研究其所涉及的影响垂体瘤发生发展的相关基因和关键通路,从而加深人们对垂体瘤发病机制的了解,并为今后该病的研究提供新的方向。
1材料与方法
1.1数据集获取与筛选 以“pituitary tumors(垂体瘤)”作为检索词,从GEO 数据库(http:www.ncbi.Nlm.Nih.gov/geo)中检索已公布人来源的垂体瘤基因芯片数据集,获取两个数据集GSE51618及GSE26966。GSE51618来源于北京神经外科研究所,该数据集采用Agilent-014850 Whole Human Genome Microarray 4x44K G4112F平台,包含10个数据样本,其中7个垂体瘤组织,3个正常垂体组织。GSE51618来源于科罗拉多大学丹佛分校,采用[HG-U133_Plus_2] Affymetrix Human Genome U133 Plus 2.0 Array平台,分析23个数据样本,包括14个垂体瘤组织和9个正常垂体组织。
1.2差异表达基因的分析 将垂体瘤组织样本作为实验组,正常垂体组织样本作为对照组。使用GEO数据库的GEO2R在线分析工具分别对两个基因芯片数据进行差异表达基因的分析。筛选差异倍数>2且P<0.05的基因作为差异基因。并利用在线Veen图软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)找出共同差异基因进行分析。
1.3基因功能注释和通路富集分析 利用在线David软件(https://david.ncifcrf.gov/)中的GO分析和KEGG分析将筛选出来的差异基因进行基因功能注释和通路富集分析。P<0.05认为差异具有统计学意义。
1.4蛋白质相互作用网络构建以及关键基因的筛选 通过上传筛选出来的差异基因至在线String9.1软件(http://string-db.org),构建差异基因表达产物蛋白质相互作用网络。并利用Cytoscape3.6.1软件中的插件Centiscape2.2筛选关键候选基因。关键基因筛选基于节点的度和中介性。在本研究中,我们设定度大于20且中介性数值大于3000,此节点对应的基因被认为是关键候选基因。
1.5差异基因转录因子预测 进入Tfacts数据库(http://www.tfacts.org/),上传上调或下调差异表达基因进行转录因子筛选,参考P值、Q值、E值和FDR 值等4个指标来预测关键的转录因子,一般认为P-value,E-value,Q-value和FDR均<0.05表示差异具有统计学意义。
2结果
2.1差异基因筛选 利用GEO2R在线软件分析垂体瘤组织与正常垂体组织的差异基因,GSE51618数据库共筛选出差异表达2倍及以上的基因959个,其中718个为上调表达基因,241个为下调表达基因。GSE26966数据库共筛选出差异表达2倍及以上的基因1211个,其中869个为上调表达基因,342个为下调表达基因。通过Venn图找出共同差异基因354个,包括上调基因296个,下调基因58个,见图1。
2.2差异表达基因基因注释和通路分析 用David数据库对354个差异基因进行GO分析,在生物过程方面,其差异基因功能主要集中于细胞表面受体信号通路、细胞增殖等生物过程。通过KEGG通路分析,垂体瘤的发生发展与PI3K-Akt信号通路、催乳素信号通路、MAPK信号通路、多巴胺能神经突触、细胞周期调控等通路密切相关。
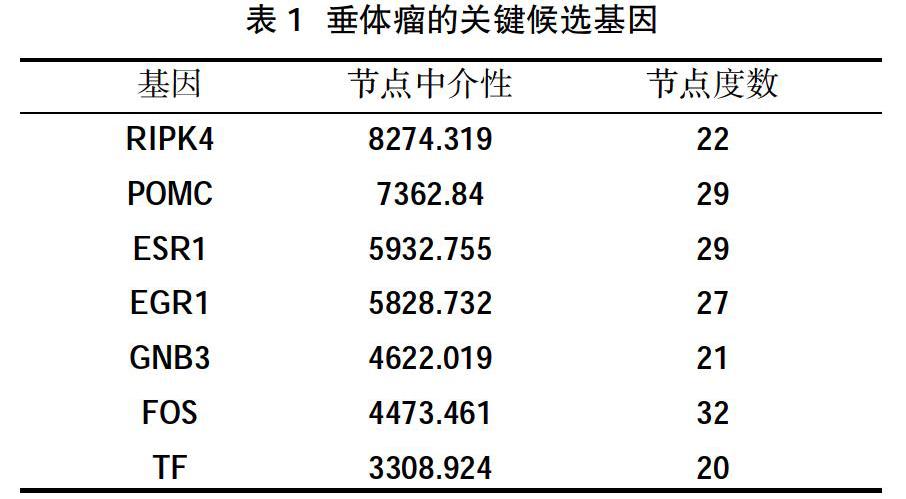
2.3差异表达基因蛋白质相互作用网络构建和关键基因的筛选 将354个差异基因上传至在线String 9.1软件,构建蛋白质相互作用网络,然后将在线软件String 9.1输出数据结果导入至Cytoscape 3.6.1软件中。利用其插件Centiscape 2.1将其网络可视化,见图2。其中网络由239个节点,592条边组成,节点中介性最大值为8274.3189,最小值为0,平均值为573.4477。网络中节点度数大于20与中介性同时大于3000的节点有7个。根据中介性数值从大到小排序依次为RIPK4、POMC、ESR1、EGR1、GNB3、FOS、TF,这些关键基因可能在垂体瘤发生及发展中发挥关键的调控作用,见表1。
2.4差异基因转录因子预测 将差异基因上传到Tfacts数据库,分析124个转录因子可调控差异基因的转录过程。其中,SP1、LHX3、CREB1这3个转录因子调控的靶基因数量最多,是重要的候选转录因子,它们可能通过调控关键基因的转录过程来发挥重要的作用。
3讨论
垂体瘤的发生与环境、行为方式和遗传等多种因素有关,虽然许多研究者开展大量的基础和临床实验来揭示垂体瘤发病的相關分子机制,但仍有95%垂体瘤仍然不知道其发病的病因。寻找新的特异性靶向分子作为治疗的靶点成为当今垂体瘤研究的热点。
本研究通过生物信息学的方法,重点分析了垂体瘤发生发展差异基因的GO功能分类和KEGG富集通路,发现细胞表面受体信号通路、PI3K-Akt信号通路、MAPK信号通路参与了垂体瘤的发生发展。同时利用蛋白质相互作用网络分析挑选出7个关键基因RIPK4、POMC、ESR1、EGR1、GNB3、FOS、TF,其中RIPK4和GNB3对细胞的增殖生长发挥重要的调控作用,但在垂体瘤的发生发展的机制中的作用尚未研究。而SP1、LHX3、CREB1等转录因子可通过调节关键基因的转录过程而调控垂体瘤的发生发展。
酵母双杂交实验中,RIPK4作为蛋白激酶Cβ1 和Cδ相交互的一种蛋白首次被发现,它的全称为受体相互作用蛋白激酶4,属于苏/丝氨酸蛋白激酶家族之一。基因定位于21q22.3,广泛表达于肾、肝、肺、骨骼肌和心脏等组织中。RIPK4是RIPKs家族成员中研究较少的一类,在 N 端上有高度保守的激酶结构域,在C 端则有11 个重复的锚蛋白(ankyrin repeats kinase,ANK),而中间区域可以被caspases裂解。RIPK4的激酶活性在NF-kB和JNK通路活化起到关键作用,也参与调控RAF/MEK/ERK和 Wnt/beta-cateni信号通路[2]。最近研究表明,RIPK4可能是垂体无功能腺瘤致病驱动基因,但其致病机制尚未研究[3]。本研究再次筛选出RIPK4作为垂体瘤致病关键基因,为其相关性提供有力的证据。
GNB3基因全称G蛋白β3亚单位基因,位于人类12p13染色体。GNB3基因主要编码β亚单位。在细胞外血管活性多肽、生长因子及细胞因子等的作用下,激活血管平滑肌细胞膜上的G蛋白,调控血管平滑肌细胞的舒缩、合成、分泌、分化、迁移和增生等功能,促进血管生成,从而可能为肿瘤的生长提供营养供应,促进肿瘤细胞的生长。但尚未發现该基因与垂体瘤发生的相关研究。
SP1蛋白是Sp/KLF家族的一员,在体内广泛表达,它通过3个C2H2锌指结构域与DNA相互作用,而机体对它的表达水平及活性有着严格的调控。调控的主要方式可以为对Sp1蛋白的不同氨基酸位点的磷酸化和去磷酸化、O-糖基化等修饰来改变与DNA的结合活性,从而调控基因的表达[4]。且Sp1在肿瘤组织中的表达水平明显高于周围正常组织,与肿瘤的分期和预后不良相关。
LHX3是一种LIM同源结构域的神经内分泌转录因子,最初在胚胎发育中的整个神经系统表达,之后则局限于内陷的 Rathke 囊和成熟的垂体中[5]。它能结合垂体基因启动子和增强子区域的调控元件 ,增强FSHβ、αGSU、PRL 、TSHβ、GRHR和 Pit1启动子转录,促进垂体组织中促性腺激素细胞、TSH细胞、GH细胞和 PRL细胞的生长和增殖,有利于垂体瘤的发生发展[6]。
总之,本研究通过生物信息学的方法对垂体瘤差异基因进行分析,筛选出垂体瘤发生发展关键基因及预测关键转录因子,分析其可能存在的垂体瘤发病机制,为临床治疗垂体瘤提供新思路。
参考文献:
[1]Lim CT,Márta Korbonits.Update on the clinicopathology of pituitary adenomas[J].Endocrine Practice,2018,24(5):473-488.
[2]Liu JY,Zeng QH,Cao PG,et al.RIPK4 promotes bladder urothelial carcinoma cell aggressiveness by upregulating VEGF-A through the NF-κB pathway[J].British Journal of Cancer,2018,118(12):1617-1627.
[3]彭羿达,王新慧,葛琳娜,等.应用生物信息学鉴定无功能型垂体瘤驱动基因及特效药物筛选[J].脑与神经疾病杂志,2019,27(7):442-450.
[4]Vizcaíno C,Mansilla S,Portugal J.Sp1 transcription factor:A long-standing target in cancer chemotherapy[J]. Pharmacology & Therapeutics,2015(152):111-124.
[5]Nicolas J,Pauline R,Mélanie P,et al.Heterozygous LHX3 mutations may lead to a mild phenotype of combined pituitary hormone deficiency[J].Eur J Hum Genet,2019(27):216-225.
[6]Yoshida S,Kato T,Nishimura N,et al.Transcription of follicle-stimulating hormone subunit genes is modulated by porcine LIM homeobox transcription factors, LHX2 and LHX3[J].Journal of Reproduction and Development,2016,62(3):241-248.
收稿日期:2020-02-05;修回日期:2020-03-05
编辑/钱洪飞
