塞来昔布对膝关节炎大鼠肿瘤坏死因子α信号通路及关节滑膜细胞的影响*
2020-05-08袁利艳杨颜滋侯晓东
袁利艳 杨颜滋 侯晓东
(1 河南大学第一附属医院药学部,开封 475000;2 南京大学生命科学学院医药生物技术国家重点实验室,南京 210093)
膝关节炎主要因局部病灶软骨的退行性变使软骨及关节周围肌肉损害而引起的进展性关节疾病[1-2]。膝关节炎的发病机制是关节内部的软骨组织出现病变,导致关节软骨局部结构性破坏及病变[3-4]。膝关节炎主要表现为行动不便、膝盖红肿、肿胀等。随着病情的发展,逐渐会出现病变关节的夜间休息痛,半月板损伤等,由于疼痛,关节的正常活动会受到限制[5-6]。发病原因有多种因素,其中包括年龄、性别等[7]。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎性因子能影响软骨细胞的代谢,由此得知,炎性反应与膝关节炎有关[8]。塞来昔布胶囊(Celecoxib)属于非甾体抗炎药,临床上通常用来治疗骨关节炎、类风湿关节炎等相关疾病。本研究旨在探索塞来昔布对膝关节炎大鼠TNF-α 信号通路及关节滑膜细胞的影响。
1 材料和方法
1.1 模型制备与分组
18 只雄性SD 大鼠购自广东省医学SD 大鼠中心,体质量250~300 g,鼠龄接近。所有实验动物于实验开始前,适应性饲养1 周。
大鼠随机分为:模型组,该组大鼠制作膝关节炎大鼠模型;假手术组,该组大鼠在膝关节做切口后不做任何处理;治疗组,该组大鼠制作膝关节炎模型后给予塞来昔布进行治疗,每组6 只。分别给予模型组、治疗组大鼠膝关节注射木瓜蛋白酶溶液,剂量为0.15 mL,浓度为4%,3 d 1次,连续3次,同时,给予假手术组大鼠0.15 mL生理盐水。大鼠关节有红色斑点、肿胀,同时伴随食欲降低、体质量减轻及轻度脱毛等症状,则表示造模成功,7 d后,给予治疗组大鼠塞来昔布(4 mg·kg-1·d-1)进行治疗,每天1次,通过灌胃给药方式,模型组、假手术组大鼠给予等体积的生理盐水,持续治疗2 个月。在此期间,所有大鼠在相同环境下生活。实验完成后,抽取大鼠静脉血,将3 组大鼠分别处死并选取关节滑膜组织,常规制成细胞[9],并进行保存,用于后续实验。
1.2 TUNEL 法检测关节滑膜细胞凋亡
将盖玻片置于6 孔板内,种入细胞,培养过夜,为70%~80%。随后严格按照厂家说明书进行TUNEL 染色。加Vectashield Hard Set 封固涂片样本,标记反应,于荧光显微镜下观察染色结果并拍照。凋亡率=同一视野内凋亡细胞数量/总细胞数量。
1.3 CCK-8 法对滑膜细胞增殖数量进行检测
取出滑膜细胞,稀释为1×105/mL,培养12 h。取培养好的滑膜细胞平铺到16 孔板中,并培养。培养到一定数量后,加入CCK-8(美仑生物公司,大连)10 μL。常温放置30 min,利用读板器检测450 nm 光密度值(OD 值)。
1.4 免疫印迹检测滑膜细胞TNF-α 蛋白含量
取滑膜细胞50 μg,裂解液提取细胞总蛋白,BCA 法定量后常规行免疫印迹检测TNF-α表达。TNF-α抗工作浓度为1∶1 000。以GAPDH 为内参,Ⅰmage J 软件分析蛋白条带灰度值,以目的条带与内参条带的灰度值比代表TNF-α蛋白相对表达量。
1.5 qRT-PCR 法检测滑膜细胞TNF-α mRNA 表达量
在大鼠滑膜细胞培养液中加入氯仿,摇荡,离心,使溶液呈乳白状,4 ℃ 1 200 r/min离心,加异丙醇,离心,加75%乙醇离心,干燥,-80℃保存。总RNA提取反转录成cDNA,按照说明书进行实验,内参采用GAPDH。TNF-α上游引物序列 为5'-CTCCCTGGTAGATGGGTTCG-3';下 游引物序列为5'-TGAACGGGAAGCTCACTGG-3';GAPDH上游引物序列为5'-TCCACCACCC TGTTGCTGTA-3';下游引物序列为5'-CCCTT GTTCCTCACCCACAC-3'。PCR反应条件为60 ℃ 10 min,95℃、72℃,各30 s,95℃ 5 min,40个循环,实验次数至少3次,用相对定量2-ΔΔCT计算TNF-α表达。
1.6 关节炎指数判定标准
0 分:膝关节没有明显炎症;1 分:膝关节有轻微炎症;2 分:膝关节有轻微红肿,有炎症;3 分:膝关节红肿明显,同时有明显炎症[10]。
1.7 统计学处理
采用SPSS 22.0 软件进行统计学分析。计量资料以±s表示,组间比较采用方差分析。
2 结果
2.1 大鼠滑膜细胞凋亡比较
模型组、治疗组、假手术组关节滑膜细胞凋亡率分别为89.38%、46.84%、13.68%。假手术组关节滑膜细胞凋亡数量最少,模型组关节滑膜细胞大量凋亡,模型组与假手术组、治疗组比较,细胞凋亡率显著升高;与假手术组比较,治疗组细胞凋亡数量增多(图1,P<0.05)。
2.2 大鼠滑膜细胞增殖情况比较
假手术组、治疗组细胞增殖较模型组高,差异有统计学意义(P<0.05),假手术组关节滑膜细胞的增殖数量最多,模型组最少,治疗组关节滑膜细胞增殖较假手术组明显减少(图2,P<0.05)。
2.3 大鼠滑膜细胞TNF-α 蛋白含量比较
假手术组的TNF-α 蛋白含量最低,模型组蛋白含量最高,与假手术组、治疗组比较,模型组关节滑膜细胞TNF-α 蛋白表达水平显著上升,治疗组TNF-α 蛋白表达水平较假手术组明显增高,差异均有统计学意义(图3,P<0.05)。
2.4 大鼠滑膜细胞TNF-α mRNA 表达含量比较
模型组关节滑膜细胞内的TNF-α mRNA 表达量最高,假手术组表达量最低,与假手术组、治疗组比较,模型组TNF-α mRNA 含量显著升高,治疗组TNF-α mRNA 表达量假手术组明显增高,差异均有统计学意义(图4,P<0.05)。
2.5 大鼠关节炎指数比较
7 d 时,模型制备成功,治疗组、模型组大鼠关节炎指数相近,随着给药时间的增加,治疗组大鼠膝关节炎情况逐渐好转,而未服用药物的模型组大鼠病情逐渐恶化(图5,表1,P<0.05)。
表1 各组大鼠关节炎指数比较(n=6,±s)Tab1 Comparison of arthritis index of three groups of rats(n=6,±s)

表1 各组大鼠关节炎指数比较(n=6,±s)Tab1 Comparison of arthritis index of three groups of rats(n=6,±s)
*P<0.05 vs sham group;△P<0.05 vs treatment group
Group 7 d 21 d 35 d Sham group 0 0 0 Treatment group 1.34±0.01* 1.05±0.04* 0.68±0.12*Model group 1.35±0.04*△ 2.67±0.03*△ 3.10±0.02*△P value <0.001 <0.001 <0.001
3 讨论
膝关节炎是骨科疾病的一种,随着年龄的增长,患病人数不断增加,该病在中老年人群中出现概率较大[11]。骨关节炎是一种关节退行性病变的结果,在人的手关节、膝关节、髋关节、脊柱中,膝关节最易发生退变,因此膝骨关节炎发病也最广泛[12]。随着社会的不断发展,膝关节炎的发病率也在迅速增加,膝关节炎是一种比较常见的关节性病变,很多人在青年时期就患有该病,但多数无明显症状。一旦发展严重则会严重影响患者的正常生活,因此,研究有效治疗方案成为医学工作者关注的重点[13]。
本研究结果显示,与假手术组、治疗组比较,模型组细胞凋亡率显著升高,与假手术组比较,治疗组细胞凋亡数量多于假手术组。假手术组关节滑膜细胞的增殖数量最多,模型组关节滑膜细胞的增殖数量最少,治疗组关节滑膜细胞的增殖情况比假手术组相比明显减少。和假手术组、治疗组比较,模型组关节滑膜细胞TNF-α 蛋白含量升高,与假手术组比较,治疗组蛋白含量明显升高。与假手术组、治疗组比较,模型组TNF-α mRNA 含量显著升高,与假手术组比较,治疗组mRNA 表达量明显增高。在7 d 时,模型制备成功,治疗组、模型组大鼠关节炎指数相近,随着给药时间的增加,治疗组大鼠膝关节炎情况逐渐好转,而未服用药物的模型组大鼠病情逐渐恶化。
有研究表明,TNF-α 信号通路参与机体内多种细胞的增殖、凋亡过程,在正常生物体内TNF-α 信号通路呈现低表达,在患病生物体内TNF-α 信号通路呈现高表达,表明其高表达能明显促进细胞凋亡、减少细胞寿命,因此,TNF-α 信号通路的表达水平对细胞的生长、凋亡具有重要作用[14]。动物实验研究检测到膝骨关节炎大鼠存在高浓度的TNF-α mRNA 表达,在正常细胞中未检测出,表明TNF-α在软骨退变和骨关节炎症中起重要作用[15]。研究证实,TNF-α 是膝关节炎进程中重要的炎症递质,可促进软骨细胞产生过氧化反应,它与白细胞介素1 共同参与促进软骨的吸收[16]。研究结果显示,塞来昔布在膝关节炎大鼠体内发挥效应显著,能够明显降低TNF-α 信号通路的表达水平,抑制其凋亡[17]。本实验结果显示,塞来昔布作用于患病大鼠时,大鼠体内TNF-α 的表达水平随之下降,且塞来昔布用药时间与TNF-α 的表达水平呈负相关关系,即塞来昔布用药时间越长,TNF-α 表达水平越低[18]。塞来昔布与TNF-α 信号通路的关系为膝关节炎的诊断和治疗发展提供新的科研方向[19-20]。本实验的研究结果与上述结论均相同。
综上所述,塞来昔布胶囊治疗膝关节炎大鼠效果显著,能够显著降低TNF-α 信号通路的表达水平,改善关节滑膜细胞的凋亡情况。

图1 3 组大鼠滑膜细胞凋亡情况,标尺=50 μm。A:假手术组;B:治疗组;C:模型组;D:3 组大鼠滑膜细胞凋亡率,*P<0.05 vs 假手术组;△P<0.05 vs 治疗组.Fig1 Apoptosis of synovial cells in rats of three groups,bar=50 μm.A:Sham group;B:Treatment group;C:Model group;D:Apoptosis rate of synovial cells in rats,*P<0.05 vs sham group.△P<0.05 vs treatment group.
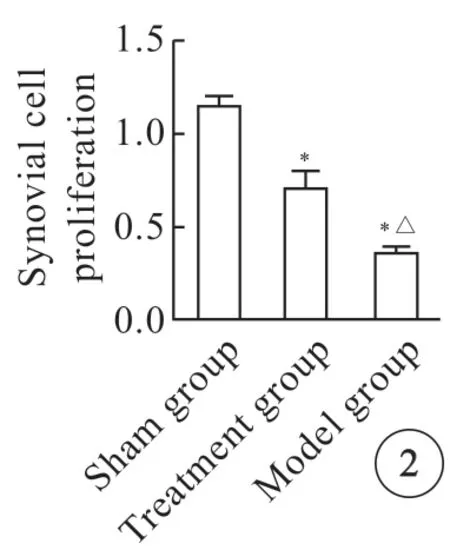
图2 3 组大鼠滑膜细胞增殖情况。*P<0.05 vs 假手术组;△P<0.05 vs 治疗组.Fig2 Proliferation of synovial cells in rats of three groups.*P<0.05 vs sham group;△P<0.05 vs treatment group.

图3 大鼠滑膜细胞中TNF-α 蛋白含量。A:3 组大鼠滑膜细胞中TNF-α 蛋白电泳图;B:3 组大鼠滑膜细胞中蛋白含量比较,*P<0.05 vs假手术组;△P<0.05 vs 治疗组.Fig3 TNF-α protein content in rat synovial cells.A:The electrophoretogram of TNF-α in synovial cells of the rats of three groups,B:Comparison of the protein content of the synovial cells of the three groups of rats,*P<0.05 vs sham group;△P<0.05 vs treatment group.
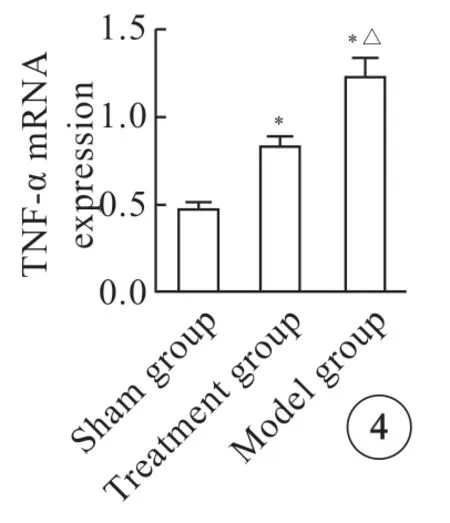
图4 3 组大鼠滑膜细胞中TNF-α mRNA 表达量.Fig4 TNF-α mRNA expression in synovial cells from three groups of rats.*P<0.05 vs sham group;△P<0.05 vs treatment group.
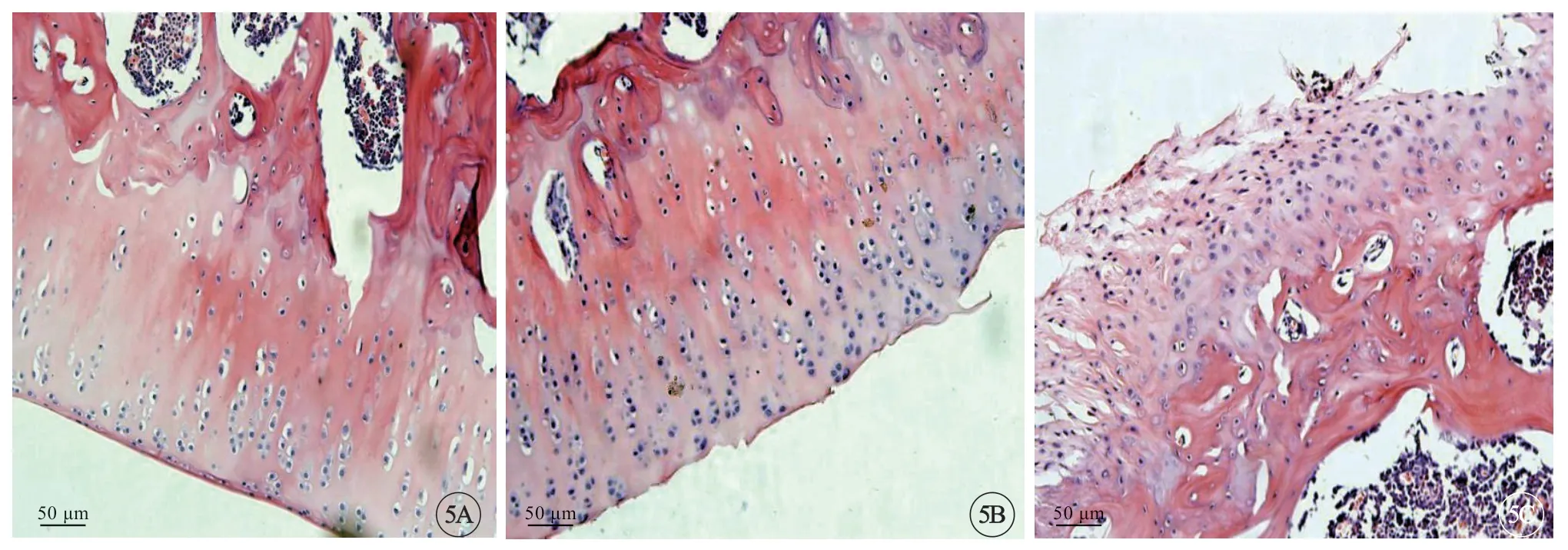
图5 3 组大鼠关节组织情况,标尺=50 μm.A:假手术组;B:治疗组;C:模型组.Fig5 Joint tissue of rats of three groups,bar=50 μm.A:Sham group;B:Treatment group;C:Model group.
