srtA基因调节变异链球菌氧化耐受的机制研究
2020-05-08何远丽任彪陈璇邹玲
何远丽, 任彪, 陈璇, 邹玲
1.口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心 四川大学华西口腔医院,四川 成都(610041);2.口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心四川大学华西口腔医院牙体牙髓病科,四川 成都(610041)
变异链球菌是主要致龋菌,其耐受各种环境应激的能力是它在牙菌斑生物膜中的竞争优势之一[1]。牙菌斑是一个复杂的微生态环境,菌斑中氧的含量水平约为大气中的10%,这些活性氧(reactive oxygen species,ROS)的累积会导致蛋白质、DNA、膜脂质损伤以及酶失活。为应对上述环境压力变化,变异链球菌通过调控网络系统如双组分信号转导系统(two-component signal transduction systems,TCSTS)、CcpA-依赖和非依赖的碳代谢阻遏(carbon catabolite repression,CCR)、群体感应信号机制(quorum-sensing,QS)增强其环境适应性,在牙菌斑波动性环境中良好生存并繁殖[1]。研究表明,氧化应激会影响细菌的遗传转化以及与感受态相关的多重基因表达[2]。而变异链球菌控制遗传转化的调控通路与许多毒力相关基因的表达相互影响。分选酶A(Sortase A,SrtA)是革兰阳性菌中的一类转肽酶,变异链球菌中的SrtA 可对其底物蛋白SpaP、GbpC、DexA、FruA、WapA、WapE 的LPXTG 序列进行分选识别,将这些表面蛋白共价锚定于细胞壁上,在变异链球菌的黏附过程中起重要作用。既往研究发现其编码基因srtA 缺失后细菌初始黏附率降低、生物膜结构松散、致龋能力减低[3]。本课题组前期研究还发现srtA基因缺失影响变异链球菌细胞外多糖合成及耐酸能力,推测这些影响与srtA 基因缺失后复杂的基因网络调控相关[4-5],且变异链球菌srtA 基因很有可能影响其氧化耐受能力。因此,本研究拟探索srtA 对变异链球菌氧化耐受能力的影响,并通过转录组测序(RNA-sequence,RNA-seq)与实时荧光定量PCR(quantitative real-time PCR,qPCR)来初步探讨其机制。
1 材料和方法
1.1 主要试剂和材料
牛脑心浸液培养基(Oxiod,英国);壮观霉素(Sigma,美国);3%过氧化氢(Sigma,美国);过氧化氢酶(Sigma,美国);Nanodrop 分光光度仪(Thermo Scientific,美国);IlluminaHiseq 4 000 测序平台(上海美吉生物医药科技有限公司,中国);Trizol 裂解液(Life Technologies,美国);PrimeScript RT reagent Kit With gDNA Eraser(TaKaRa,日本);TB GreenTMPremix Ex TaqTMII(Tli RNase H Plus)(TaKaRa,日本);LightCycler480 荧光定量PCR 仪(Roche,瑞士)。变异链球菌UA159(Streptococcus mutans UA159)由口腔疾病研究国家重点实验室提供,保存于-80 ℃。变异链球菌UA159 菌株srtA 基因缺失株及回复株由本课题组前期研究构建[5-6]。
1.2 菌株培养
变异链球菌UA159、变异链球菌UA159 菌株srtA 基因缺失株(ΔsrtA)及回复株(ΔsrtAcomp)各菌株分别接种于牛脑心浸液(brain heart infusion broth,BHI)培养基,于37 ℃、5%CO2培养条件下过夜复苏后,划线接种于BHI 固体培养基,培养48 h后4 ℃储存备用。其中,ΔsrtAcomp 接种于含有浓度为1 000 μg/mL 壮观霉素的BHI 培养基,余同上。细菌经菌落形态学、细胞形态学鉴定为变异链球菌。将UA159、ΔsrtA、ΔsrtAcomp 单菌落过夜培养,1∶20 稀释于BHI 中培养3 h 后,调整菌液600 nm 光密度为0.5,即为“对数中期细菌”。将1∶20稀释后细菌培养至24 h,即为“稳定期细菌”。将对数中期菌液继续1∶20 稀释于含有1%蔗糖的BHI培养基中,分别加入24 孔板,培养24 h 以产生稳定期生物膜。
1.3 浮游菌氧化耐受
将UA159 及ΔsrtA、ΔsrtAcomp 菌株培养至对数中期,离心收菌、去上清,等体积1 mL 无菌磷酸盐缓冲液(phosphate buffer saline,PBS)(pH=7.0)重悬,振荡混匀,再次离心、去上清。将3%过氧化氢(hydrogen peroxide,H2O2)用无菌PBS 缓冲液稀释至0.05%终浓度[7]。然后向各管中分别加入等体积含0.05% H2O2的无菌PBS 缓冲液重悬细菌团块,于37 ℃、5%CO2培养条件下分别培养0、15、30、60 min后,加入5 mg/mL H2O2酶终止反应[8],震荡混匀,用无菌PBS 进行浓度梯度稀释,每样取10 μL 于BHI琼脂平板点样,37 ℃、5%CO2条件下培养2 d 后菌落计数,计算各样本存活率的对数转换结果并绘制其随时间变化折线图,比较其统计学差异。
1.4 生物膜氧化耐受
培养UA159 及ΔsrtA、ΔsrtAcomp 菌株至稳定期生物膜状态,吸弃上清液,无菌PBS 缓冲液润洗孔板底部生物膜3 次,将每菌种6 平行孔分为A、B组(各3 孔)。各菌A 组每孔即刻加入2 mL PBS 缓冲液,各菌B 组每孔即刻加入2 mL 含0.05% H2O2的无菌PBS 缓冲液后于37 ℃、5%CO2条件下培养60 min。A 组即刻刮取生物膜,为“无刺激组”;B组培养60 min 后刮取生物膜,为“刺激组”。震荡混匀,5 000 rpm 离心10 min,去上清、PBS 重悬,再次离心、重悬;震荡混匀,从各组各孔中分别吸取100 μL 菌液用无菌PBS 进行浓度梯度稀释,取合适稀释倍数的菌液100 μL 涂布于BHI 琼脂平板,37 ℃、5%CO2条件下培养4 d 后菌落计数,计算各样本CFU/mL 的对数转换结果并比较其统计学差异。
1.5 RNA-seq 与数据分析
将UA159 和ΔsrtA 对数中期组、稳定期组菌液培养至预定生长时间后,提取样本总RNA。使用Nanodrop 分光光度仪检测所得样本RNA 的纯度及浓度,琼脂糖凝胶电泳分析RNA 质量。本实验RNA-Seq 检测及原始数据质控均委托上海美吉生物医药科技有限公司完成,RNA 建库、富集,采用IlluminaHiseq 4 000 测序 平台 行2 × 150 bp 测 序。参考Gene Ontology 数据库及KEGG 数据库对测序所得同源基因转录本进行功能注释。使用软件RSEM 以FPKM 为单位计算样本中各基因表达量。以显著性FDR <0.05,变化倍数(fold change,FC)绝对值≥2 为筛选标准,计算对数中期及稳定期ΔsrtA 相对UA159 的基因差异表达状况,差异表达基因(differentially expressed gene,DEG)若在ΔsrtA样本中表达量高于UA159 样本,则为表达上调基因,反之则为表达下调基因。
通过文献查阅,本实验筛选了与变异链球菌氧化耐受相关的转录调控系统和编码细胞内H2O2合成酶、代谢解毒酶类等相关基因共33 个,其中TCSTS 基因17 个、H2O2合成酶编码基因3 个、H2O2代谢酶编码基因8 个以及其他[9]对氧化耐受有潜在影响的基因与调控子5 个。分别分析这33 个基因在对数中期及稳定期各样本中的转录水平。
1.6 氧化耐受相关基因的qPCR 验证
将UA159 和ΔsrtA 对数中期菌液1∶20 稀释于含有1%蔗糖的BHI 培养基中,分别培养至对数中期、稳定期后,离心收菌,提取细菌总RNA,然后使用PrimeScript RT reagent Kit With gDNA Eraser 逆转录为cDNA。选用16S rRNA[10]作为内参引物,选用RNA-seq 结果中FDR <0.05、|FC| ≥2 的DEGs 作为目的基因。本研究所用引物序列见表1,其中lrgB、lytT引物序列参考Ahn等[11]的研究设计,其余引物序列使用Primer 3 Plus 设计。根据TB GreenTMPremix Ex TaqTMII(Tli RNase H Plus)说明书加样,各基因引物设置不含cDNA 的阴性对照。通过LightCycler 480IISystem 程序上机扩增,获得各目的基因及内参基因的CT(cycle threshold)值。采用2-ΔΔCT法对目的基因的相对表达水平进行计算分析,得到各目的基因差异表达情况。

表1 引物序列Table 1 Primer sequences
1.7 统计学分析
数据分析均用SPSS 17.0 软件完成。用Levene′s test 对样本进行方差齐性检验,若样本方差齐,则进行两独立样本t 检验或单因素方差分析,若样本方差不齐,则进行Kruskal-wallis 非参数检验,P <
0.05 为差异有统计学意义。
2 结 果
2.1 srtA 基因缺失株影响浮游状态变异链球菌氧化耐受能力
H2O2刺激UA159 和ΔsrtA、ΔsrtAcomp 菌株浮游菌0、15、30、60 min 后3 菌种平板生存率的对数转换结果随时间变化情况如图1 所示,可见UA159 和ΔsrtA、ΔsrtAcomp 菌株的存活率随氧化刺激时间增加而降低。ΔsrtA 在H2O2刺激15 min 时存活率无明显变化(P>0.05);在H2O2刺激30、60 min 后,ΔsrtA、ΔsrtAcomp 存活率低于UA159(P<0.05)。
2.2 srtA 基因缺失株生物膜状态耐氧化能力下降
生物膜状态各菌株受H2O2刺激前后的菌落计数结果如图2 所示,srtA 基因缺失后稳定期生物膜状态变异链球菌氧化耐受能力下降(P<0.05)。在无刺激组,UA159 和ΔsrtA、ΔsrtAcomp 菌落计数结果分别为2.38×106、1.28×106、8.00×106,差异无统计学意义(P>0.05)。在刺激组,ΔsrtA 在过氧化氢刺激1 h 后被完全杀灭,低于此时UA159 及ΔsrtAcomp 组的活菌菌落计数(P<0.05),此时ΔsrtAcomp组活菌菌落计数也低于UA159(P<0.05)。
2.3 srtA 基因缺失影响转录组中氧化耐受相关基因的表达水平
在对数中期ΔsrtA 样本中,有31 个氧化耐受相关基因呈现出转录水平改变的趋势(图3a),其中,有15 个基因趋于上调,16 个基因趋于下调,但其F C 均低于本次筛选阈值,故对数中期样本中未见细胞氧化耐受相关基因差异表达。
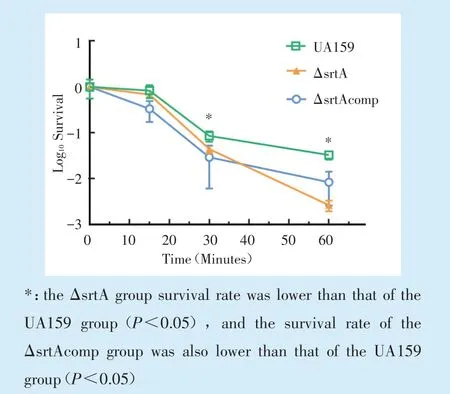
Figure 1 Oxidation tolerance results for the UA159,ΔsrtA and ΔsrtAcomp strains in the planktonic state图1 UA159 和ΔsrtA、ΔsrtAcomp 菌株浮游状态耐氧化结果
在稳定期ΔsrtA 样本中(图3b),双组份信号转导系统编码基因lrgA、lrgB、lytT 表达显著下调(2.2~2.4 倍),comC 表达显著上调(2.1 倍)。其余14 个基因趋于上调,15 个基因趋于下调,但其基因表达水平波动范围在本次分析阈值以下。

Figure 2 Oxidation tolerance results for the UA159,ΔsrtA and ΔsrtAcomp strains in the biofilm state图2 UA159 和ΔsrtA、ΔsrtAcomp 菌株生物膜状态耐氧化结果
2.4 srtA 基因缺失降低TSCTS 相关基因的表达水平
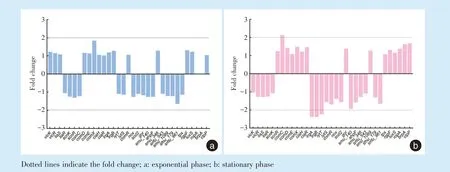
Figure 3 Differential expression levels of oxidation tolerance-related genes in the exponential and stationary phase samples upon srtA deletion图3 srtA 基因缺失后氧化耐受相关基因在对数中期及稳定期的差异表达水平
将上述转录结果中差异表达的TSCTS 编码基因lrgB、lytT 以及既往研究[1,12]显示与氧化耐受显著相关的vicK 通过qPCR 验证其差异表达情况。结果显示,ΔsrtA 菌株的lytT、lrgB、vicK 基因在对数中期、稳定期的表达水平均较UA159 降低,差异有统计学意义(P <0.001)。如图4 所示,ΔsrtA 菌株的vicK 在对数中期、稳定期分别下调10.88、6.57倍,lrgB 下调28.57、53.51 倍,lytT 下调21.41、11.01倍,其差异表达趋势与稳定期RNA-Seq 结果一致。

Figure 4 Differential expression of TSCTS-related genes according to the ΔsrtA strain RNA-seq and qPCR profiles图4 ΔsrtA 菌株的TSCTS 相关基因在RNA-seq 与qPCR 中的差异表达水平
3 讨 论
变异链球菌形成了复杂的调控网络,使之能够更好地耐受氧化压力,也为其应对口腔牙菌斑复杂微生态环境中大量的ROS,如H2O2等提供了优势。变异链球菌的H2O2合成酶相对缺乏,但其拥有NADH 氧化酶Nox 和烷基氢过氧化物酶(alkylhydroperoxidase,AhpF);Nox 和AhpF 的胞内呼吸作用能够将NADH 氧化为NAD+、将氧还原为H2O或H2O2[13]。本研究发现srtA 基因缺失后,对数中期及稳定期变异链球菌样本中,nox、ahpF 和推定的AhpF 编码基因smu_961 表达水平均略有下调,但差异无统计学意义,提示srtA 基因缺失并未对变异链球菌的胞内呼吸作用造成显著影响。
变异链球菌基因组编码了众多不同的脱氢酶和过氧化物酶,如谷胱甘肽氧化还原酶[14](glutathione oxidoreductase,Gor)、硫醇过氧化物酶,以及超氧化物歧化酶(superoxide dismutase,Sod)等来分解代谢胞内ROS。sod、gor 和硫醇过氧化物酶编码基因tpx在ΔsrtA对数中期略有下调,其它NADH脱氢酶的编码基因smu_346、smu_543、smu_1089、smu_179 等转录水平变化也不显著,提示srtA 基因缺失没有对胞内ROS代谢解毒酶类造成直接影响。
变异链球菌典型的调控系统TCSTS 和CCR 以及群体感应机制QS 等可以增强变异链球菌的环境适应性[1],有文献报道ScnRK 系统、LiaRS 系统对酸刺激及氧化耐受等有明显的调控作用[15],CiaRH、ComCDE、ComRS 等也可影响其H2O2耐受性[16]。但本研究结果显示,srtA 基因缺失后,对数中期及稳定期变异链球菌样本中liaRS、scnRK、comX 略有下调,ciaRH、comR、comDE 略有上调,但差异无统计学意义;TCSTS 基因comC 在稳定期显著上调2.1倍。据研究显示,comC 编码产物为QS 通路中ComDE 的信号肽的前体肽,comC 基因对压力敏感且能够调控变异链球菌内众多基因的表达[15-16]。推测comC 在ΔsrtA 稳定期中表达上调可能是因为该信号肽对H2O2刺激压力的响应,从而将该刺激信号传导入细菌整体的调控网络,以便细菌做出相应的调控。
双组分系统LytST 与细菌细胞壁代谢相关[14],LrgAB 的表达对复杂和不利的环境信号高度敏感,与氧化耐受性、热应激、抗生素耐药等毒力因素相关[17],另外,LrgAB 据推测与噬菌体holin 蛋白有相似性[18],在适应环境压力时能调节诱导亚群细胞死亡、裂解,从而有利于整个群体的生存。本研究中lrgA、lrgB、lytT 在ΔsrtA 稳定期的表达水平显著下调2.2~2.4 倍,进一步qPCR 验证lrgB、lytT 下调11.01~53.51 倍。说明srtA 基因缺失影响了变异链球菌以lrgAB、lytST 为主的调控网络,从而将信号整合到细胞整体水平;同时lrgAB 的下调也反应出ΔsrtA 对自身诱导死亡、裂解的负向调控,但作用较弱,故而ΔsrtA 氧化耐受性仍下降。
此外,据报道VicRK 系统对氧化应激也有着明显的调控作用[12],能够显著影响变异链球菌的H2O2耐受能力。虽然本研究中对数中期及稳定期ΔsrtA 的vicRK 变化水平均不显著,但基于既往大量研究对VicRK 系统对氧化应激调控作用的肯定,本次实验选取了vicK(smu_1516)基因进行qPCR 实验。结果表明ΔsrtA 菌株的vicK 在对数中期、稳定期分别下调10.88 与6.57 倍,提示vicK 的差异表达在srtA 基因缺失株的氧化耐受能力降低中发挥着一定的调控作用;与上述lrgAB、lytST 的差异表达信号传递模式相似,这可能与信号整合到细胞调控网络有关。
综上所述,srtA 基因缺失后,变异链球菌过氧化物合成及代谢酶类编码基因表达水平不变,但氧化耐受相关转录调节因子表达水平下降,进而减弱变异链球菌的氧化耐受能力,但具体的作用机制仍需进一步探讨。
