成都地区3种桉树叶挥发油成分与体外抗肿瘤活性的初步研究
2020-05-05孟巧巧岳海燕张玉琴马丹炜
孟巧巧,岳海燕,张玉琴,马丹炜
(四川师范大学生命科学学院,四川 成都 610101)
【研究意义】桉树为桃金娘科(Myrtaceae)桉属(Eucalyptus)的总称,原产于澳大利亚、印度尼西亚岛屿和马布亚新几里亚,共有945个种和变种[1],具有生长快、适应性广、产量高等特性[2],与杨树(Populus)、松树(Pinus)并称为三大速生造林树种[3],具有蓄水保土、固碳释氧、积累营养物质、净化环境等生态功能[4],被世界各地大规模引种栽培[5]。【前人研究进展】桉树引入我国已经有120多年的历史,目前我国的桉树人工林主要分布在长江以南地区[4],种植面积超过460万hm2,仅次于巴西[6]。桉树叶富含挥发油,但不同种类和不同地区桉树的挥发油成分和含量差异较大[7]。桉树挥发油中含有丰富的生物活性物质,具有抗氧化[8-9]、抗菌[10-12]、抗病毒[13-14]、驱虫[15-17]等活性,对糖尿病也具有一定的疗效[8]。近年来,有关桉树挥发油抗肿瘤活性的研究逐渐成为热点[18-23],如托里桉(E.torelliana)[20]、本沁桉(E.benthamii)[21]、柠檬桉(E.citriodora)[22]、赤桉(E.camaldulensis)[23]等植物的挥发油均具有一定的抗肿瘤活性,但这些研究仅涉及桉属900多种的少数种类。桉属植物是成都市园林绿化中主要的行道树树种,有关成都地区桉属次生代谢物质抗肿瘤活性的研究较少。【本研究的切入点】本研究采用水蒸气蒸馏法提取了成都地区的蓝桉(E.globulus)、巨桉(E.grandis)和大叶桉(E.robusta)叶的挥发油,运用GS-MS技术进行成分分析,归一化法测定了各成分相对含量;分别以人正常肝L02细胞和人肝癌SMMC-7721细胞为受试细胞株,采用MTT法初步评价了3种桉树叶挥发油的抗肿瘤活性。【拟解决的关键问题】旨在为成都地区桉属资源的综合利用和挖掘其药用价值提供理论依据。
1 材料与方法
1.1 供试材料
蓝桉、巨桉、大叶桉的叶于2016年12月采集于四川师范大学成龙校区和狮子山校区及其附近街道;人正常肝L02细胞和人肝癌SMMC-7721细胞源自四川大学华西医院生物治疗国家重点实验室。
1.2 研究方法
1.2.1 挥发油的制备 分别将3种桉树叶阴干后剪成小段,准确称取1000 g,水蒸气蒸馏法提取4 h,得到淡黄色透明并具有芳香性气味的挥发油,无水Na2SO4除去水分,称重,得油率以干重计;用0.22 μm微孔滤膜过滤后用于GC-MS分析。
1.2.2 挥发油成分的GS-MS分析 采用 Aglient 7890A/ 5975c气相色谱-质谱联用仪分别测定3种桉树挥发油的成分和相对含量。
气相色谱条件:色谱柱为DB-5ms(规格为60 m×0.25 mm×0.25 μm)毛细管色谱柱;恒流模式,载气为99.999 %氦气,流量为1.0 mL·min-1;升温程序为起始温度50 ℃,保持2 min,以5 ℃·min-1升至200 ℃,再以20 ℃·min-1升至280 ℃,保持2 min;进样口温度为250 ℃;采用20︰1分流比进样,进样体积为1 μl。
质谱条件:采用单四极杆质谱检测器,电子轰击离子源(EI),电子能量70 eV,离子源温度为230 ℃,四级杆温度为150 ℃,气相色谱质谱接口温度为250 ℃;溶剂延迟10 min,全扫描模式。挥发性成分经质谱扫描后,在Agilent Chemstation化学工作站得到总离子流量图,经NIST标准谱库检索,从特征离子及相对丰度等方面进行比较,确定各色谱峰对应的化学成分。用峰面积归一法对各化合物进行定量,计算出各组分的相对含量。
1.2.3 抗肿瘤活性的测定 用含10 %新生牛血清、1 %青-链霉素的RPMI-1640培养液培养L02细胞和SMMC-7721细胞,37 ℃、5 %CO2、饱和湿度条件下进行常规培养。采用MTT法测定3种挥发油对2种细胞的抑制率及半抑制浓度(IC50值)。具体方法是取对数生长期细胞分别消化、离心,培养液重悬制成细胞悬液,血细胞计数板计数,每孔100 μl,1×105个/mL接种于96孔板,放于CO2培养箱中孵育过夜,细胞贴壁后进行处理。处理组加入经DMSO稀释为不同浓度的挥发油2 μl,每孔补加98 μl RPMI-1640培养液,使挥发油的最终浓度分别为3.13,6.25,12.50,25.00和50.00 μg·mL-1,且设置阴性对照和溶剂对照(1 %DMSO),每处理6次重复。培养24 h后,20 μl MTT溶液(用PBS配制成浓度为5 mg·mL-1,过滤除菌后,置于-20 ℃冰箱避光保存)作用4 h,弃上清,每孔加入150 μl DMSO,置于多功能酶标仪(MD/Spectra Max M2)内振荡5 min,490 nm下测吸光值(OD值)。
细胞增殖抑制率(%) =(1-OD处理组/OD溶剂对照)×100 %
1.2.4 统计分析 采用SPSS 17.0进行ANOVA方差分析,Duncan法进行多重比较,Probit法分析IC50值,采用Microsoft Excel 2010作图。
2 结果与分析
2.1 成都3种桉树挥发油的GC-MS分析鉴定
用水蒸气蒸馏法提取的蓝桉、巨桉和大叶桉挥发油的质量浓度分别为912.22、945.71和836.67 mg·mL-1,挥发油得率分别为3.67 %、1.21 %和0.43 %;蓝桉叶挥发油分离出39个色谱峰(图1),共鉴定出34种化合物,占总离子峰的96.14 %;巨桉叶挥发油分离出42个色谱峰(图2),共鉴定出34种化合物,占总离子峰的93.95 %;大叶桉挥发油分离出42个色谱峰(图3),共鉴定出31种化合物,占总离子峰的86.76 %。
3种桉树叶的挥发油成分和相对含量结果见表1。蓝桉叶挥发油的主要成分是α-蒎烯(17.18 %)、柠檬烯(4.65 %)、桉油精(59.55 %)、邻伞花烃(4.40 %)等,占挥发油总量的85.78 %;巨桉叶挥发油的主要成分是α-蒎烯(17.89 %)、柠檬烯(4.38 %)、桉油精(50.49 %)、邻伞花烃(6.71 %)等,占挥发油总量的79.47 %;大叶桉挥发油的主要成分是α-蒎烯(41.91 %)、柠檬烯(5.28 %)、桉油精(7.68 %)、松香芹醇(12.49 %)等,占挥发油总量的67.36 %;3种挥发油有17种共有成分,即α-蒎烯、二环庚烷7,7-二甲基-2-亚甲基、莰烯、柠檬烯、桉油精、葑醇、龙脑烯醛、松香芹醇、龙脑、异松蒎酮、4-萜烯醇、反式-1(7),8-孟二烯-2-醇、香芹酮、别香橙烯、石竹烯、邻伞花烃和苹果香精。在共有成分中,含量最高的成分为α-蒎烯和桉油精。在蓝桉、巨桉、大叶桉的挥发油中,α-蒎烯的相对含量分别为17.18 %、17.89 %、41.91 %,桉油精相对含量分别为59.55 %、50.49 %、7.68 %;3种桉树挥发油的成分和含量差异较大,蓝桉和巨桉叶挥发油中含量最高的成分是桉油精,分别占59.55 %和50.49 %,而大叶桉挥发油中含量最高的成分为α-蒎烯(41.91 %)。
2.2 成都地区3种桉树挥发油体外抗肿瘤活性
MTT试验结果表明,3种桉树挥发油对L02细胞和SMMC-7721细胞的增殖均有不同程度的抑制作用(图4),并且呈现浓度依赖性(P<0.05)。用挥发油处理24 h时,蓝桉、巨桉和大叶桉的挥发油对L02细胞的IC50分别为21.29、9.40和5.08 μg·mL-1,对SMMC-7721细胞的IC50分别为13.53、7.36和4.66 μg·mL-1。3种挥发油对2种细胞的抑制效应从大到小依次为大叶桉、巨桉和蓝桉,SMMC-7721细胞对挥发油的敏感性大于L02细胞。由此可见,成都地区3种桉树挥发油具有抗肿瘤活性,且对人正常细胞的抑制效应小于肿瘤细胞。
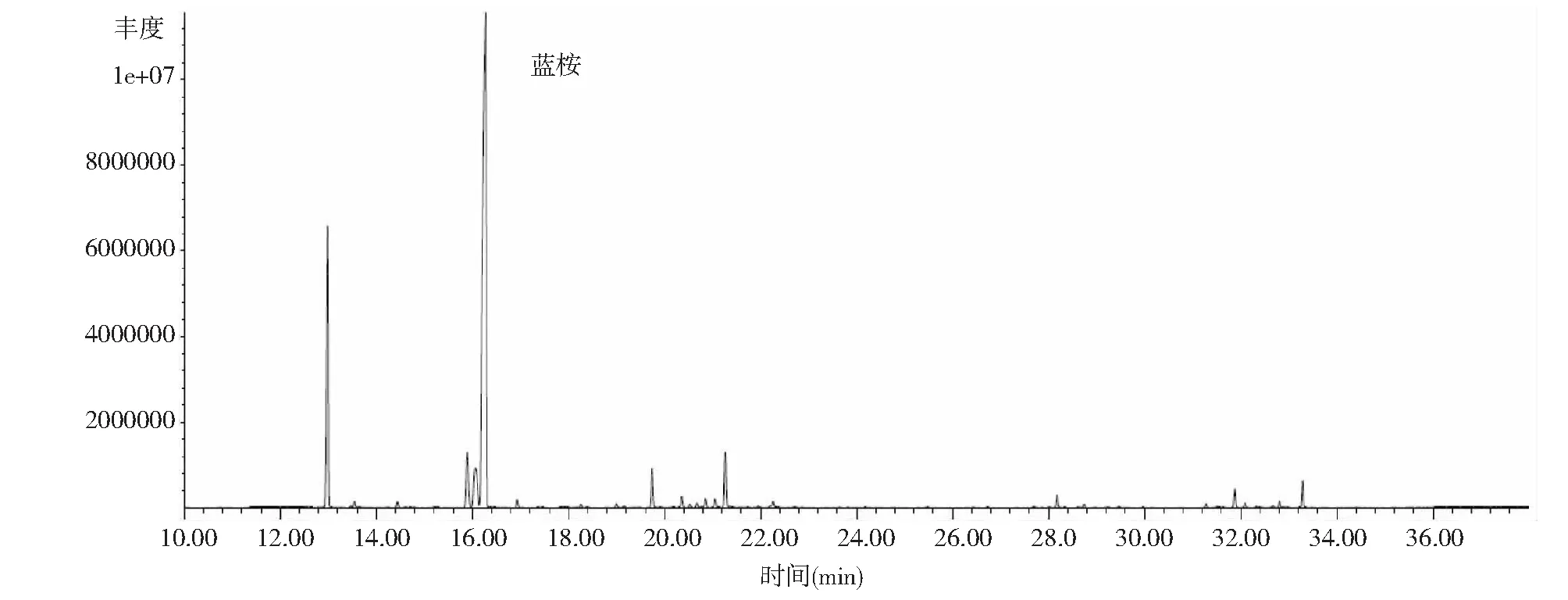
图1 成都地区蓝桉叶挥发油GC-MS总离子流色谱图Fig.1 Total ion chromatogram of the essential oil from the leaves of Eucalyptus globulus in Chengdu
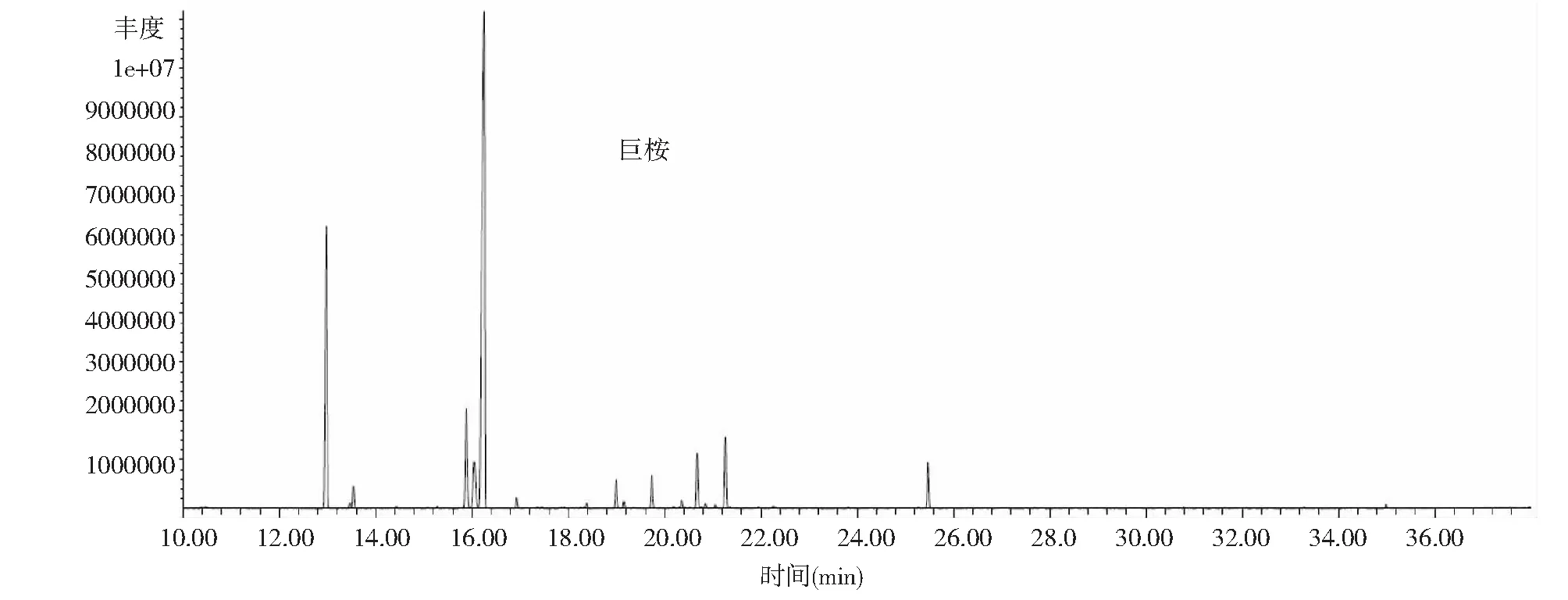
图2 巨桉叶挥发油GC-MS总离子流色谱图Fig.2 Total ion chromatogram of the essential oil from the leaves of Eucalyptus grandis in Chengdu
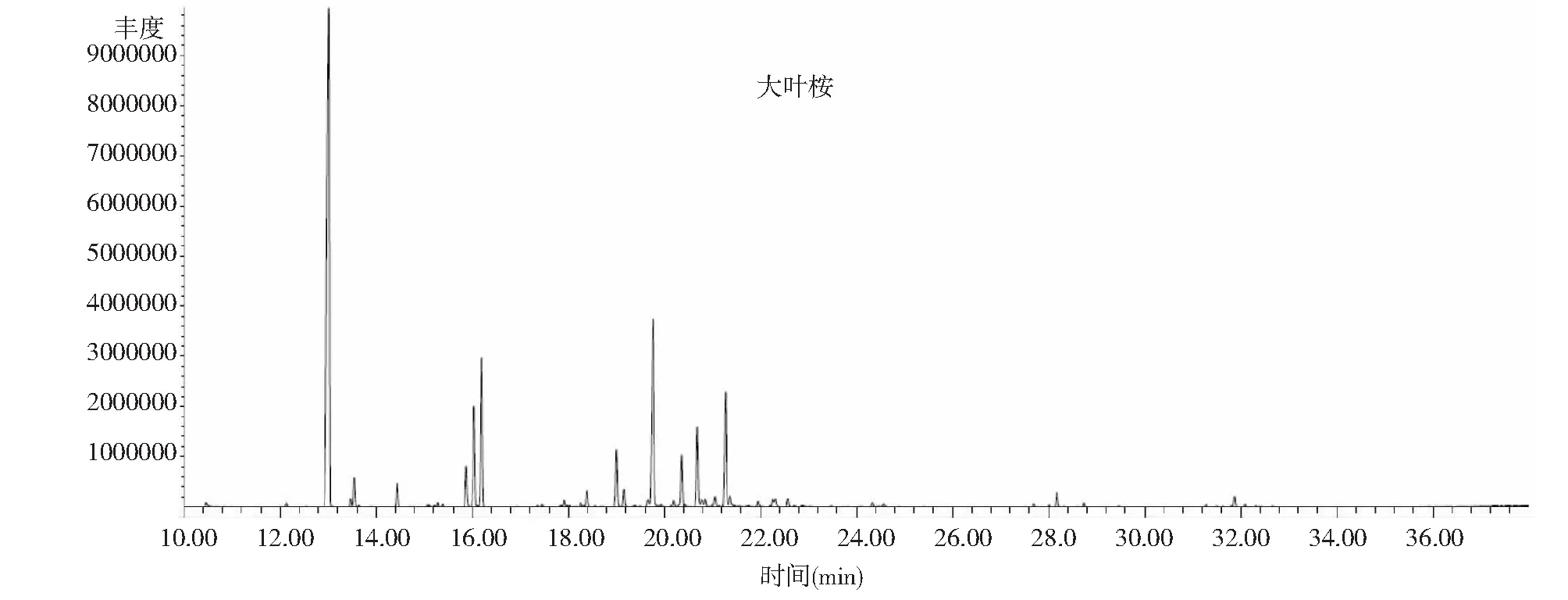
图3 大叶桉叶挥发油GC-MS总离子流色谱图Fig.3 Total ion chromatogram of the essential oil from the leaves of Eucalyptus robusta in Chengdu
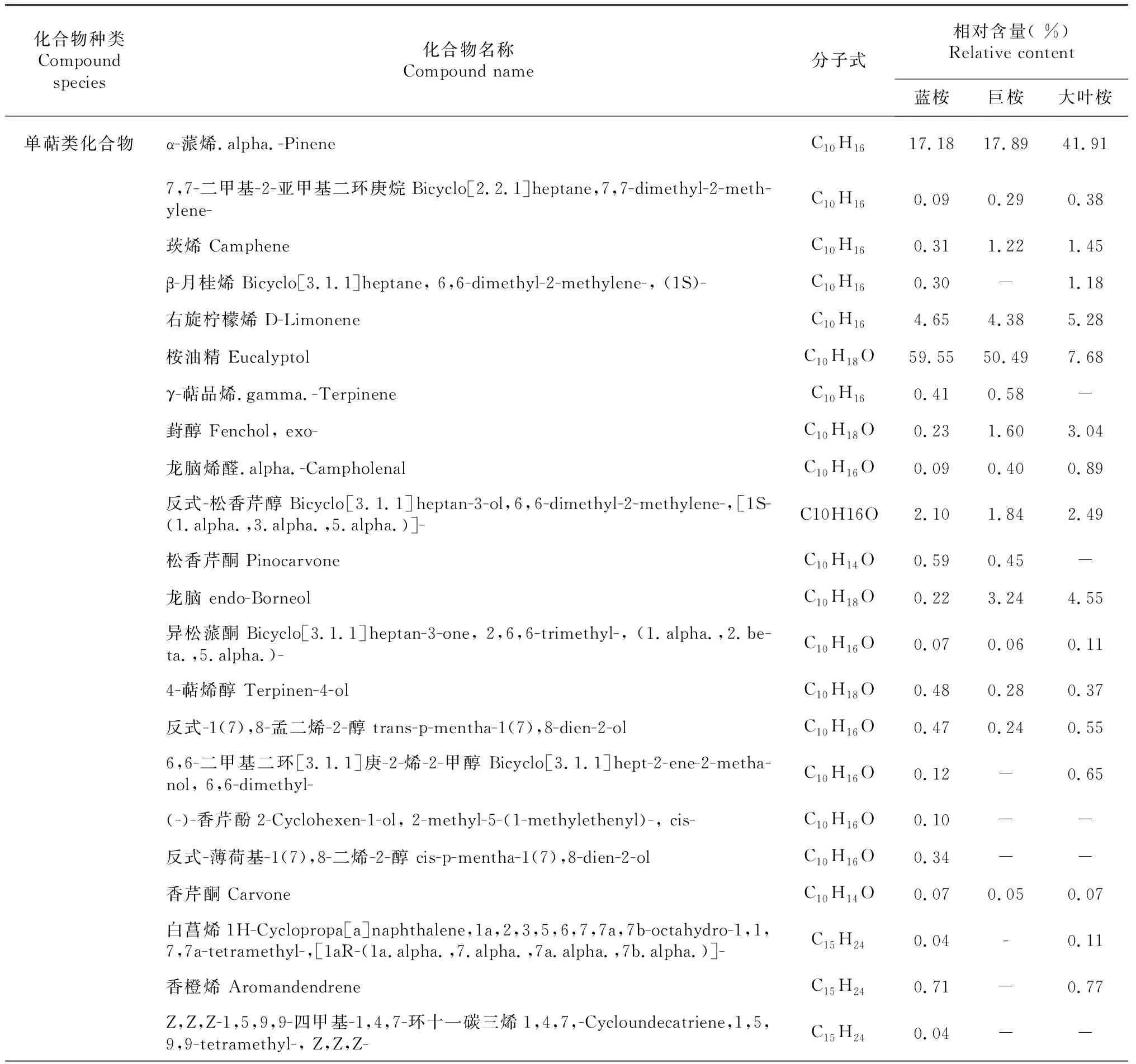
表1 成都地区3种桉树叶挥发油的化学组成Table 1 Chemical component of the essential oils from three Eucalyptus species leaves in Chengdu

续表1 Continued table 1
3 讨论与小结
3.1 成都地区3种桉树叶挥发油成分的差异
Sebei,et al.[24]研究表明,在同一地区桉属不同种类中,挥发油的成分和含量差异较大。本研究供试的3种桉树叶中,挥发油得率最高的是蓝桉(3.67 %),其次是巨桉(1.21 %),含量最少的是大叶桉(0.43 %)。从蓝桉的挥发油中检出34种化合物,其中相对含量大于1 %的成分为7种,占挥发油总量的90.07 %;从巨桉挥发油中检出的34种化合物,相对含量大于1 %的成分为9种,占挥发油总量的89.93 %;从大叶桉挥发油中检出31种化合物,相对含量在1 %以上的成分有9种,占挥发油总量的79.88 %;α-蒎烯、莰烯、右旋柠檬烯、桉油精、葑醇、龙脑烯醛、龙脑、香芹酮、别香橙烯、石竹烯、邻伞花烃等共17种化合物是3种挥发油的共有成分。在这些共有成分中,含量最高的成分均为α-蒎烯和桉油精,但含量明显差异,在蓝桉、巨桉和大叶桉的叶挥发油中,α-蒎烯的含量分别为17.18 %、17.89 %和41.91 %,桉油精的含量分别为59.55 %、50.49 % 和7.68 %。
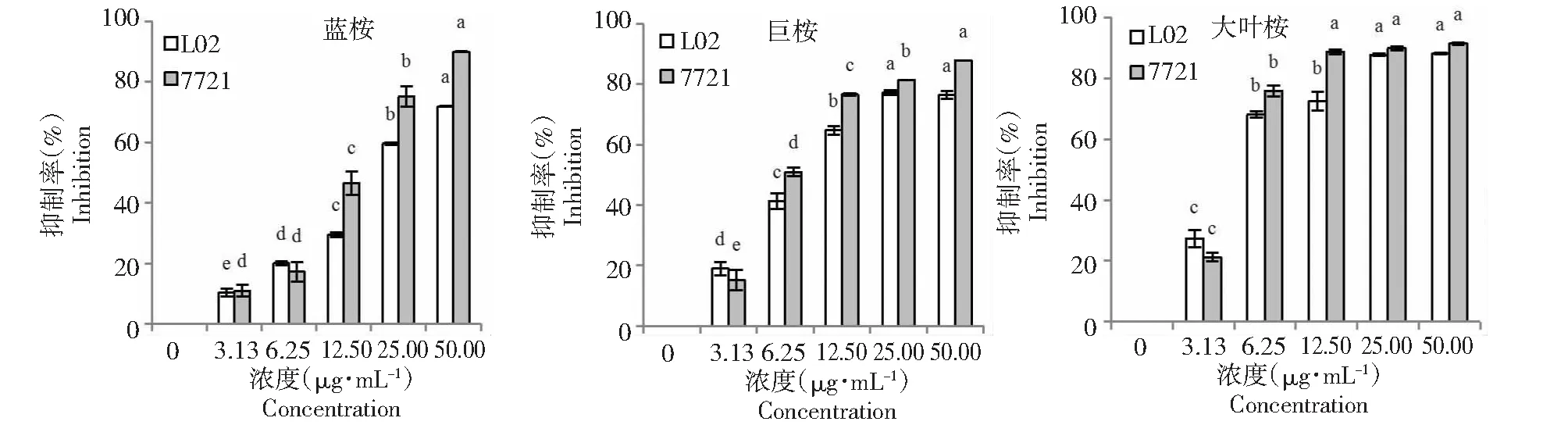
不同小写字母表示P<0.05的显著水平图4 3种桉树叶挥发油对SMMC-7721细胞和L02细胞增殖的抑制作用Fig.4 Inhibitory effects of three Eucalyptus essential oils on cell proliferation of SMMC-7721 cell and L02 cells
另一方面,分布在不同地区的同种桉树的挥发油成分及其相对含量也具有较大的差异。云南省苍山区的蓝桉挥发油主要成分为桉油精(72.71 %)、α-松油醇(2.54 %)、α-蒎烯(9.22 %)、蓝桉醇(2.77 %)、乙酸松油酯(3.10 %)和香树烯(2.47 %)[25];突尼斯市的蓝桉挥发油主要成分为桉油精(48.20 %)、α-蒎烯(16.10 %)、γ-萜品烯(8.90 %)和对伞花烃(8.80 %)[10];巴西的蓝桉挥发油的主要成分是α-蒎烯(4.63 %)、对伞花烃(5.35 %)、柠檬烯(6.38 %)和桉油精(83.65 %)[26]。本研究发现,成都地区的蓝桉挥发油的主要成分是α-蒎烯(17.18 %)、柠檬烯(4.65 %)、桉油精(59.55 %)、松香芹醇(2.10 %)、愈创木烯(1.00 %)、桉油醇(1.19 %)和邻伞花烃(4.40 %),比较不同地区蓝桉的挥发油成分的含量可见,蓝桉叶挥发油中含量最高的成分均为桉油精;阿根廷的巨桉叶挥发油主要成分是α-蒎烯(52.71 %)、邻伞花烃(9.70 %)、桉油精(18.38 %)和龙脑(2.95 %)等[27],本研究结果表明,成都地区巨桉叶挥发油的主要成分是α-蒎烯(17.89 %)、柠檬烯(4.38 %)、桉油精(50.49 %)、邻伞花烃(6.71 %)和龙脑(3.24 %),阿根廷和成都地区的巨桉叶的挥发油中含量最高的成分均为α-蒎烯;巴西大叶桉挥发油主要成分是α-蒎烯(73.00 %)、β-蒎烯(6.80 %)、月桂烯(0.80 %)、水芹烯(2.30 %)、柠檬烯(8.30 %)、异松油烯(1.60 %)和蓝桉醇(1.30 %)等[28],本研究结果表明,成都市大叶桉挥发油的主要成分是α-蒎烯(41.91 %)、月桂烯(1.18 %)、蓝桉醇(0.13 %)和柠檬烯(5.28 %)等,不同地区的大叶桉挥发油含量最高的均是α-蒎烯。
3.2 成都地区3种桉树叶挥发油体外抗肿瘤活性
前人研究表明,桉树挥发油具有抑制肿瘤细胞增殖的效应,如托里桉(E.torelliana)[20]、本沁桉(E.benthamii)[21]、柠檬桉(E.citriodora)[22]、赤桉(E.camaldulensis)[23]等的挥发油均具有体内和体外抗肿瘤活性。本研究结果表明,成都地区的蓝桉、巨桉和大叶桉叶挥发油对人肝癌SMMC-7721细胞均具有抑制效应,其IC50分别为13.53、7.36 和4.66 μg·mL-1,以大叶桉挥发油的抗肿瘤活性最佳。因此,桉属植物叶的挥发油普遍具有抗肿瘤活性,具有较大的开发潜力。
本沁桉叶挥发油的抗肿瘤活性大于其单体成分α-蒎烯、4-萜烯醇和γ-萜品烯的抗肿瘤活性[20],推测其原因是挥发油的各成分之间存在着协同作用,主要成分的活性可以被其他微量成分调节,从而使挥发油发挥更好的抗肿瘤活性[29]。Newman et al.[17]的研究表明,桉油精具有诱导肿瘤细胞凋亡的效应,本研究的3种桉树挥发油的主要成分均是α-蒎烯和桉油精,本研究室将在后续研究中进一步分析3种桉树叶挥发油主要成分的抗肿瘤活性以及不同成分之间的协同效应。
