携galectin-7-siRNA超声纳泡靶向治疗大鼠心脏移植急性排斥反应的实验研究
2020-04-30赵冰冰李守强于丹丹姜双全冷晓萍
王 卓 赵冰冰 李守强 于丹丹 赵 晨 姜双全 冷晓萍
随着心脏移植术手术方式的不断改进及免疫抑制剂的发展和应用,心脏移植已逐渐成为治疗终末期心力衰竭的有效方法。然而,由T-细胞介导主导的急性排斥反应仍是影响移植患者心脏功能和长期存活的重要因素之一[1]。T细胞活化和细胞因子的产生是移植排斥反应的中心环节。探索移植排斥反应的免疫机制、寻找新的阻断排斥反应的作用位点是抑制急性排斥反应的重要途径[2-3]。研究[4]表明,半乳糖凝集素-7(galectin-7)特异性表达于移植器官的血管内皮细胞及浸润淋巴细胞表面,可以促进T细胞的分化和增殖,进而发生移植排斥反应。因此,通过抑制galectin-7蛋白的表达有可能抑制移植后急性排斥反应。本实验拟建立大鼠心脏移植急性排斥反应模型,以发生排斥反应心肌大量表达的血管内皮细胞表面黏附因子(intercellular adhesion molecule-1,ICAM-1)作为靶点,利用ICAM-1靶向阳离子超声纳泡(chronic nanobubbles,CNBs)作为 galectin-7-干扰核糖核酸(siRNA)的载体,通过超声靶向微泡定位释放(ultrasound-targeted microbubble destruction,UTMD)技术,即使用低强度聚焦超声(low intensity focused ultrasound,LIFU)辐照靶向纳泡,使其靶向释放galectin-7-siRNA,介导siRNA下调galectin-7的表达从而达到抑制急性排斥反应的目的,实现心脏移植急性排斥反应的靶向治疗。
材料与方法
一、实验动物及心脏模型制备
1.实验动物:雄性Lewis大鼠60只,体质量180~200 g;雄性 Brown Norway大鼠 36只,体质量 180~200 g。均购于北京维通利华实验动物技术有限公司。
2.模型制备及分组:采用改良的Ono术式行大鼠异位心脏移植术,将供体的升主动脉和肺动脉分别与受体的腹主动脉和下腔静脉吻合,制备心脏移植模型。以雄性Lewis大鼠作为心脏受体,Lewis大鼠作为心脏供体构建同系移植ISO组(n=12),Brown Norway大鼠作为心脏供体构建异系移植ALLO组,共36只,随机将其分为ALLO+磷酸盐缓冲液(PBS)+LIFU组、ALLO+微泡(NBs)组及ALLO+NBs+LIFU组,每组各12只。
二、实验主要试剂和仪器
1.主要试剂:二硬脂酰磷脂酰胆碱(PSPC,美国Avanti公司);二硬脂酰磷脂酰乙醇胺聚乙二醇2000-生物素(PSPE-PEG-2000-biotin,美国Avanti公司);链霉亲和素(美国Sigma公司);小鼠抗大鼠ICAM-1抗体(美国Abcam公司);生物素化小鼠抗大鼠ICAM-1抗体(美国Abcam公司);FAM-Galectin-7-siRNA(江苏吉马基因股份有限公司);APC标记的兔抗小鼠荧光二抗;苏木素-伊红染料;DAB显色剂(美国RD公司);抗荧光淬灭剂(上海碧云天生物技术有限公司);全氟丙烷气体(天津核工业厂);液氮(哈尔滨黎明气体厂)
2.仪器与设备:使用Philips iE Elite彩色多普勒超声诊断仪,超净工作台(苏州净化设备厂);光学显微镜(日本Olpympus公司);手术显微镜(日本Olpympus公司);精密电子天平(日本岛津公司);荧光显微镜(德国Lecia公司);流式细胞仪(美国BD公司);库尔特颗粒计数仪(美国Beckman Coulter公司);银汞振荡仪(广东佛山斯凯斯医疗器械公司);LIFU实验装置(重庆融海超声医学工程研究中心);Nano-ZS 90纳米粒度及Zeta电位分析仪(英国马尔文仪器有限公司)。
三、靶向超声纳泡构建
携galectin-7-siRNA靶向纳泡的构建采用薄膜-水化法制备超声纳泡,分别取PSPC 10 mg、DSPEPEG-2000-biotin 4 mg及DC-chol 1 mg,加入450 μl去离子水和50μl甘油充分混匀,置于40℃水浴30 min,4℃冰箱中10 min,转移至充满全氟丙烷气体的特制管型瓶中,使用银汞振荡仪振荡50 s(频率600次/min),静置后加入稀释并离心,所得上层的乳白色悬浮带即为脂质阳离子纳泡;并将其浓度稀释为1.0×107NBs/ml,加入6μg链霉亲和素于4℃孵育30 min,并离心2次,去除过量的链霉亲和素。再加入6μg生物素化的ICAM-1抗体,于4℃孵育30 min,离心2次,去除过量的ICAM-1抗体,即得到携ICAM-1抗体的靶向阳离子纳泡(NBICAM-1)[5]。显微镜观察纳泡的形态,使用纳米粒度及电位分析仪检测纳泡的粒径和表面电位。
将NBICAM-1与绿色荧光标记的大鼠galectin-7-siRNA按照荷电比1∶2~2∶1的不同比例混合,室温孵育30 min,通过静电吸附作用得到galectin-7-siRNA/NBICAM-1,离心2次,去除过量的siRNA。应用红色荧光标记的二抗与galectin-7-siRNA/NBICAM-1孵育,使其与ICAM-1抗体结合,并在荧光显微镜下观察siRNA及ICAM-1与纳泡连接的情况,流式细胞仪检测siRNA及 NBICAM-1连接率[6]。
四、UTMD介导载基因靶向纳泡治疗心脏移植排斥反应
ISO组和ALLO组大鼠于术后第1、3、5、7天分别经鼠尾静脉注射靶向纳泡(浓度1×107NBs/ml)400μl或等剂量的PBS,随即用2 ml生理盐水冲管,注射30 s后,使用LIFU实验装置对移植心脏进行靶向爆破,频率1 MHz,功率2.0 W/cm2,占空比50%,使用超声诊断仪造影模式于胸骨旁乳头肌水平短轴持续观察,至心肌内纳泡显影完全消失时停止LIFU爆破。
五、病理学检测
于心脏移植后第10天处死大鼠并摘取供心标本,用4%福尔马林固定24 h,梯度酒精脱水、二甲苯透明,进行石蜡包埋并切片(厚度6μm),行HE染色,光镜下观察心肌的病理学改变。排斥反应的病理学分级依照国际心肺移植协会(ISHLT)制定的标准[7]:0级,正常心肌;Ⅰ级,排斥反应表现为少量淋巴细胞浸润,无心肌坏死;Ⅱ级,排斥反应表现为中等量淋巴细胞浸润伴少量心肌坏死;Ⅲ级,排斥反应表现为弥漫型淋巴细胞浸润伴中等量心肌坏死;Ⅳ级,排斥反应表现为弥漫型淋巴细胞浸润伴严重心肌坏死。
另取切片行免疫组化染色,用抗大鼠的galectin-7抗体(0.5 mg/ml)孵育于4℃过夜,链亲和素-辣根过氧化物酶室温孵育30 min,应用DAB显色剂进行显色,并在显微镜下观察galectin-7的分布及表达程度,使用Image Pro Plus软件分析galectin-7表达情况。
六、统计学处理
应用SPSS 19.0统计软件,计量资料以x±s表示,组间两两比较采用单因素方差分析;病理等级比较行K独立样本检验。P<0.05为差异有统计学意义。
结 果
一、siRNA/NBs的表征及基因携带能力检测
纳泡在光镜下显示为均匀分布的球形(图1A),平均粒径(221.25±34.21)nm(图1B),其Zeta电位(51.32±2.21)mV(图1C)。荧光显微镜下观察显示靶向纳泡表面携带抗ICAM-1为红色荧光,siRNA为绿色荧光(图2)。流式细胞仪检测结果显示,同时携带ICAM抗体和galectin-7-siRNA的微泡所占百分比为71%(图3)。
二、免疫组化检测UTMD体内转染效率
免疫组化结果显示,ALLO+PBS+LIFU组和ALLO+NBs组均可观察到心肌组织内galectin-7大量表达,ALLO+NBs+LIFU组中galectin-7阳性细胞数量显著减少,galectin-7表达水平减低,与ALLO+NBs组和ALLO+PBS+LIFU组比较差异均有统计学意义(均P<0.05)。见图4,5。
三、移植心脏排斥反应分级
ALLO+PBS+LIFU组和ALLO+NBs组的大鼠供体心脏切片均可观察到心肌及心内膜中有大量淋巴细胞浸润,心肌细胞凝结坏死,心肌间质内大量红细胞聚集,符合ISHLTⅢ~Ⅳ级。与ALLO+PBS+LIFU组和ALLO+NBs组比较,ALLO+NBs+LIFU组显示免疫排斥反应相对较弱,仅2只符合排斥反应Ⅲ级,其余10只均表现为血管病变较局限,心肌内仅出现少量坏死,淋巴细胞浸润多见于心内膜,但数量明显减少,符合ISHLTⅠ~Ⅱ级(图6),与ALLO+NBs组及ALLO+PBS+LIFU组比较差异均有统计学意义(均P<0.05)。见图7。
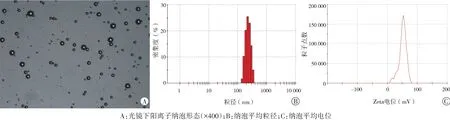
图1 靶向纳泡特性检测图

图2 携galectin-7-siRNA靶向纳泡特性检测图
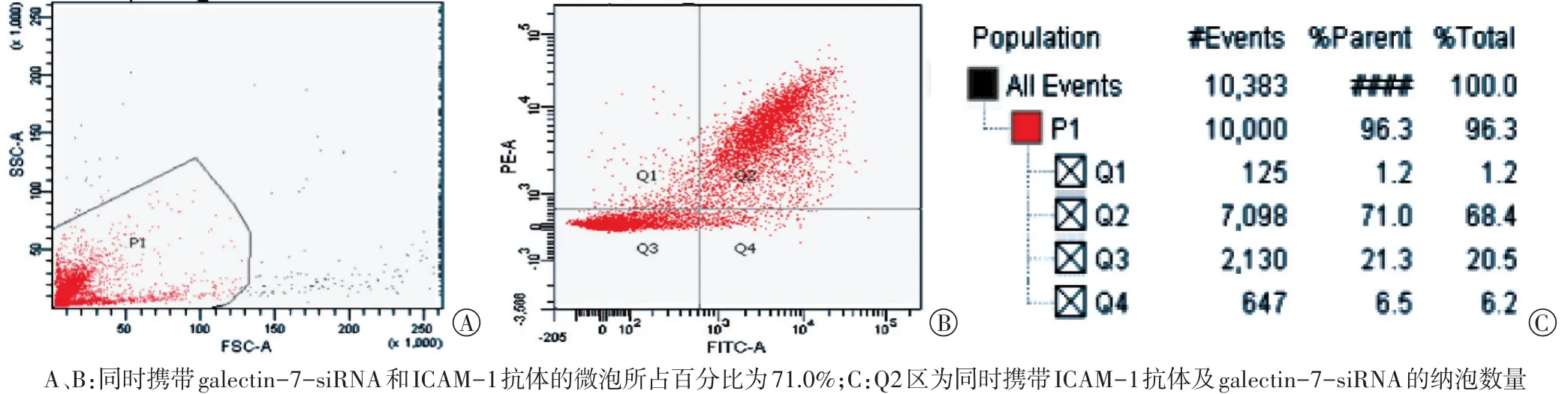
图3 靶向纳泡与galectin-7-siRNA和ICAM抗体的连接率
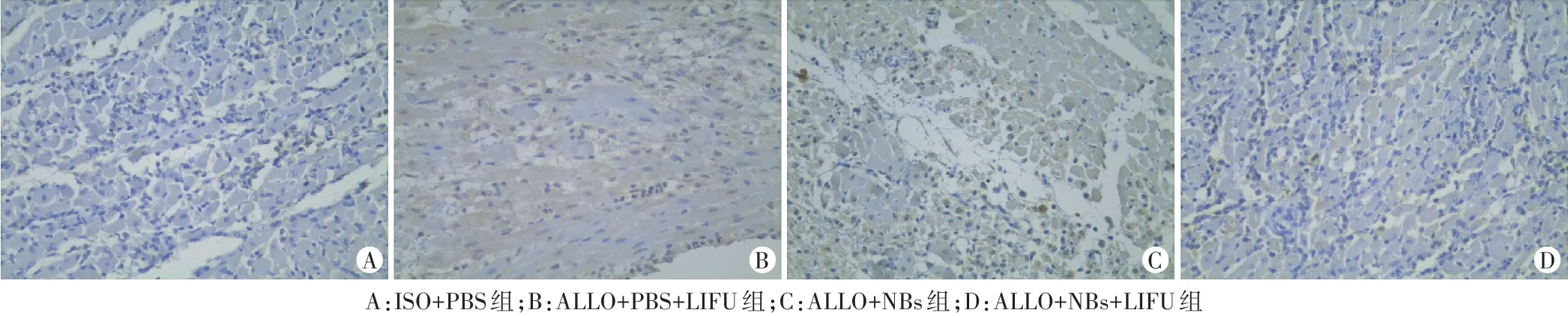
图4 免疫组化检测各组大鼠移植心脏内galectin-7表达(×400)
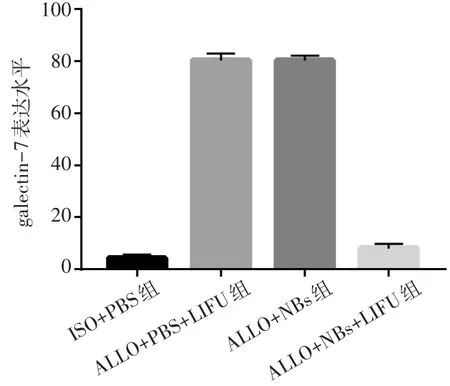
图5 各组大鼠移植心脏galectin-7表达水平比较
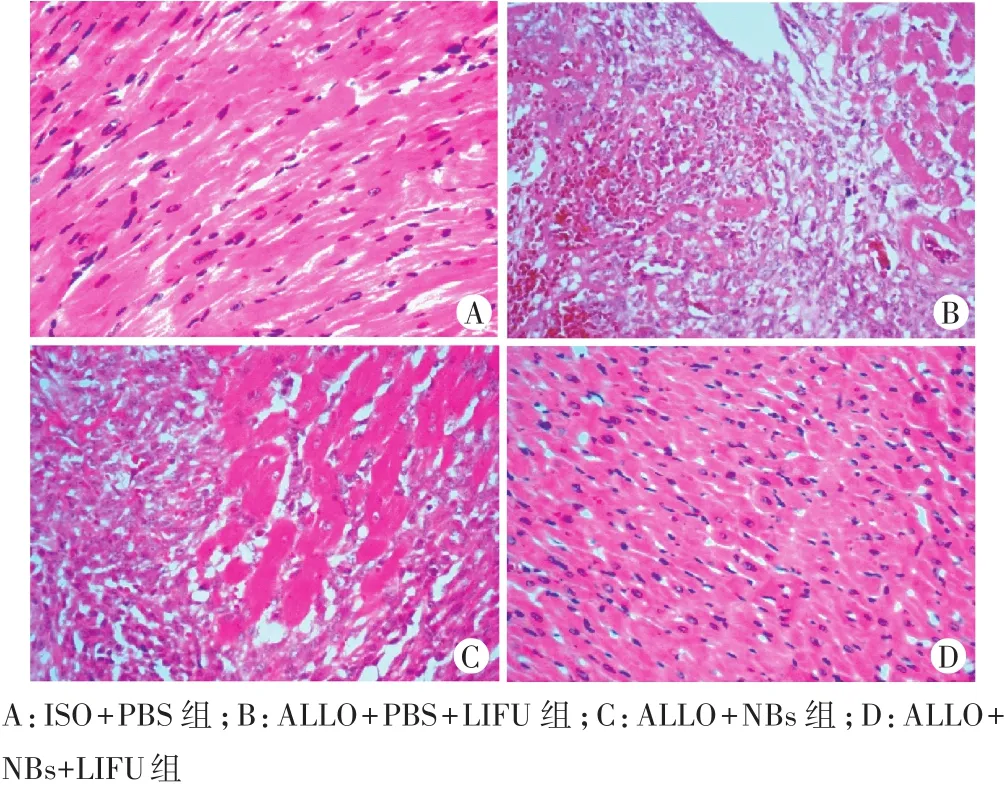
图6 HE染色检测各组大鼠移植心脏急性排斥反应程度(×400)
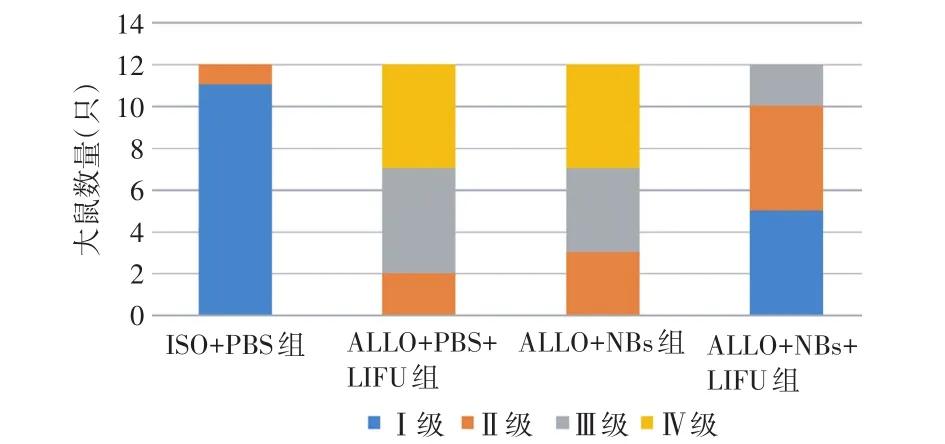
图7 各组大鼠移植心脏急性排斥反应分级图
讨 论
心脏移植后,早期发现和及时治疗急性排斥反应对于患者的远期存活至关重要。目前的免疫抑制疗法主要使用小分子药物,但由于其半衰期短,对细胞特异性不足,长期使用易导致全身免疫系统失衡,造成感染及肿瘤等并发症。因此,临床上迫切需要一种克服小分子药物上述缺陷的新的治疗方法。siRNA体积小,易于包被成为抑制细胞中mRNA表达的有效方法,但存在在生物体内不稳定,易被核酸降解,半衰期短,转染效率低的问题,因此需要基因载体使目的基因运送至靶细胞[8-9]。病毒是基因传递最常用的载体,病毒载体虽然具有较高的基因转染效率,但因存在毒性和免疫原性等问题其应用受限。本实验采用UTMD技术,利用超声纳泡这种安全、便捷的非病毒载体载入 siRNA,靶向释放基因[10]。
研究[11-12]表明,galectin-7蛋白特异性表达在移植器官的血管内皮细胞和浸润淋巴细胞表面,并与细胞的凋亡和增殖有关。在T细胞介导的急性排斥反应中,Th1型细胞因子可以诱发迟发型变态反应,启动或加速器官移植排斥反应的发生发展;Th2型细胞因子可抑制Th1细胞的分化和Th1型细胞因子的表达,调节免疫排斥反应,促进器官移植免疫耐受的建立。galectin-7对T淋巴细胞具有促进增殖及诱导Th1/Th2细胞平衡向Th1细胞优势应答偏移的作用,从而诱导移植排斥反应发生。另有研究[11]表明,galectin-7可以与抗CD3/CD28抗体活化的T细胞中的pSmad3蛋白相互作用,并诱导pSmad3蛋白向胞浆转位,表明galectin-7有阻断活化的T淋巴细胞TGFβ/Smad信号通路的作用;由此也反映通过抑制galectin-7在活化的CD4+T细胞中的表达有可能抑制急性排斥反应的发生。本实验中,ALLO+PBS+LIFU组和ALLO+NBs组心肌组织内见大量galectin-7表达,而当使用NBs+LIFU成功抑制异系移植大鼠galectin-7表达量后,急性排斥反应的程度明显减弱,证明在急性排斥反应的早期抑制galectin-7蛋白表达,可以达到抑制急性排斥反应的效果,也说明galectin-7有望成为急性排斥基因治疗的全新靶点。
本实验使用了ICAM-1靶向纳泡,使其能够聚集在急性排斥反应发生区域,同时使用UTMD提高siRNA转染效率,通过UTMD产生的声孔效应,使siRNA直接进入细胞内,实现溶酶体逃逸,从而提高基因敲除效率[13]。本实验结果显示,ALLO+PBS+LIFU组、ALLO+NBs组及ALLO+NBs+LIFU组比较,前两组galectin-7表达量基本相似,而ALLO+NBs+LIFU组galectin-7蛋白表达量明显减低(均P<0.05),说明靶向ICAM-1的纳泡能够有效地将galectin-7-siRNA转运到大鼠心肌组织细胞中,并能成功减低galectin-7表达,证明UTMD技术结合siRNA靶向基因敲除具有较高效率。
综上所述,本实验通过UTMD结合ICAM-1靶向纳泡,成功实现galectin-7-siRNA的体内转染,并通过抑制galectin-7蛋白的表达减轻了移植后急性排斥反应,证明UTMD结合galectin-7-siRNA基因转染有望成为治疗心脏移植后急性排斥反应的一种新方法。
