晚期肺肉瘤样癌1例及文献复习
2020-04-27陈乐陈飞宇胡福安王鹏杜进臣王占鹏李庆新
陈乐 陈飞宇 胡福安 王鹏 杜进臣 王占鹏 李庆新△
1)宁夏医科大学研究生院 银川 750004 2)中国人民解放军联勤保障部队第940医院普胸外科 兰州 730050
肺肉瘤样癌(PSC)是一种以肉瘤样为主、低分化罕见的非小细胞肺癌(NSCLC),占肺原发性恶性肿瘤的0.1%~0.4%,恶性程度高,高度侵袭性,预后差,无特异型临床表现,就诊时多数已属晚期[1]。现结合文献复习对我科近期收治的1例PSC患者的临床资料进行分析,以提高对该疾病的认识。
1 病例资料
患者男性,56岁。因“反复咳嗽、胸痛、呼吸困难3月伴痰中带血1周”于2019年5月24日入院。长期吸烟,20支/d,约40 a。2019年5月24日胸部CT(图A、B)示:右肺上叶实变影内可见空洞形成。查体:体温36.8℃,脉搏74次/分,呼吸24次/分,血压92/61 mmHg。全身浅表淋巴结未触及,右胸腔闭式引流管内水柱波动大,引出不凝固的血性液体。右肺呼吸运动减弱,语颤及语音传导减弱。右下肺叩诊浊音,右上肺叩诊鼓音,听诊右肺呼吸音弱。2019年5月28日再次复查胸部CT(图C、D)示:右肺上叶肿块影,与胸膜粘连,其内可见3.5 cm×2.2 cm的空洞,右侧胸腔可见引流管影。头颅MRI扫描(图E、F)示:双侧额叶及右侧小脑半球多发结节影,考虑转移瘤。心超、心电图无异常。血尿粪常规、肾功能、电解质无异常。肝功能:白蛋白23.7 g/L、总蛋白46.9 g/L。痰抗酸杆菌阴性,痰培养正常菌群生长。结核杆菌特异性细胞免疫反应为阴性。肿瘤标志物检查:SCC、Pro-GRP、CEA均正常,细胞角蛋白19片段(CYFRA21-1)10.75 ng/mL。2019年5月30日在全麻下行单孔胸腔镜胸膜组织活检术。术中见:右侧胸腔内脏层及壁层胸膜弥漫性增厚,胸膜、肺、心包及膈肌表面可见弥漫的结节,质脆,触之易出血。术中剖开标本见:灰白、灰红色组织。术中快速冰冻切片检查:(右侧胸膜)间叶源性恶性肿瘤,待石蜡明确诊断。术后病理诊断:肺低分化癌(肉瘤样癌),并累及胸膜及膈肌。癌组织梭形细胞构成,呈束状排列,细胞深染,异型性明显(图G、H、K、J)。免疫组化:CKp(+),Ki-67(+)60%,CK5/6(-),TTF-1(+),SMA(CR),CD34(+),CD163(+),CD68(+),Desmin(-),S100(-),Bcl-2(-),EMA(+),napsin-A(-),P63(-),Calretinin(-),MC(-),WT-1(-)。患者术后恢复顺利,术后给予“TP”方案联合化疗2次,3个月后死亡。
2 讨论及文献复习
肉瘤样癌1864年由Virchow最早报道并提出。1992年Ro等[2]建议采用肉瘤样癌命名这类肿瘤。在2004年WHO中PSC被定义为含有肉瘤及肉瘤样成分的分化差的非小细胞肺癌,可分为多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤5个亚型。多形性癌(PC)是一种低分化非小细胞肺癌(鳞状细胞癌、腺癌或大细胞癌),含有至少10%的梭形细胞和(或)巨细胞,或完全由梭形细胞和巨细胞组成的癌,是最多见的亚型。梭形细胞癌(SCC)仅由梭形细胞组成的非小细胞肺癌。巨细胞癌(GCC)完全由巨细胞组成。肺母细胞瘤(PB)是一种具有原始上皮成分和原始间质的双相肿瘤,由原始上皮和原始间叶组成,原始上皮成分主要为低级别胎儿型腺癌,部分可出现高级别胎儿型腺癌或完全分化的腺癌。肺癌肉瘤(CS)是一种混合的恶性肿瘤,包括非小细胞癌(鳞癌、腺癌、腺鳞癌和大细胞癌)和含有肉瘤成分(如横纹肌肉瘤、恶性软骨瘤或骨肉瘤)混合存在的肉瘤。多形性癌多见,其次是梭形细胞癌和癌肉瘤。PSC多见于中老年患者,男女发病率为4∶1,长期吸烟者多见[3]。有文献报道吸烟可能与肺肉瘤样癌的发生有关,但吸烟对预后并无明显影响[4]。PSC患者的临床症状无特异性,临床症状与肿瘤的位置对周围组织刺激有关。根据肿瘤位置分为中央型和周围型。中央型多以咳嗽、咳痰伴痰中带血为主要表现;周围型以胸痛、胸腔积液等表现为主,多因侵犯胸膜及胸壁出现疼痛。肺肉瘤样癌恶性程度高,生长迅速,多数患者就诊时已属局部晚期或远处转移,常见的转移部位有脑、骨、肾上腺、肝[5],少数也可转移到食管、空肠、直肠、胰腺、心、肾、皮肤等[6]。PSC也可侵犯胸膜、胸壁。该患者以咳嗽、痰中带血、胸痛为主要临床表现,肿瘤位于右肺上叶,约3.5 cm×2.2 cm,已侵犯胸膜、膈肌,颅脑转移,与文献报道一致[7]。
PSC影像学表现无明显特异性。胸部CT平扫可见肿瘤边缘界限不清,可有毛刺或分叶,增强CT可见肿瘤边缘不规则环形或斑片状强化[8-10];胸壁侵犯和(或)胸腔积液征象[7]。本病例胸部CT显示右肺上叶实变影内可见空洞形成,右侧胸腔内可见液气胸,未行增强扫描,与上述报道一致。有文献报道PSC比NSCLC在PET-CT中有更高的平均SUVmax值[11]。故可以考虑行PET-CT为确定肿物性质提供参考,但因PET-CT费用昂贵,临床应用较为困难。
PSC主要依靠病理学和免疫组织化学诊断。PSC中带有上皮细胞成分和间质细胞成分。PSC的免疫组化检测主要为上皮生物学标记物和间质细胞生物学标记物。上皮生物学标记物主要为细胞角蛋白(cytokeratin,CK)、上皮细胞抗原(EMA)、甲状腺转录因子1(TTF-1)、细胞角蛋白5/6(CK5/6)、P40等。间质细胞生物学标记物主要为波形蛋白(vimentin)、结蛋白(desmin)等[12-13]。PSC中可出现上皮标记物及间质标记物均呈阳性表达[13]。CD31和CD34免疫组织化学染色显示肿瘤组织中有丰富的微血管,提示肿瘤血管生成活跃。本例免疫组化检查显示,TTF-1、CD34、CD163、CD68均呈阳性表达,Ki-67阳性细胞数60%,与文献报道一致[12-13]。

2019-05-24 图A纵隔窗:右肺上叶实变影内可见空洞形成、右侧胸腔积液。图B肺窗:右肺上叶实变影内可见空洞形成。


2019-05-28 图C纵隔窗:右肺上叶肿块影,与胸膜粘连,其内可见空洞形成,大小约3.5 cm×2.2 cm。图D肺窗:右肺上叶肿块影,与胸膜粘连,其内可见空洞形成,大小约3.5 cm×2.2 cm。

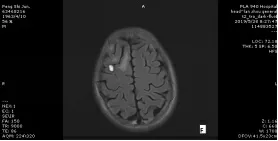
图E、图F为颅脑MRI检查提示:双侧额叶及右侧小脑半球见多发结节影,T1WI呈高、低混杂信号,T2WI边缘可见环形高信号,中心亦呈囊状高、低混杂信号,较大者直径约1.2cm,DWI呈高信号,周围见斑片状水肿信号影,增强扫描后可见轻度不均匀强化。



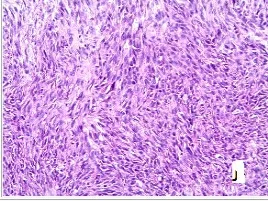
图G、H、K、J所示为病理HE染色示:肿瘤细胞呈梭形细胞构成,呈束状排列,嗜酸性,细胞深染,异型性明显(HE 染色 ×40)。
早期手术是PSC首选的治疗方法,术后给予以铂类为基础的联合化疗。新辅助化疗或术后辅助化疗对患者的远期生存期并无明显延长。Martin等[14]报道早期PSC患者的中位生存期为11.54个月,1 a生存率为92%,2 a、3 a、5 a生存率分别为30%、25%、21%。晚期PSC患者应用吉西他滨联合顺铂(GP)或紫杉醇联合顺铂(TP)方案化疗,其客观缓解率及中位生存时间与同期的NSCLC并无明显差异,其中位总生存期为6个月[15-16]。顾海艇[17]等研究称肿瘤大小、有无淋巴结转移、有无远处转移、TNM分期及早期手术是影响患者预后的因素。近年来,有研究报道PSC中以KRAS、TP53、EGFR突变多见。但PSC患者的EGFR突变率低,报道1例PSC术后患者出现复发,EGFR外显子缺失,接受吉非替尼治疗,获得了35个月的完全缓解[18]。也有1例ALK阳性的PSC患者接受了克唑替尼的治疗,获得了2.4个月的完全缓解。有文献报道PD-L1在PSC中的表达明显高于非小细胞肺癌[19]。Hey等[20]比较PD-L1在原发肿瘤和转移复发后的表达,发现PD-L1在转移部位的表达是原发灶的2倍,通过阻断程序性死亡蛋白-1(programmed cell death 1,PD-1)及其配体 1(PD-1 ligand,PD-L1)构成的PD-1/ PD-L1通路,重现激活机体免疫系统对肿瘤的杀伤作用,已成为一种新的治疗方法[21]。报道1例PD-L1高表达并接受了帕博利珠单抗(pembrolicumab)作为二线治疗的患者,部分缓解的时间为7个月。该患者未行任何治疗,3个月后死亡。
PSC是一种罕见的侵袭性高、预后差的非小细胞肺癌,预后与肿瘤大小、淋巴结是否转移、有无远处转移、TNM分期及早期手术等因素有关[17]。早期治疗多以手术切除和围手术期放化疗为主。PSC对放化疗均不敏感,对不能手术或术后患者,可行辅助放化疗或靶向治疗,以延长生存期。随着分子生物学的发展,靶向药物和免疫治疗会使该病患者受益。因此,临床医师应提高对本病的认识,做到早发现、早诊断、早治疗,以降低其病死率。
