利用UV和ARTP诱变筛选优良性状的球等鞭金藻
2020-04-26陈建楠陈由强薛婷
陈建楠 陈由强 薛婷
摘 要:为获取优良性状的球等鞭金藻突变藻株,通过紫外和等离子体诱变育种技术对球等鞭金藻进行诱变和高通量筛选。结果表明:共筛选出了7株优良性状的突变藻株,分别为YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11、JN31,其藻液尼罗红染色测定油脂含量的荧光比值都大于原始藻株,突变藻株YB1Z2、ZA2、ZA5、Z3YB4、JN31比生长速率相比于原始藻株提高了1.38、1.22、1.33、1.10、1.37倍,突变藻株YB1Z2的生长速率最快,其次是突变藻株JN31。突变藻株YB1Z2、Q2B5ZWYB、Z3YB4、Z3YB11、JN31的岩藻黄素单位含量均高于原始藻株,其中突变藻株YB1Z2、Z3YB11提高了1.07、1.08倍。突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11的不饱和脂肪酸含量比原始藻株提高了1.22、1.09、1.08、1.18、1.13、1.18倍,突变藻株YB1Z2、ZA5、Z3YB4、Z3YB11、Q2B5ZWYB的多不飽和脂肪酸(C22∶6)DHA含量比原始藻株提高了1.28、1.27、1.26、1.21、1.21倍。利用紫外和等离子体诱变育种技术对球等鞭金藻进行诱变筛选,获得了7株优良性状的突变藻株,为后续的研究和基础饵料藻提供了很好的种质资源。
关键词:球等鞭金藻;生长速率;岩藻黄素;不饱和脂肪酸;诱变筛选
中图分类号:Q938 文献标志码:A 文章编号:0253-2301(2020)02-0009-08
DOI:10.13651/j.cnki.fjnykj.2020.02.002
Abstract:In order to obtain the mutants of Isochrysis galbana with excellent characters, the mutation and high throughput screening of Isochrysis galbana was carried out by using the ultraviolet and plasma mutation breeding technologies. The results showed that a total of seven mutants with excellent characters were screened out, which were YB1Z2, ZA2, ZA5, Q2B5ZWYB, Z3YB4, Z3YB11, JN31, respectively. The fluorescence ratio of oil content determined by Nile red staining in the algal solution was higher than that of the original strain. The growth rate of the mutant YB1Z2, ZA2, ZA5, Z3YB4 and JN31 was 1.38, 1.22, 1.33, 1.10 and 1.37 times higher than that of the original strain, and the growth rate of YB1Z2 was the fastest, followed by JN31. The contents of fucoxanthin per unit in the mutant YB1Z2, Q2B5ZWYB, Z3YB4, Z3YB11 and JN31 were all higher than that of the original strain, among which the mutant YB1Z2 and Z3YB11 increased by 1.07 and 1.08 times. The content of unsaturated fatty acids in the mutant YB1Z2, ZA2, ZA5, Q2B5ZWYB, Z3YB4 and Z3YB11 was 1.22, 1.09, 1.08, 1.18, 1.13 and 1.18 times higher than that of the original strain. The DHA content of polyunsaturated fatty acids (C22∶6)in the mutant YB1Z2, ZA5, Z3YB4, Z3YB11 and Q2B5ZWYB was 1.28, 1.27, 1.26, 1.21 and 1.21 times higher than that of the original strain. In conclusion, the mutation screening of Isochrysis galbana was carried out by using the ultraviolet and plasma mutation breeding technologies, and then seven mutants with excellent characters were obtained, which provided good germplasm resources for the subsequent research and basic bait algae.
Key words:Isochrysis galbana;Growth rate;Fucoxanthin;Unsaturated fatty acid;Mutation screening
球等鞭金藻Isochrysis galbana是一种富含岩藻黄素和油酸、亚油酸、二十二碳六烯酸(DHA)等多种不饱和脂肪酸的海洋单细胞微藻[1-3],是我国养殖海产鱼类幼苗和双壳类幼虫的基础饵料藻[4]。藻体大小为3~7 μm,没有细胞壁,藻体一般为椭圆形或球形,有两根等长的鞭毛从细胞前端伸出,依靠两根鞭毛运动的单细胞藻体[5]。主要分布在我国近海岸水体的中下层,其对生长环境温度变化敏感,在早春和晚秋生长旺盛,繁殖速度快,生长在海洋水体中,营浮游生活。球等鞭金藻在不断的传代培养过程中会出现藻种的退化,表现为生长速率缓慢、油脂含量和岩藻黄素含量下降、生物活性不高等症状,极大影响了饵料藻的品质,为了获取优良性状的种质,科研人员一般会通过诱变育种技术对球等鞭金藻进行诱变筛选[6]。
紫外誘变是一种传统的物理诱变育种技术,其原理是紫外线照射到细胞里的DNA形成嘧啶二聚体,从而导致DNA双链双螺旋结构变异,碱基错配,从而形成突变体[7]。紫外诱变对其设备要求简单、操作简便,突变效率较高、安全性较高等特点,在微藻生物诱变育种过程中得到了广泛的应用[8-9]。Sivaramakrishnan等[10]通过紫外诱变技术对栅藻Scenedesmus sp.进行诱变育种,筛选出了1株突变藻株M22,总油脂产量较野生株提高了3倍,达到了1.625 g·L-1。刘晓娟[11]通过对拟微绿球藻进行紫外诱变筛选,筛选出了2株突变藻株N63和N27,生长速率提高了26.1%和41.9%,海藻多糖提高了19.68%和38.57%。Liu等[12]通过紫外诱变技术对小球藻进行诱变,筛选出的突变藻株较野生株的生长速率更快,生物量提高了7.6%,油脂含量也有相应提高。叶丽等[13]通过紫外对拟微绿球藻进行诱变筛选,获得了2株生长速率较快的 MN1和MN2突变藻株,MN1突变藻株比出发藻株的生物量增加14.55%,粗蛋白含量增加2.54%,总油脂含量增加9.81%,MN2突变藻株比出发藻株的生长率增加6.25%,生物量增加5.62%,多糖增加13.26%,总油脂增加7.93%。翟兴文[14]通过对雨生红球藻进行紫外诱变筛选,筛选出了几株高产虾青素藻株。Lim等[15]通过紫外诱变育种多次诱变筛选,获得了2株中性油脂含量分别提高了114%和123%的突变藻株。陈书秀[16]对盐藻和雨生红球藻进行紫外诱变筛选,获得2株生长速率高的盐藻和3株虾青素含量高的雨生红球藻突变藻株。杨生辉等[17]通过对极大螺旋藻的紫外诱变筛选等胁迫手段,筛选出了1株生长速率快、光合作用高、藻丝体长、蛋白质叶绿素含量高的突变藻株。
常压室温等离子体(ARTP)诱变[18]是一种新兴的物理诱变育种技术,它是以氦气为工作载体,在室温常压下通过激发氦离子产生射频辉光放电高能量的等离子体射流,穿过细胞壁和细胞膜使得基因发生巨大损伤,碱基修复机制发生改变,从而形成稳定遗传突变株。常压室温等离子体(ARTP)诱变育种技术近年来在微生物育种和微藻育种中得到了较为广泛使用[19]。Fang等[20]通过常压室温等离子体(ARTP)诱变育种技术对螺旋藻进行诱变育种,获得了3株生长速率较快和多糖含量相对较高的突变藻株。Liu等[21]通过ARTP诱变育种技术对寇氏隐甲藻Crypthecodinium cohnii进行诱变育种,筛选出了高产突变藻株M7,细胞外多糖(EPS)含量和生物量分别提高了33.85%、85.35%。艾江宁等[22]通过对湛江等鞭金藻进行ARTP诱变育种,筛选出1株生长速率快,细胞密度大,油脂含量高的突变藻株。曹旭鹏等[23]通过常压室温等离子体(ARTP)诱变育种技术对湛江等鞭金藻进行等离子体的一次和二次诱变,得到了一次诱变筛出率为0.6%、二次诱变筛出率为1.2%的高生长速率和油脂含量高的突变藻株。Zhu等[24]通过常压室温等离子体对猴头菌进行诱变育种,获得1株猴头菌的突变株与原菌株相比,子实体产量提高了22%,猴头菌多糖含量提高了16%。Yu等[25]通过常压室温等离子体对吸水链霉菌进行诱变处理,获得1株SFK36突变菌株,抗坏血素的产量能够达到495.3 mg·L-1,比出发菌株ATCC 14891增加了32.5%。
本研究主要通过突变效率高的紫外诱变育种技术和近年新兴的常压室温等离子体(ARTP)诱变育种技术对球等鞭金藻进行诱变筛选,结合尼罗红染色法高通量筛选,快速筛选出具有优良性状的突变藻株,为后续的研究和基础饵料藻提供了很好的种质资源,解决了球等鞭金藻在不断的传代培养过程中出现生长速率缓慢、油脂含量和岩藻黄素含量下降、生物活性不高等藻种退化问题。
1 材料与方法
1.1 试验材料
1.1.1 试验藻株 原始藻株:球等鞭金藻藻种购自于上海光语生物科技有限公司。
1.1.2 试验试剂 二甲基亚砜、乙酰氯、氯化钠、甲醇、丙酮、正己烷等均为国药集团的分析纯试剂,色谱级甲醇购自于德国默克公司,色谱级正己烷购自于上海阿拉丁生化科技股份有限公司,尼罗红染色液和鲁哥氏碘液购自于生工生物工程(上海)股份有限公司。
1.1.3 试验仪器 紫外诱变箱UVVⅢ、常压室温等离子体诱变箱ARTPIIS、蔡司倒置荧光显微镜Axio Vert A1、安捷伦气相色谱仪7890B、超高效液相色谱仪Waters ACQUITY VPIC、FLUOstar Omega全自动多功能酶标仪等。
1.1.4 试验培养基 f/2培养基[f/2(Guillard.1962)改良配方(海水)]:硝酸钠75 mg·L-1、一水磷酸氢二钠5 mg·L-1、乙二胺四乙酸二钠4.36 mg·L-1、六水合三氯化铁3.16 mg·L-1、五水合硫酸铜0.01 mg·L-1、七水合硫酸锌0.023 mg·L-1、六水合二氯化铁0.012 mg·L-1、Na2MoO4·2H2O 0.07 mg·L-1、维生素B 10.1 mg·L-1、维生素B12 0.5 ug·L-1、生物素0.5 ug·L-1。pH自然,121℃灭菌20 min。
Erdschreiber′s 培养基:灭菌的海水3 L、PIV金属溶液 12 mL·L-1 (Na2EDTA·2H2O 0.75 g·L-1、FeCl3·6H2O 0.097 g·L-1、MnCl2·4H2O 0.041 g·L-1、ZnCl2 0.005 g·L-1、CoCl2·6H2O 0.002 g·L-1、Na2MoO4·2H2O 0.004 g·L-1),NaNO3 2.3 mmol·L-1、Na2HPO4·7H2O 0.067 mmol·L-1、土壤提取液50 mL·L-1、维生素 B12 1 mL·L-1。pH自然,121℃灭菌20 min。
1.2 试验方法
1.2.1 球等鞭金藻的紫外诱变 (1)将球等鞭金藻接种至f/2培养基中无菌化培养,培养温度为25℃,放置在LED灯架下培养,光照强度为120 μmol photons m-2s-1,光照周期为光暗比14 h∶10 h,每天定时对球等鞭金藻摇瓶3次,培养至对数生长期。在超净台中取100 uL对数生长期的无菌藻液涂布在预先倒好的Erdschreiber's 固体培养基平板上(琼脂含量在0.8%左右),藻液在固体培养基平板上涂布均匀,涂布完后将平板静止一会儿。(2)将UVVⅢ紫外诱变箱打开预热5 min,选定紫外线波长为254 nm。然后将平板放入紫外诱变箱中间,再打开254 nm波长进行紫外照射诱变。(3)紫外诱变时间预先分别设定:1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0 min,对照组为涂布完没有经紫外照射的平板。经紫外照射完后平板立即盖上盖子和封口膜封口,再用报纸将紫外照射过的平板包起来和对照组一起放置黑暗处避光处理3 h以上,以防止光修复。(4)避光处理后将平板倒扣放置在LED灯架下,光照强度为120 μmol photons m-2s-1白光培养,光照周期为光暗比14 h∶10 h,培养温度为25℃,连续培养15 d左右,观察平板上的球等鞭金藻生长情况。(5)待培养至15 d左右,球等鞭金藻的单藻落基本上已经长出,通过计算平板上长出的单藻落数来计算紫外诱变照射的致死率。致死率=[对照组平板上的单藻落数(平均数)-紫外照射组平板上的单藻落数(平均数)]/对照组数×100%。找到致死率在80%~90%的紫外照射时间,再接着以这个照射时间做多次的紫外诱变试验。据参考文献描述微藻致死率在80%~90%正向突变概率比较大。
1.2.2 球等鞭金藻等离子体诱变 (1)将球等鞭金藻接种至f/2培养基中无菌化培养,培养温度为25℃,放置在LED灯架下培养,光照强度为120 μmol photons m-2 s-1,光照周期为光暗比14 h∶10 h,每天定时对球等鞭金藻摇瓶3次,培养至对数生长期。在超净台中取100 uL对数生长期的无菌藻液涂布在預先倒好的Erdschreiber′s 固体培养基平板上(琼脂含量在0.8%左右),藻液在固体培养基平板上涂布均匀,涂布完后将平板静置一会儿。(2)将ARTP诱变箱打开预热30 min,选定好诱变照射的功率。然后将涂布好的球等鞭金藻平板放入诱变箱中,再设置好诱变照射时间进行诱变。(3)等离子体诱变照射时间预先分别设定:36、72、108、144、180、216、252、288、324、360 s,对照组为涂布完没有经等离子体照射的平板。照射完后的平板立即盖上盖子和封口膜封口。(4)将等离子体照射诱变后的平板和对照组,先正面放置5 h以上,再将平板倒扣过来放置在LED灯架下培养,光照强度为120 μmol photons m-2 s-1,光照周期为光暗比14 h∶10 h,培养温度为25℃,连续培养15 d左右,观察平板的球等鞭金藻生长情况。(5)待培养至15 d左右,球等鞭金藻的单藻落基本上已经长出,通过计算平板上长出的单藻落数来计算等离子体诱变照射的致死率。致死率=[对照组平板上的单藻落数(平均数)-紫外照射组平板上的单藻落数(平均数)]/对照组数×100%。找到致死率在80%~90%的等离子体照射时间,再接着以这个照射时间做多次的等离子诱变实验。据参考文献描述微藻致死率在80%~90%正向突变概率比较大。
1.2.3 球等鞭金藻突变藻株的初筛与培养 (1)挑选诱变照射平板上单藻落比对照组平板上大的单藻落于96孔板f/2培养基中培养,做好标记,培养温度为25℃,放置在LED灯架下培养,光照强度为120 μmol photons m-2 s-1,光照周期为光暗比14 h∶10 h,培养至10 d左右,转移到24孔板中继续培养。待突变藻株基本上在24孔板上长起来,再转移至50 mL三角瓶中培养10 d左右,每天定时摇瓶3次。再转移到250 mL三角瓶培养,按1∶10接种,每天定时摇瓶3次。待球等鞭金藻生长到生长指数期时,取样,通过血球计数板在显微镜下观察计数,计算培养的突变藻株细胞密度。(2)尼罗红染色法[26-27]高通量筛选富油球等鞭金藻突变藻株。通过细胞计数的结果来按接种量一样重新接种培养突变株,培养在250 mL的三角瓶中,培养条件与1.2.3(1)相同。然后每天取样测定藻液的OD值,制作生长曲线,比较生长速率。连续培养8 d后,再分别取样,血球计数板计数,稀释到细胞数一样的浓度,取200 uL藻液分装于96孔酶标板中,加入尼罗红染色液,避光染色10 min,再通过FLUOstar Omega全自动多功能酶标仪测定尼罗红染色液与球等鞭金藻油脂激发出来的荧光值,跟原始藻株进行比较;同时通过倒置荧光显微镜观察激发出来的荧光亮度(橘红色)进行比较。筛选出生长速率快的和荧光值高(油脂含量高)的突变藻株留下进行下一阶段的复筛。(3)通过UPLC快速检测突变藻株中岩藻黄素的含量,直接筛选出岩藻黄素含量高的球等鞭金藻突变藻株。将培养至8 d的藻液取100 mL进行离心收集藻泥,预冷冻干,称干重,有机溶剂甲醇浸提岩藻黄素,UPLC快速检测计算突变藻株中岩藻黄素的含量。将生长速率快的和岩藻黄素含量高的突变藻株留下进行下一阶段的复筛。
1.2.4 球等鞭金藻突变藻株的复筛与培养 经过初筛后,实验室接种传代培养至第5代,再进行突变藻株的复筛,筛选出稳定性好生物活性高的,生长速率快和岩藻黄素含量高或者油脂含量高的突变藻株。其筛选方法如下:(1)通过日常的培养观察,筛选显微镜镜鉴球等鞭金藻突变藻株里有鞭毛,游动悬浮生长不沉底的,培养生长过程藻液中会出现“云朵条带”,液面会出现近似油光发亮的“油面层”,说明球等鞭金藻的生长旺盛,生物活性很好。(2)再通过尼罗红染色法高通量筛选富油突变藻株,UPLC快速检测突变藻株中岩藻黄素的含量。尼罗红染色法高通量筛选富油突变藻株同1.2.3(2)方法一样,筛选出生长速率快和荧光值高(油脂含量高)的突变藻株。再将突变藻株的藻液取样100 mL进行离心收集藻泥,预冷冻干,称干重,有机溶剂甲醇浸提岩藻黄素,UPLC快速检测计算岩藻黄素含量,筛选出岩藻黄素含量高的突变藻株。
1.2.5 突变藻株与原始藻株的比生长速率和岩藻黄素含量比较 通过复筛将筛选出的突变藻株和原始藻株培养于250 mL的三角瓶中,培养基为f/2培养基,接种量一样,每天测定藻液的OD值,制作生长曲线,连续培养8 d左右,比较生长速率,计算比生长速率。比生长速率计算公式μ=(lnNt2 - lnNt1) /( t2 - t1) (Nt2为t2 d时藻液的OD值,Nt1为t1 d时藻液的OD值)。再将突变藻株和原始藻株的藻液各取样100 mL进行离心收集藻泥,预冷冻干,称干重,有机溶剂甲醇浸提岩藻黄素,UPLC快速检测计算岩藻黄素含量。
1.2.6 突变藻株与原始藻株的脂肪酸含量分析 将球等鞭金藻的突变藻株和原始藻株分别培养于1 L三角瓶中,培养基为f/2培养基,放置在LED灯架下培养,光照强度为120 μmol photons m-2 s-1,培养温度为25℃,光照周期为光暗比14 h∶10 h,连续培养10 d,离心收集藻泥,预冷冻干,称重,碾成粉末,分别称取40 mg,采用有机溶剂氯仿甲醇(1∶2)法提取总油脂,经甲酯化,气相色谱检测分析球等鞭金藻的脂肪酸含量。气相色谱仪:Agilent 7890B 气相色谱仪,色谱柱:SP2560 100 m×0.25 mm×0.2 μm,色谱条件:前检测器温度为250℃,色谱柱加热温度:初始温度为140℃,维持5 min,再以4℃·min-1的加热温度加热到250℃,再维持12.5 min。进样量为1 μL。脂肪酸标品为SIGMA公司的Fatty Acid Methyl Ester,C8~C22,外加入EPA、DHA,内标为十九酸甲酯。各主要脂肪酸含量计算,采用面积归一化法。
2 结果与分析
2.1 紫外照射诱变和等离子体照射诱变时间选定
球等鞭金藻在固体培养基平板上培养15 d以后,根据对照组平板和试验组诱变平板中的单藻落数,计算致死率在80%~90%的平板照射时间,得出紫外照射诱变时间为2 min,等离子体照射诱变时间为252~288 s。
2.2 紫外诱变和等离子体诱变突变菌株筛选
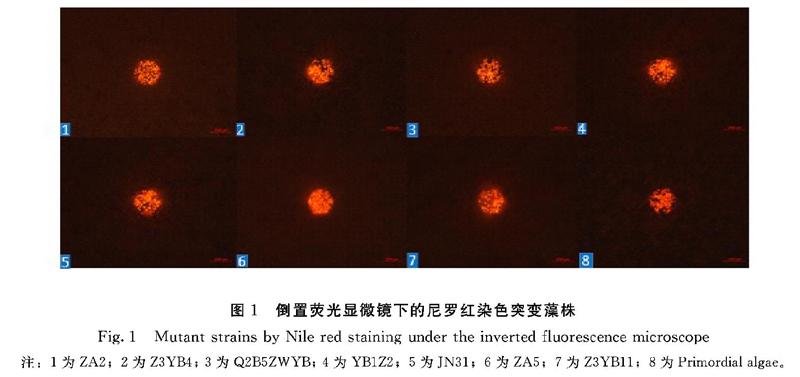
通过多次大量的紫外诱变筛选和等离子体诱变筛选,最终筛选出了7株具有优良性状的突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11、JN31。其中YB1Z2、Q2B5ZWYB、Z3YB4、Z3YB11这4株突变藻株通过紫外诱变筛选,ZA2、ZA5、JN31这3株突变藻株通过等离子体诱变筛选。尼罗红染色藻液倒置荧光显微镜直接观察法比较突变藻株的熒光亮度如图1所示,突变藻株的尼罗红染色法橘红色都会比对照原始藻株亮,ZA5突变藻株的橘红色最亮,其次是Z3YB4 、JN31、YB1Z2突变藻株。FLUOstar Omega全自动多功能酶标仪测定突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11、JN31的荧光比值分别是1.39、1.10、1.54、1.09、1.45、1.09 、1.41,荧光比值最大的是ZA5突变藻株,是原始藻株的1.54倍,其次是Z3YB4突变藻株,是原始藻株的1.45倍。尼罗红染色高通量筛选法可以快速地检测微藻细胞中中性油脂的含量。说明这7株突变藻株的油脂含量比原始藻株高。
2.3 突变藻株与原始藻株的比生长速率和岩藻黄素含量比较
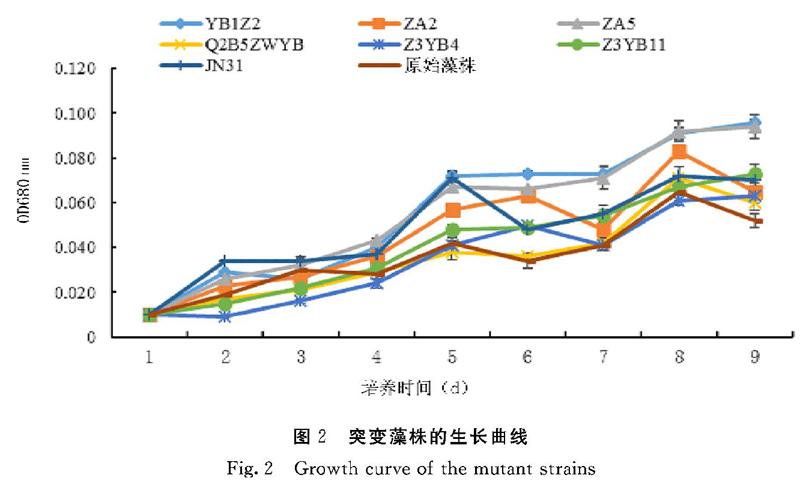
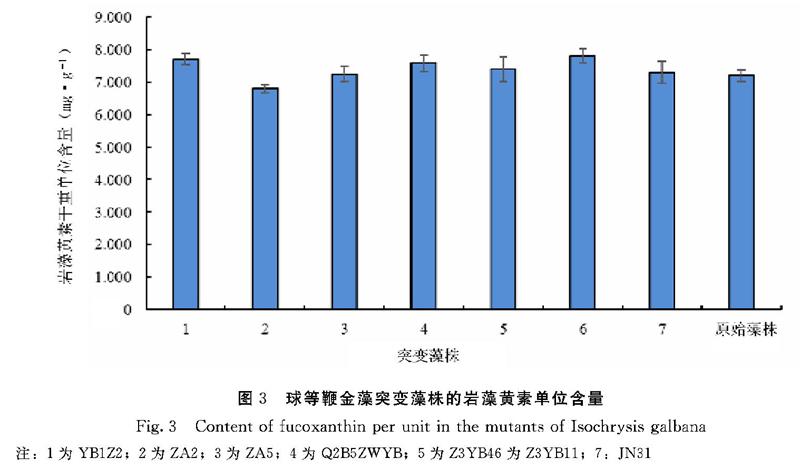
如图2所示,在突变藻株培养至第4 d时,通过比生长速率公式计算可知,YB1Z2、ZA2、ZA5、Z3YB4、JN31的比生长速率分别是对照原始藻株的1.38、1.22、1.33、1.10、1.37倍, 其中突变藻株YB1Z2的生长速率是最快的,其次是突变藻株JN31。由图3可见,突变藻株YB1Z2、Q2B5ZWYB、Z3YB4、Z3YB11的岩藻黄素单位含量与对照原始藻株相比都高,提高最多的是突变藻株YB1Z2和Z3YB11,分别提高了1.07、1.08倍。
2.4 突变藻株与原始藻株的脂肪酸含量分析
通过对突变藻株和原始藻株的脂肪酸含量分析,其脂肪酸含量见表1,突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11的不饱和脂肪酸含量都会比原始藻株提高了1.22、1.09、1.08、1.18、1.13、1.18倍,其主要是单不饱和脂肪酸油酸(C18∶1)提高较多;突变藻株YB1Z2、ZA5、Z3YB4、Z3YB11、Q2B5ZWYB的多不饱和脂肪酸(C22∶6)DHA含量相较于对照原始藻株提高了1.28、1.27、1.26、1.21、1.21倍。
3 结论与讨论
通过紫外诱变和等离子体诱变育种技术对球等鞭金藻进行诱变筛选,共获得了7株优良性状的突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11、JN31,其中YB1Z2、Q2B5ZWYB、Z3YB4、Z3YB11突变藻株是通过紫外诱变筛选,ZA2、ZA5、JN31突变藻株是通过等离子体诱变筛选。最后对这7株突变藻株油脂含量进行尼罗红染色法检测、比生长速率的测定、岩藻黄素含量的测定、脂肪酸含量的分析,结果显示:通过对突变藻株尼罗红染色测定的荧光比值最大的是ZA5突变藻株,是原始藻株的1.54倍,其次是Z3YB4突变藻株,是原始藻株的1.45倍,JN31突变藻株荧光值是原始藻株的1.41倍,YB1Z2突变藻株的荧光值是原始藻株的1.39倍,这7株突变藻株的油脂含量都比原始藻株高。通过对突变藻株比生长速率的测定,突变藻株YB1Z2、ZA2、ZA5、Z3YB4、JN31的比生长速率分别是原始藻株的1.38、1.22、1.33、1.10、1.37倍,突变藻株YB1Z2的生长速率最快,其次是突变藻株JN31。通过对突变藻株岩藻黄素含量的测定,突变藻株YB1Z2、Q2B5ZWYB、Z3YB4、Z3YB11的岩藻黄素单位含量均比原始藻株高,提高最多的是突变藻株YB1Z2和Z3YB11,分别是原始藻株的1.07、1.08倍。通过对突变藻株脂肪酸含量的分析,突变藻株YB1Z2、ZA2、ZA5、Q2B5ZWYB、Z3YB4、Z3YB11的不饱和脂肪酸含量都会比原始藻株提高了1.22、1.09、1.08、1.18、1.13、1.18倍,突变藻株YB1Z2、ZA5、Z3YB4、Z3YB11、Q2B5ZWYB的多不饱和脂肪酸(C22:6)DHA含量相较于原始藻株提高了1.28、1.27、1.26、1.21、1.21倍,主要提高了不饱和脂肪酸含量,这个对于基础饵料藻来说是非常好的突变方向。紫外诱变和等离子体诱变育种技术不仅在微生物育种得到广泛应用,也在微藻生物育种得到了广泛应用,在解决微藻种质退化和获取优良性状的种质资源起着重要的角色。De Jaeger等[28]通过紫外诱变筛选出了5 株缺乏淀粉斜生栅藻的突变藻株,提高了产三酰甘油(TAG)的能力,其中1株突变株产三酰甘油(TAG)的能力可以达到藻体干重的49.4%。吴晓英等[29]通过等离子体诱变育种技术对雨生红球藻进行诱变筛选,获得了1株高产虾青素的雨生红球藻突变藻株M45,生物量和生长速率比出发藻株分别提高了6.45%和8.57%,虾青素含量提高了51.96%。本研究主要通过紫外诱变和常压室温等离子体(ARTP)诱变育种技术对球等鞭金藻进行诱变筛选,结合尼罗红染色法高通量筛选,快速筛选出了具有优良性状的7株突变藻株,为后续的研究和基础饵料藻提供了很好的种质资源,同时也为广大的微藻诱变育种科研人员提供了参考。
参考文献:
[1]王帅.富油微藻筛选及球等鞭金藻(Isochrysis galbana)脂肪酸去饱和酶基因的克隆与功能研究[D].青岛:中国海洋大学,2015.
[2]郭兵.两株海洋微藻中Δ4脂肪酸去饱和酶基因和Δ5脂肪酸延长酶基因的克隆以及功能验证[D].北京:中国农业科学院,2011.
[3]臧正蓉. 富含岩藻黄素的微藻藻种的筛选及其中试培养[D].北京:中国科学院研究生院(海洋研究所),2014.
[4]李梅燕. 西施舌人工育苗饵料藻种的选育[D]. 福州:福建师范大学, 2004.
[5]刘春凤,吴雪,高悦勉.两种等鞭金藻外部形态与超微结构的观察比较[J].大连水产学院学报,2008(4):273-277.
[6]丛超. 球等鞭金藻的遗传多样性与高DHA和EPA品系的定向选育[D]. 上海:上海海洋大学,2017.
[7]唐学玺, 杨震, 王悠,等. 紫外辐射诱发三角褐指藻自由基伤害的研究[J]. 海洋通报, 1999, 18(4):93-96.
[8]付峰, 隋正红, 孙利芹. 藻类诱变育种技术研究进展[J]. 生物技术通报, 2018, 34(10):64-69.
[9]范道春,张红兵,刘垒.富油脂微藻育种技术研究进展[J].微生物學杂志,2019,39(1):115-121.
[10]SIVARAMAKRISHNAN R,INCHAROENSAKDI A.Enhancement of lipid production in Scenedesmus sp.by UV mutagenesis and hydrogen peroxide treatment[J].Bioresource Technology,2017,235:366-370.
[11]刘晓娟.拟微绿球藻高脂藻株的紫外、激光诱变育种研究[D].福州:福建师范大学,2012.
[12]LIU S Y,ZHAO Y P,LIU L,et al.Improving Cell Growth and Lipid Accumulation in Green Microalgae Chlorellasp.via UV Irradiation[J].Applied Biochemistry and Biotechnology,2015,175(7):3507-3518.
[13]叶丽,蒋霞敏,孙志鹏.紫外诱变对微绿球藻生长和营养成分的影响[J].生物学杂志,2014,31(1):56-59.
[14]翟兴文.雨生红球藻的基础生物学和诱变育种研究[D].宁波:宁波大学,2003.
[15]LIM D K Y,SCHUHMANN H,SHARMA K,et al.Isolation of HighLipid Tetraselmis suecica Strains Following Repeated UVC Mutagenesis,FACS,and HighThroughput Growth Selection[J].BioEnergy Research,2015,8(2):750-759.
[16]陈书秀.盐藻与雨生红球藻优良藻种的选育[D].青岛:中国海洋大学,2009.
[17]杨生辉, 祖廷勋, 罗光宏.极大螺旋藻高光合速率藻种的紫外诱变筛选[J].食品科学,2017(2):127-132.
[18]张雪,张晓菲,王立言,等.常压室温等离子体生物诱变育种及其应用研究进展[J].化工学报,2014,65(7):2676-2684.
[19]袁军, 赵犇, 孙梦玉,等.常压室温等离子体(ARTP)诱变快速选育高产DHA的裂殖壶菌突变株[J].生物技术通报,2015,31(10):199-204.
[20]FANG M Y,JIN L H,ZHANG CH,et al.Rapid Mutation of Spirulina platensis by a New Mutagenesis System of Atmospheric and Room Temperature Plasmas (ARTP) and Generation of a Mutant Library with Diverse Phenotypes[J].Plos One,2013,8(10):e77046.
[21]LIU B,SUN Z,MA X,et al.Mutation Breeding of Extracellular PolysaccharideProducing Microalga Crypthecodinium cohnii by a Novel Mutagenesis with Atmospheric and Room Temperature Plasma[J].International Journal of Molecular Sciences,2015,16(4):8201-8212.
[22]艾江宁,姚长洪,孟迎迎,等.生长速度快且油脂产率高的湛江等鞭金藻诱变株的筛选[J].微生物学通报,2015,42(1):142-147.
[23]曹旭鹏,艾江宁,刘亚男,等.基于常压室温等离子体技术的金藻诱变筛选方法[J].中国生物工程杂志,2014,34(12):84-90.
[24]ZHU L L,WU D,ZHANG H N,et al.Effects of Atmospheric and Room Temperature Plasma (ARTP) Mutagenesis on Physicochemical Characteristics and Immune Activity In Vitro of Hericium erinaceus Polysaccharides[J].Molecules (Basel, Switzerland),2019,24(2):262-278.
[25]YU Z T,SHEN X F,WU Y J,et al.Enhancement of ascomycin production via a combination of atmospheric and room temperature plasma mutagenesis in Streptomyces hygroscopicus and medium optimization[J].AMB Express,2019,9(1):25-40.
[26]胡小文,马帅,弓淑芬,等.荧光光谱法检测微藻中油脂[J].中国油脂,2011,36(4):70-74.
[27]梁文艳,张元春, 曹敬灿,等.采用尼罗红荧光探针对微藻中油脂的定量测定[J].环境化学,2013(8):70-74.
[28]DE JAEGER L, EM VERBEEK R, DRAAISMA R B,et al.Superior triacylglycerol (TAG) accumulation in starchless mutants of Scenedesmus obliquus:(I) mutant generation and characterization[J].Biotechnology for Biofuels,2014,7(1):69-79.
[29]吴晓英, 柳泽深, 姜悦.雨生红球藻等离子诱变及高产藻株的筛选[J].食品安全质量检测学报, 2016(7):3781-3787.
(责任编辑:柯文辉)
