鹅乙酰辅酶A 酰基转移酶1 基因的克隆、表达及生物信息分析
2020-04-22李光全龚绍明何大乾
刘 毅,李光全, 龚绍明,何大乾
(上海市农业科学院畜牧兽医研究所,上海 310029)
鹅肥肝是以特定的饲料和养殖技术促使鹅肝脏合成大量脂肪,并诱导肝脏中脂肪变性而形成的含有大量脂肪的鹅肝脏[1]。这种肥肝相当于正常肝脏重量的5~10倍,因其质地细嫩、风味鲜美,营养丰富,特别是不饱和脂肪酸含量极高,颇受人们青睐。鹅肝脏在调节脂肪代谢的能力表现出很强的可塑性,其肥肝重量可以达到原来肝脏重量的10 倍以上,占其体重的10%[2],并且这个过程是可逆的,当肥肝形成以后,加以限制饲养,肝脏重量及其组成成分会恢复到填饲前的状态[3-5]。近年来,有关鹅肥肝形成机理一直受到人们的关注,并利用现代分子生物学技术,围绕鹅肥肝形成的分子机制展开研究[6-8],已成功筛选到与鹅肥肝形成相关的基因,并对这些基因进行功能研究。
乙酰辅酶A 酰基转移酶(Cetyl-CoenzymeA Acyltransferas,ACAA)作为酰基转移酶主要分布于线粒体内,参与脂肪酸的合成、氧化和代谢等,是调节动物肝脏中脂类代谢重要的功能基因。乙酰辅酶A 酰基转移酶(ACAA)基因包括乙酰CoA 酰基转移酶1(Cetyl-CoenzymeA Acyltransferas 1,ACAA1) 和 乙 酰 CoA酰基转移酶2(ACAA2)2 种类型。有研究表明,ACAA1[9-10]和ACAA2[11-14]在动物肝脏中长链脂肪酸的代谢、脂肪酸的β氧化、胆汁酸代谢、胆固醇代谢过程发挥重要作用。王倩倩等[14]研究表明,ACAA2基因的表达与鹅肥肝的形成密切相关。但目前关于鹅ACAA1基因在鹅肥肝形成过程中的作用未见报道。
本研究选用朗德鹅为实验动物,通过填饲和限饲获得肥肝形成过程中不同阶段的肥肝样品,并采用RTPCR 和RACE 方法克隆获得朗德鹅ACAA1基因cDNA全长序列并进行生物信息学分析,采用实时荧光定量PCR 的方法检测ACAA1基因在朗德鹅不同填饲阶段肝脏中的表达,为深入研究ACAA1基因在鹅肥肝形成过程中的作用奠定基础。
1 材料与方法
1.1 实验动物 朗德鹅选自江西南丰汇和有限公司,同批孵化且在相同的环境条件下饲养,选用体型和体重相当的70 日龄健康朗德鹅42 只,单笼饲养,自由饮水,并用蒸熟玉米(玉米,1% 植物油,1% 盐)填饲,填饲到21 d 转为限制饲养。分别在填饲前(OF0)、填饲第7 天(OF7)、填饲第14 天(OF14)、填饲第21天(OF21)、限制饲养第7 天(F7)、限制饲养第14天(F14)和限制饲养第21 天(F21)随机选取6 只屠宰,快速收集肝组织,投入液氮中快速冷冻之后放置-80℃冰箱保存。
1.2 实 验材 料 总 RNA 提 取 试剂(TRIzol®Reagent) 购于Invitrogen 公司,反转录试剂(PrimeScriptTMRT reagent Kit with gDNA Eraser)、PCR 扩 增 试 剂(TaKaRa LA Taq)、基因片段克隆载体(PMDTM19-T Vector Cloning Kit)、实时荧光定量试剂(SYBR Premix EX Taq)和DNA Marker购于TaKaRa公司,RACE试剂(SMARTERTMRACE cDNA Amplification Kit)购于Clontech 公司,琼脂糖(Agarose)购于Biowest 公司α感受态细胞购自天根生化科技有限公司,异丙基β-D- 硫代半乳糖苷(IPTG)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠盐(EDTA-Na2·H20)二甲基酰胺购自成都博瑞克公司。PCR 产物回收试剂盒Gel Extraction Mini Kit 为OMEGA 公司。
1.3 实验方法
1.3.1 引物设计 根据鹅肝脏转录组拼接的ACAA1基因片段,设计3 对引物(表1),根据获得的鹅ACAA1基因片段,分别设计5´和3´端巢式PCR 引物(表1),利用获得的鹅ACAA1基因cDNA 序列,设计荧光定量引物,以GAPDH为内参,引物详情见表1。
1.3.2ACAA1基因CDS 区的克隆 根据鹅肝脏转录组拼接的ACAA1基因片段,设计3 对引物(表1),PCR扩增鹅ACAA1基因CDS 区的部分序列,PCR 反应总体系为 50 μL:上、下游引物各 1.5 μL、2× Taq PCR Master Mix 25 μL、ddH2O 20 μL、cDNA 模 板 2 μL。反应条件:95 ℃ 5 min、95 ℃ 30 s、退火温度 30 s、72℃ 1 min,34 个循环,72℃ 5 min。扩增产物用1.5%的琼脂糖凝胶电泳检测,用琼脂糖凝胶DNA 回收试剂盒进行目的片段纯化回收,并将回收纯化的目的片段连接到PMD19-T 克隆载体,转化到DH5α感受态细胞,在平板上培养后挑出阳性单菌落并接种于液体培养基中,于37℃恒温摇床中摇菌8 h,进行菌液浑浊后进行PCR 鉴定,挑选3 个阳性克隆送往上海生工进行测序。
1.3.3ACAA1基因 RACE 克隆 根据根据 ACAA1-1、ACAA1-2 和ACAA1-3 引物PCR 扩增获得的鹅ACAA1基因片段,分别设计5´和3´端巢式PCR 引物(表1),巢式 PCR 扩 增鹅ACAA1基 因 5´ 和 3´ 端 完 整序 列。RACE cDNA 模板按照SMARTerTMRACE 试剂盒说明制备获得,PCR 反应总体系为50 μL:10X Advantage 2 PCR Buffer 5 μL、dNTP Mix 1 μL、50X Advantage 2 Polymerase Mix 1 μL、PCR-Grade Water 34.5 μL、UPM 5 μL、第 1 条引物 1 μL、cDNA 模板 2.5 μL。反应条件:95℃ 30 s、72℃ 3 min,5 个循环;95℃ 30 s、70℃ 30 s、 72℃ 3 min,5 个循环;94℃ 30 s、68℃ 30 s、72℃ 3 min,25 个循环。然后以第1 次PCR 产物为模板,用第2 条引物再重复1 次PCR 扩增,反应体系和条件与第一次PCR 相同,然后PCR 产物检测、纯化、克隆和测序。

表1 ACAA1 基因引物信息
1.3.4 荧光定量PCR 分析 利用上面获得的鹅ACAA1基因cDNA 序列,设计荧光定量引物,以GAPDH为内参,参照 TAKARA SYBR®Premix Ex TaqTM II 试剂盒进行荧光定量PCR。反应体系为25 μL:SYBR Premix Ex TaqTMII(2×)12.5 μL,上、下游引物各 1 μL,cDNA 2 μL 和 ddH2O 8.5 μL。上述体系密封后放入荧光定量PCR 仪中。反应条件:95℃预变性30 s。然后95℃变性5 s,60℃退火30 s,72℃延伸15 s,共40 个循环。熔解曲线分析:95℃ 1 min,55℃ 1 min。然后从55℃开始,每个循环温度增加0.5℃,时间为10 s,81 个循环。反应结束后,由熔解曲线判定PCR 反应的特异性,利用2-ΔΔCt计算ACAA1基因mRNA 的相对表达量。
1.3.5 生物信息学分析 测序结果利用NCBI 网站提供的同源比对服务器BLAST 进行序列同源性分析。从NCBI 核酸和蛋白数据库中下载其他动物的ACAA1基因的核酸序列,利用DNAMAN(5.2.9)、Clustal X(1.83)软件进行多重序列比对分析,然后根据核酸序列多重比对的结果运用MEGA4.0 绘制分子进化树。使用ExPASy 的在线软件Compute pI/MW 分析ACAA1分子的等电点(pI)、理论分子量,利用ProtParam 在线工具推测编码蛋白质的氨基酸组成,网址为http://au.ExPASy.org/tools/pi_tool.html;使用TMHMM 软件分析ACAA 蛋白的跨膜区域(http://www.cbsdtu.d--k/services/TMHMM/);使用HNN 软件预测ACAA1 蛋白质的二级结构(https://npsaprabi.ibcp.fr--/cgibin/npsa_automat.pl?page=/NPSA/npsah-nn.html);ACAA1 蛋白三维模型由SWISS-MODEL(https://swissmodel.expasy.org)完成。
2 结 果
2.1 鹅ACAA1基因克隆 以朗德鹅肝脏cDNA 为模板,用 ACAA1-1、ACAA1-2 和 ACAA1-3 进行 PCR 扩增,通过琼脂糖凝胶电泳检测获得3 个单一条带(图1-A、B 和C),克隆测序比对分析,分别获得706、724、510 bp 鹅ACAA1基因片段。用 5′ RACE 和 3′ RACE引物进行巢式PCR 扩增,通过琼脂糖凝胶电泳检测获得2 条明显的条带(图1-E 和D),克隆测序和比对分析,分别获得756 bp 和828 bp 鹅ACAA1基因片段。
2.2 鹅ACAA1基因序列分析 测序结果利用DNAMAN去除载体序列,拼接获得鹅ACAA1基因完整的cDNA序列,共3 352 bp,采用ORF Finder 对ACAA1基因cDNA 序列比对发现,其包括CDS 区为1 323 bp,5'UTR长度为77 bp,3'UTR 长度为1 952 bp,编码441 个氨基酸,起始密码子为ATG,终止密码子为TAA,3'UTR包括2 个保守的AATAAA 顺序及poly(A)尾巴(图2)。利用BLAST 进行序列同源性分析发现,鹅ACAA1 氨基酸序列与鸟类的ACAA1 氨基酸序列相似度最高。
利用ExpASy 上的ProtParam 软件分析ACAA1 蛋白基本的理化性质,预测ACAA1蛋白的分子量为45.015ku,理论等电点为9.19。利用TMHMM 软件进行蛋白跨膜区域分析: ACAA1 蛋白不具有跨膜结构,1~441 位氨基酸均位于细胞膜内。
2.3 鹅ACAA1 氨基酸序列同源与进化分析 氨基酸对比结果表明,与小鼠、大鼠、绵羊、原鸡、鸿雁、人、猪、牛、狗的氨基酸同源性分别为86.9%、86.5%、86.9%、100%、93.0%、85.4%、85.2%、86.2%、85.6%。所有物种的同源率均超过了85%,说明ACAA1 在进化过程中非常保守。
进化树构建的结果见图3,本次预测的朗德鹅ACAA1 蛋白先与鸿雁汇集到一支,再与原鸡聚成一支。在哺乳动物里绵羊与牛先汇集成一支,再分别按顺序单独与猪、狗、人汇集。大鼠与小鼠单独汇聚成一支。从分析结果可以看出,哺乳动物与家禽之间差异很大,哺乳动物里不同纲之间也有一定差异。
2.3 鹅ACAA1基因荧光定量分析 以鹅GAPDH基因表达量为参照,ACAA1基因在朗德鹅不同填饲阶段肝脏中的表达量如图4 所示,ACAA1基因在肝脏中的表达量随着填饲时间的推移表达量逐步增加,在填饲14 d时表达量最高(P<0.05),在填饲到第21 天,其表达量有所下降,在填饲结束限饲阶段的鹅肝脏中表达最低(P<0.05),限饲到21 d,其表达量恢复到填饲前水平。
3 讨 论
ACAA 作为酰基转移酶主要分布于线粒体内,参与脂肪酸的合成、氧化和代谢等,是调节动物肝脏中脂类代谢重要的功能基因。本研究采用RT-PCR 和RACE方法克隆获得鹅ACAA1基因cDNA 全长序列并进行生物信息学分析,结果显示,鹅ACAA1基因cDNA 全长为 3 352 bp,其中 CDS 区长度为 1 323 bp,5'UTR 长度为77 bp,3'UTR 长度为1 952 bp,编码441 个氨基酸,起始密码子为ATG,终止密码子为TAA,3'UTR 包括2 个保守的AATAAA 顺序及poly(A)尾巴。比对结果表明,鹅ACAA1 氨基酸序列与鸟类的ACAA1 氨基酸序列相似度为95%~98%,说明ACAA 氨基酸序列在鸟类同源性高,进化过程中较保守。这与ACAA2[14]在鸟类中的同源分析结果类似。ACAA1 的氨基酸序列聚类分析结果和ACAA2[14]分析结果一致,鸟类聚为一支,其他哺乳动物聚为一支,这可能与其在动物生命活动过程中所发挥的作用有关。
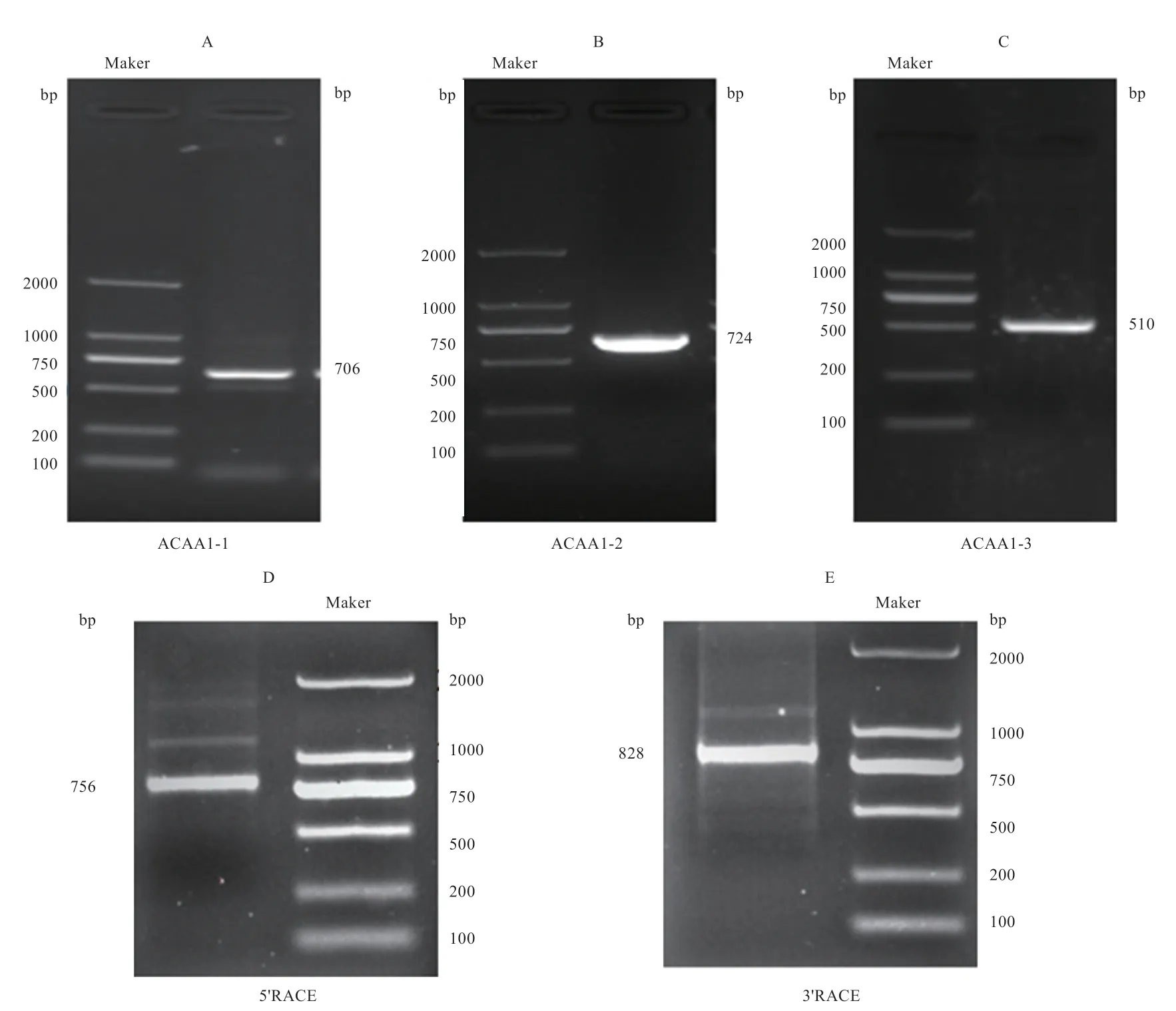
图1 鹅ACAA1 基因PCR 扩增片段电泳图


图2 鹅ACAA1 基因cDNA 序列与对应的氨基酸序列

图3 ACAA1 的系统发生树

图4 不同时期ACAA1 基因的表达谱
在哺乳动物的肝脏中,ACAA1 参与过氧化物酶体脂代谢,在动物多不饱和脂肪酸(亚麻酸和亚油酸)合成和代谢中发挥重要作用[15]。ACAA 催化完成过氧化物酶体β- 氧化的最后一步[16]。另外,ACAA1 还是过氧化物酶体增殖物活化受体α亚基(PPAR-α)的靶基因[17],通过上调SREBP-2基因的表达来调控PPAR-α的表达和功能[18]。本研究结果表明,ACAA1基因在肝脏中的表达量随着填饲时间的推移,其表达量逐步增加,在填饲14 d 时表达量最高,与ACAA2基因在朗德鹅肥肝形成过程中表达模式基本一致[14]。以上研究结果表明,通过填饲可以增加鹅ACAA1和ACAA2的表达,与SREBP 协同作用,促进肝脏合成大量脂肪酸。随着填饲的继续,ACAA1基因表达开始下降,在填饲结束限饲阶段的鹅肝脏中表达最低,限饲到21 d,其表达量恢复到填饲前水平,这可能与肥肝形成之后,肝脏中脂肪酸的氧化减少相关。
综上所述,本研究克隆获得朗德鹅ACAA1基因cDNA 全长序列并进行生物信息学分析,检测ACAA1基因在朗德鹅不同填饲阶段肝脏中的表达。结果表明,ACAA1基因的表达与鹅肥肝的形成密切相关,其作用机制还有待深入研究,为研究ACAA1基因在鹅肥肝形成中的生物学功能及其分子机制奠定基础。
