抗肿瘤药物临床超常用药分析
2020-04-20刘婧琳吴春暖宋晓坤
刘婧琳 吴春暖 宋晓坤

摘 要 目的:研究抗腫瘤药物临床超常用药的情况,为其临床合理用药提供参考。方法:参考国内外抗肿瘤药物应用指南及相关文献、《新型抗肿瘤药物临床应用指导原则(2018年版)》《超药品说明书用药目录(2019版)》《实用肿瘤内科学》(第2版)、美国食品药品监督管理局(FDA)批准的抗肿瘤药品说明书以及国内已上市的抗肿瘤药品说明书等资料,对抗肿瘤药物超常用药(包括超说明书用法、特殊适应证用法、新型抗肿瘤药物联用时给药顺序)进行归纳整理及分析。结果与结论:抗肿瘤药物超说明书用药共有4项,涉及11个品种,如超用药方案(重组人血管内皮抑制素、利妥昔单抗)、超给药途径(培美曲塞二钠、硼替佐米、贝伐珠单抗)、超治疗线数(厄洛替尼、吉非替尼)、超给药剂量(放线菌素D、吉西他滨、异环磷酰胺、依托泊苷),临床使用中应谨慎选用、严格监控,根据需要调整治疗方案。特殊适应证用法中涉及环磷酰胺、阿糖胞苷、甲氨蝶呤和顺铂4种药物的大剂量用法,剂量分别为 2 000~2 400 mg/m2、2 000 mg/m2、12 g/m2、80~120 mg/m2,临床使用中应注意个体差异,必要时进行治疗药物监测。新型抗肿瘤药物之间联用或与传统化疗药物联合用药方案中,共涉及5类共11项,包括分子靶向抗肿瘤药物联用传统化疗药物(如先用多西他赛,同时或之后用吉非替尼)、靶向免疫检查点药物联用传统化疗药物(如先用铂类再用纳武利尤单抗)、分子靶向抗肿瘤药物间的相互联用(如帕妥珠单抗和曲妥珠单抗须序贯给药,但先后顺序均可)等,临床使用中应明确患者的病理组织学诊断,对有明确靶点的药物须进行基因检测后再使用并严格遵循适应证用药。
关键词 抗肿瘤药物;超常用药;超说明书用药
ABSTRACT OBJECTIVE: To study the abnormal use of anti-tumor drugs in the clinic in order to provide reference for rational use of drugs in the clinic. METHODS: Referring to foreign and domestic anti-tumor drug use guidelines and literatures, Guidelines for Clinical Use of New Anti-tumor Drugs (2018 edition), Off-label Drug Use List (2019 edition), Practical Oncology (secondary edition), anti-tumor drug package inserts approved by FDA and package inserts of anti-tumor drug listed in China, abnormal use of antitumor drugs (including instructions, special indications, and the order of administration of new anti-tumor drugs) was summarized and analyzed. RESULTS & CONCLUSIONS: The off-label use of anti-tumor drugs were summarized in this paper, including 11 drug varieties and 4 kinds of off-label drug items, such as off-label drug use plan (recombinant human endostatin, rituximab), off-label administration route (pemetrexed disodium, bortezomib, bevacizumab), off-label administration lines (erlotinib, gefitinib), off-label drug dosage (actinomycin D, gemcitabine, ifosfamide, etoposide). They should be carefully selected and strictly monitored in clinical use, and treatment plan should be adjusted according to needs. Among the special indications, cyclophosphamide, cytarabine, methotrexate and cisplatin were used in large doses, which were 2 000-2 400 mg/m2, 2 000 mg/m2, 12 g/m2 and 80-120 mg/m2, respectively; individual differences should be paid attention to and therapeutic drug monitoring should be carried out if necessary. In the scheme of combination of new anti-tumor drugs or traditional chemotherapy drugs, there were 5 categories and 11 items in total, such as combination of molecular targeted anti-tumor drugs with traditional chemotherapy drugs (such as docetaxel at first, gefitinib at the same time or later), combination of target immunocheckpoint drugs with traditional chemotherapy drugs (such as platinum at first, then nivolumab), and molecular targeted anti-tumor drugs combination (such as pertuzumab and trastuzumab should be given in sequence, in either order). In clinical use, histopathological diagnosis should be made clear, and drugs with specific targets should be used after gene detection and strictly follow the indications.
KEYWORDS Anti-tumor drugs; Abnormal drug use; Off- label drug use
超常用药是指临床非常规给药方法,包括药品超说明书用法、说明书内的特殊适应证用法以及联合用药方案中特定的给药顺序等[1-4]。近年来,随着分子生物学的发展,抗肿瘤药物已经不局限于传统的细胞毒性药物,细胞受体、关键基因和调控分子等研究领域已有多种药物应用于临床[5]。面对种类繁多的抗肿瘤药物,选用适宜的给药方法是提高疗效、降低不良反应发生率的关键。
药品说明书是经国家药品监督管理部门审核通过的,判断用药行为是否得当的最具法律效力的文书,也是医师开具处方以及药师审核处方的依据。但是,药品说明书具有滞后性,随着人类疾病谱不断变迁和医学药学研究的不断发展,越来越多的药品新适应证和用法已被临床试验、国内外文献及指南和共识予以支持[5]。为改善治疗效果,超常用药势在必行。目前,超说明书用药在国际上已非常普遍[6-7]。我国对超说明书用药的合理性判定及操作规范非常重视。2010年3月,广东省药学会出台我国首个《药品未注册用法专家共识》[8],并于2019年5月10日发布修订补充版《超药品说明书用药中患者知情同意权的保护专家共识》[9],这是我国第一部由专业协会发布的针对超说明书用药的行业规范;中国药理学会发布的《超说明书用法专家共识》[10]和国家卫生健康委员会印发的《新型抗肿瘤药物临床应用指导原则(2018年版)》[11]都从政策和制度层面对超说明书用药予以指导,保障了患者及医师的权益。说明书内的特殊适应证用法重点对药品说明书收录的适应证、给药方法或给药剂量中毒副作用大、治疗窗窄、需要临床密切监护的特殊适应证的大剂量给药方案进行了梳理归纳[12-14]。两种或两种以上药物的联合用药方案已被普遍应用。大量临床研究结果表明,制定适宜的给药顺序,可以提高治疗效果、降低药物毒副作用,达到最佳治疗目标[15-16]。
使用传统化疗药物治疗是目前治疗肿瘤的主要手段之一。传统化疗药物是指作用在肿瘤细胞生长繁殖的不同阶段,抑制或杀死肿瘤细胞的细胞毒性抗肿瘤药物;传统化疗药在联合化疗方案中的给药顺序已有较为成熟的研究分析[7-8]。但对于近年来快速涌现的靶向药物为代表的新型抗肿瘤药物联合用药的研究尚处于探索阶段。《新型抗肿瘤药物临床应用指导原则(2018年版)》[11]指出,新型抗肿瘤药物包括小分子靶向药物和大分子单克隆抗体类药物,作用机制包括具有特异性抗肿瘤作用的肿瘤分子靶向治疗和通过促进宿主抗肿瘤免疫应答从而抑制肿瘤进展和转移的免疫治疗两大类。研究发现,靶向治疗除了对肿瘤生物学有影响外,还可以对宿主的免疫反应产生影响,如增加肿瘤抗原性、促进肿瘤内T细胞浸润[17]。基于此,笔者从药师角度,结合国内外指南及文献,参照药品说明书,重点对抗肿瘤药物超常用药进行汇总分析,为临床用药提供思路,以实现患者用药最佳适宜性的目的。
1 研究范围、资料来源、纳入与排除标准
1.1 研究范围
国家食品药品监督管理局(NMPA)自2006年1月1日起批准上市的,具有治疗肿瘤相关适应证的传统抗肿瘤药物和新型抗肿瘤药物。
1.2 资料来源
《新编药物学》(第18版)、《临床肿瘤内科手册》(第6版)、《实用肿瘤内科学》(第2版)、国内外抗肿瘤药物应用指南、《新型抗肿瘤药物临床应用指导原则(2018年版)》《超药品说明书用药目录(2019版)》、美国FDA批准的药品说明书以及国内已上市的抗肿瘤药品说明书等。
1.3 纳入与排除标准
1.3.1 抗肿瘤药物超说明书用法分析
纳入标准:未收录于NMPA批准的最新版药品说明书,且已被国外权威指南及文献或FDA批准的药品说明书收录的适应证、给药方案、途径、治療线数和剂量范围。
排除标准:《超药品说明书用药目录(2019版)》中收录的超说明书用法。
1.3.2 抗肿瘤药物特殊适应证用法分析
纳入标准:①NMPA批准的最新版说明书中收录的适应证、给药方法或给药剂量;②毒副作用大、治疗窗窄、需要临床给予密切监护的大剂量给药方案、特殊给药途径等。
排除标准:未在NMPA批准说明书范围内的适应证、给药方法或给药剂量。
1.3.3 新型抗肿瘤药物给药顺序分析
纳入标准:指南、文献推荐或NMPA批准说明书中包含的小分子靶向药物或大分子单克隆抗体类抗肿瘤药物联合给药中关于给药先后顺序的用药方案。
排除标准:①激素类药物;②抗肿瘤辅助药。
2 结果
2.1 抗肿瘤药物超说明书用法
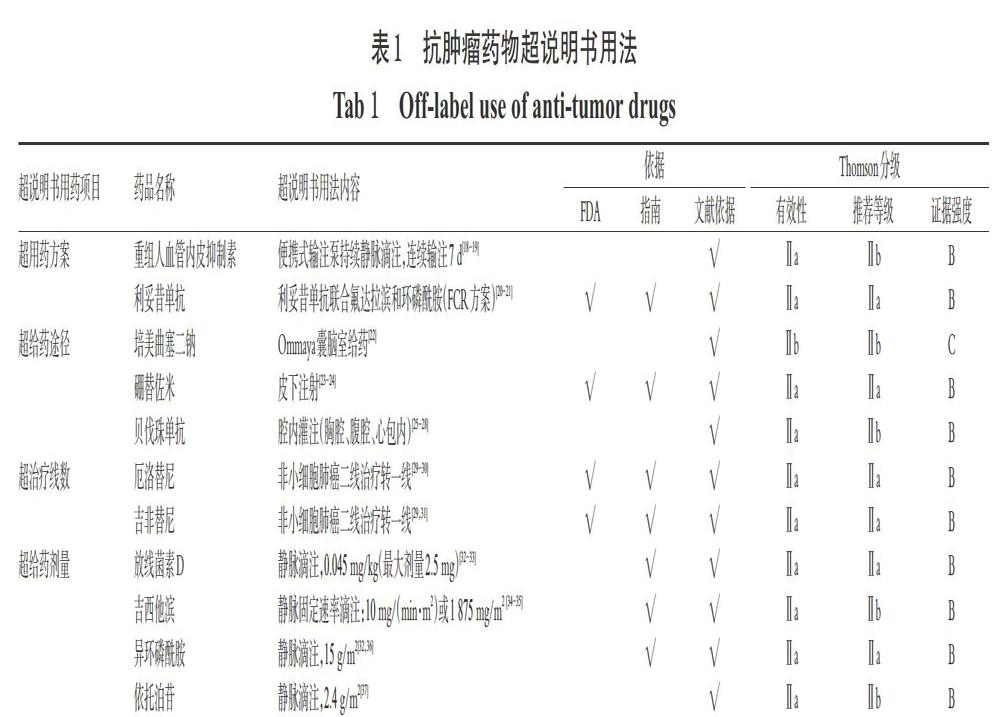
本研究抗肿瘤药物超说明书用法最终纳入11个药品,共11条超说明书用药项目,涉及超用药方案、超给药途径、超治疗线数、超给药剂量等。检索Micromedex数据库并进行Thomson分级[9],对有效性、推荐等级和证据强度进行划分,结果详见表1。
由表1可知,涉及抗肿瘤药物超说明书用药的包括烷化剂、抗代谢类、抗肿瘤抗生素和新型抗肿瘤药物。超说明书用药项目中,超用药方案共2项,超给药途径3项,超治疗线数2项,超给药剂量4项。其中有4项超说明书用药方案得到FDA批准,7项得到国内外指南支持,所有超说明书用药项目均有文献数据支持。
超用药方案方面,重组人血管内皮抑制素持续静脉泵入方案是使用微量输液泵连续输注7 d,血药浓度维持更加平稳,对多种实体瘤都具有显著抗肿瘤血管生成作用,治疗依从性明显优于连续给药14 d的传统方式。国内文献研究[18-19]对此种用法多有报道,目前国内已临床应用。FDA已批准利妥昔单抗联合氟达拉滨和环磷酰胺(FCR方案)用于年龄<65岁无明显并发症的慢性淋巴细胞白血病的患者,该方案可显著改善患者的无进展生存期(PFS)和总生存期(OS)[20-21]。
超给药途径方面,培美曲塞二钠经Ommaya囊脑室内给药仅在国内有研究报道[23]。相较于反复腰椎穿刺给药,Ommaya囊给药具有以下优势:(1)操作安全、便捷;(2)患者疼痛少;(3)便于重复推送脑脊液,监测药物浓度及肿瘤指标动态变化;(4)药物可随脑脊液循环均匀分布于中枢神经的各个部位,药物浓度可达到经腰椎穿刺给药同等剂量的10倍。当使用中枢神经系统药物进行鞘内化疗时,可考虑应用Ommaya囊给药。硼替佐米皮下注射给药已获FDA批准[23-24],目前国内已在临床应用,皮下注射给药时应使用1.4 mL生理盐水配制为2.5 mg/mL的药物溶液。国内外文献研究表明,贝伐珠单抗可腹腔灌注用于卵巢癌恶性腹水、胸腔灌注用于晚期癌症的恶性胸腔积液、心包内给药用于转移癌恶性心包积液等治疗,临床作用安全有效[25-28],目前国内已用于临床。
超治疗线数方面,表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)类的代表性药物厄洛替尼和吉非替尼的国内说明书注明这2种药物的适应证为既往接受过化学治疗失败的局部晚期或转移性非小细胞肺癌,而FDA已批准这2种药物用于EGFR突变的晚期非小细胞肺癌亚洲患者的一线治疗方案[29-31]。目前,大量研究已证实EGFR-TKI治疗EGFR突变晚期非小细胞肺癌相比化疗,可提高患者的PFS[31]。
超给药剂量方面,指南和文献研究[32-33]中支持放线菌素D用于儿童横纹肌肉瘤的治疗,小于1岁的儿童用药剂量为0.025 mg/kg,1岁以上的儿童用药剂量为0.045 mg/kg,但该药的剂量上限为2.5 mg,超剂量使用过程中需引起重视;支持大剂量吉西他滨和依托泊苷[34-35,37]用于自体造血干细胞移植前的用药方案,该方案克服了放化疗对正常组织和造血干细胞的毒性,明显提高了疗效,其中吉西他滨采用静脉固定速率滴注,避免吉西他滨长时间暴露及骨髓瘤细胞内激活酶饱和;支持大剂量异环磷酰胺联合甲氨蝶呤、顺铂和阿霉素用于骨肉瘤新辅助化疗,可提高患者手术机会[32,36]。
基于此,抗肿瘤药物超说明书用药时,应谨慎选用,严格监控,根据需要调整诊疗方案。
2.2 抗肿瘤药物特殊适应证用法
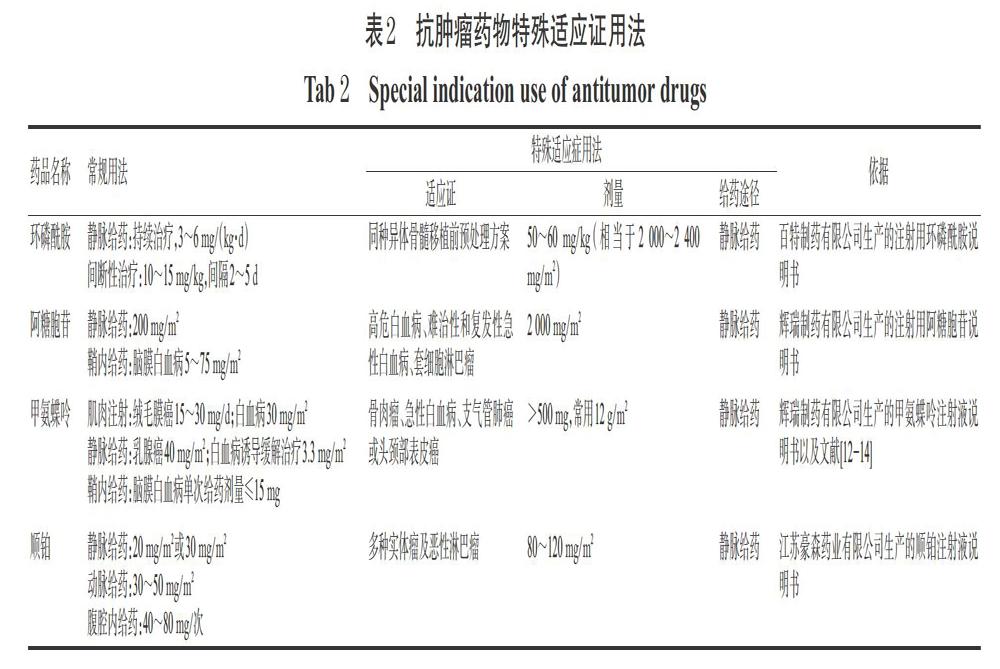
抗肿瘤药物特殊适应证用法为大剂量给药方案,包括环磷酰胺、阿糖胞苷、甲氨蝶呤和顺铂4种药物,具体用法详见表2。
在表2总结的抗肿瘤药物特殊适应证用法中,药物的毒副作用需要采取相应方法予以监测和减缓:环磷酰胺的代谢产物对尿路有刺激性,大剂量给药时应水化、利尿,促进代谢产物排出,同时给予美司钠,并密切关注肝肾功能,及时调整治疗剂量。甲氨蝶呤相关代谢酶基因存在多态性,大剂量给药血药浓度易受诸多因素影响,给药前后涉及到水化、碱化、亚叶酸钙解救、尿pH监测,以及输注时间、出入量记录等,其治疗指数低、毒性大,可能引发肾毒性、骨髓抑制,用药风险极高,需要进行治疗药物监测(TDM)[12-13]。另外国内的《大剂量甲氨蝶呤临床用药指南》[14]正在制订过程中,该指南适用于大剂量甲氨蝶呤合理用药的规范化。顺铂的肾毒性是大剂量用药的主要限制,应采用充分的水化治疗减轻其毒性。基于此,这类药物在临床使用中应注意个体差异,必要时进行TDM。
2.3 新型抗肿瘤药物联合用药方案
临床批准的新型抗肿瘤药物主要包括小分子靶向药物和大分子单克隆抗体类药物。对新型抗肿瘤药物与传统化疗药物联用方案和新型抗肿瘤药物相互之间联用方案中涉及用药先后顺序的部分进行总结,并阐述原因和依据,详见表3。
由表3可知,不同作用机制的抗肿瘤药物合理联用,可以增强疗效,如传统化疗药物与肿瘤免疫治疗药物或分子靶向药物联用、不同作用机制的分子靶向抗肿瘤药物与免疫检查点药物相互联用等。由于作用机制的不同,在联用中合理的用药顺序可提高抗肿瘤效果,产生协同作用,减轻药物的毒副作用;而對于EGFR突变的肺癌患者,在使用TKI类靶向药耐药后使用PD-1抗体治疗效果却并不好,还存在爆发进展的风险[44-46]。临床应用中,应明确患者的病理组织学诊断,对有明确靶点的药物须进行基因检测后使用并严格遵循适应证用药。
3 结语
抗肿瘤药物临床超常使用具有必要性、重要性和前瞻性。首先,在适宜的范围内进行抗肿瘤药物超常使用可为临床用药提供必要的安全性保障;其次,临床病例复杂多变,有证据支持的超常用药是临床的重要参考依据;此外,以基础性研究为先导的临床超常用药,可充分发挥前瞻性,推进医药学研究不断发展。随着对肿瘤标志物、基因表型、细分靶点、信号通路以及肿瘤微环境研究的不断深入,靶向治疗和免疫疗法将成为未来抗肿瘤药物的发展方向。在靶向抗肿瘤药物方面,我国首个抗体偶联(ADC)药物RC48已经进入临床试验阶段[47];异柠檬酸脱氢酶1(IDH1)突变有望成为新一代神经胶质瘤的治疗靶点[48]。在肿瘤免疫治疗领域,三功能抗体和双特异性T细胞衔接抗体已分别有药物上市,代表药物是卡妥索单抗和博纳吐单抗。未来,双特异性抗体的优势将进一步扩大,将有望靶向2个以上的治疗靶点[49]。最新研究发现,通过抑制活化细胞磷酸化酶1(PAC1)抑制PAC1通路,可激活T淋巴细胞的防御功能,也为肿瘤免疫治疗提供了潜在的新型药物靶点[50]。除了开发新药的临床试验外,拓展适应证、前推治疗线数和探索联合给药方式的多项临床试验也正在进行[51]。研究结果一经证实,将会被纳入正式依据。而传统化疗[如肝动脉化疗栓塞(TACE)介入/射频消融(RFA)/放疗]仍然会在免疫联合治疗中表现出经典且重要的作用;免疫治疗+靶向治疗+传统化疗的精准免疫联合方案也将得到更多应用,为患者提供新的选择。
综上所述,药师在参与临床用药过程中,应紧跟研究前沿,掌握药品的应用规范,合理开具、审核、调配和使用抗肿瘤药物,并依据患者的用药需求调整用药方案。在抗肿瘤药物超常使用中,药师应重点关注其注意事项,为临床提供必要的用药建议,共同促进合理用药。
参考文献
[ 1 ] 曾卫强.细胞毒药物在联合化疗方案中的给药时序[C]//2010年广东省药师周大会论文集.广州:广东省药学会,2011,6:709-714.
[ 2 ] 王程程,彭媛,陈芙蓉,等.肿瘤联合化疗与用药顺序[J].中国药房,2013,24(26):2470-2472.
[ 3 ] 薛朝军,靳会欣,安静,等.对某院超说明书用药申请进行循证医学分析[J].中国医院药学杂志,2018,38(14):1554-1557.
[ 4 ] 李萌,丁瑞麟,文庆莲.重组人血管内皮抑素联合紫杉醇不同时序给药降低肺癌移植瘤小鼠血清中VEGF和HIF-1α的水平及其意义[J].肿瘤,2016,36(3):264-271.
[ 5 ] 石远凯,孙燕.临床肿瘤内科手册[M]. 6版.北京:人民卫生出版社,2018:62-87.
[ 6 ] ARONSON JK,FERNER RE.Unlicensed and off-label uses of medicines:definitions and clarification of terminology[J]. Br J Clin Pharmacol,2017,83(12):2615-2625.
[ 7 ] 崔学艳,时银萍,时海燕,等.超说明书用药管理及药学服务模式探讨[J].中国医院药学杂志,2016,36(9):751- 754.
[ 8 ] 广东省药学会.关于印发《药品未注册用法专家共识》的通知[J].今日药学,2010,20 (4):1-3.
[ 9 ] 广东省药学会.超药品说明书用药中患者知情同意权的保护专家共识[J].今日药学,2019,29(6):1-13.
[10] 中国药理学会.超说明书用法专家共识[J].药物不良反应杂志,2015,17(2):101-103.
[11] 国家卫生健康委员会.新型抗肿瘤药物临床应用指导原则:2018年版[EB/OL].[2020-02-19].http://www.nhc.gov. cn/yzygj/s7659/201809/0ea15475f58a4f36b675cfa4716f- a1e4.shtml.
[12] 张殿宝,郭艳珍,张治业,等.大剂量甲氨蝶呤在淋巴瘤中的应用及其解救方式的研究[J].中国医药科学,2015,5(13):64-66.
[13] 康敏,黄榕彬,刘文辉.亚叶酸钙解救用于大剂量甲氨蝶呤疗法的研究进展[J].中南药学,2019,17(8):1247- 1250.
[14] 宋再伟,谈志远,刘维,等.基于循证药学实践的大剂量甲氨蝶呤临床用药指南制订方案[J].临床药物治疗杂志,2019,17(2):71-75、84.
[15] 王永莎,范娟,傅少志,等.阿帕替尼联合紫杉醇不同时序给药治疗肺癌的实验[J].肿瘤防治研究,2016,43(7):560-565.
[16] 刘燕湘.细胞毒药物的给药时序应遵循的四原则[J].临床合理用药杂志,2014,7(14):92.
[17] YAN J,ALLEN S,MCDONALD E,et al. MAIT cells promote tumor initiation,growth and metastases via tumor MR1[J]. Cancer Discovery,2020,10(1):124-141.
[18] 彭娜,李金铃,李貌,等.恶性肿瘤患者使用一次性便携式输注泵持续静脉泵入恩度的护理[J].中华肿瘤防治杂志,2016,23(S1):354-356.
[19] ZHANG C,DENG WY,LI N,et al. Clinical observation and therapeutic evaluation of intravenous pump of recombinant human endostatin combined with TP regimen in treating patients with advanced ovarian cancer[J]. Chronic Dis Transl Med,2015,1(3):158-162.
[20] National Comprehensive Cancer Network?(NCCN?).Chronic lymphocytic leukemia/small lymphocytic lymphoma[S]. Washington:NCCN?,2020:CSLL-D1-6.
[21] EICHHORST B,FINK AM,BAHLO J,et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine,cyclophosphamide,and rituximab in patients with advanced chronic lymphocytic leukaemia(CLL10):an international,open-label,randomized,phase 3,non-inferiority trial[J]. Lancet Oncol,2016.DOI:10. 1016/S1470-2045(16)30051-1.
[22] 林永娟,李會颖,黄明敏,等.经Ommaya囊脑室内注射培美曲塞治疗非小细胞肺癌软脑膜转移1例及文献回顾[J].中国肺癌杂志,2019,22(8):546-550.
[23] National Comprehensive Cancer Network?(NCCN?).Multiple myeloma[S]. Washington:NCCN?,2020:MYEL- F1-3.
[24] MOREAU P,PYLYPENKO H,GROSICKI S,et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma:a randomized,phase 3,non-inferiority study[J]. Lancet Oncol,2011,12(5):431-440.
[25] CHEN DW,SONG XY,SHI F,et al. Greater efficacy of intracavitary infusion of bevacizumab compared to traditional local treatments for patients with malignant cavity serous effusion[J]. Oncotarget,2017,8(21):35262- 35271.
[26] 孫志佳,杜楠,祁楠,等.胸腔灌注吉西他滨联合贝伐珠单抗治疗恶性胸腔积液的疗效分析[J].解放军医学院学报,2018,39(4):275-278.
[27] JIANG LX,LI P,GONG ZH,et al. Effective treatment for malignant pleural effusion and ascites with combined therapy of bevacizumab and cisplatin[J]. Anticancer Res,2016,36(3):1313-1318.
[28] CHEN D,ZHANG Y,SHI F,et al. Intrapericardial bevacizumab safely and effectively treats malignant pericardial effusion in advanced cancer patients[J]. Oncotarget,2016,7(32):52436-52441.
[29] National Comprehensive Cancer Network?(NCCN?).Non-Small Cell Lung Cancer[S]. Washington:NCCN?,2019:NSCL-18.
[30] ROSELL R,CARCERENY E,GERVAIS R,et al. Erlotinib versus standard chemotherapy as first line treatment for European patients with advanced EGFR mutation positive non-small cell lung cancer(EURTAC):a multicenter,open label,randomized phase 3 trail[J]. Lancet Oncol,2012.DOI:10.1016/S1470-2045(11)70393-X.
[31] WU YL,CHENG Y,ZHOU X,et al. Dacomitinib versus gefitinib as first-line treatment for patient with EGFR-mutation-positive non-small-cell lung cancer(ARCHER 1050):a randomized,open-label,phase 3 trial[J]. Lancet Oncol,2017.DOI:10.1016/S1470-2045(17)30608-3.
[32] National Comprehensive Cancer Network?(NCCN?). Soft Tissue Sarcoma[S]. Washington:NCCN?,2019:SARC-F1.
[33] RANEYR B,WALTERHOUSED O,MEZAJ L,et al. Results of the intergroup rhabdomyosarcoma study group D9602 protocol,using vincristine and dactinomycin with or without cyclophosphamide and radiation therapy,for newly diagnosed patients with low-risk embryonal rhabdomyosarcoma:a report from the soft tissue sarcoma committee of the childrens oncology group[J]. J Clin Oncol,2011,29(10):1312-1318.
[34] National Comprehensive Cancer Network?(NCCN?). Pancreatic Adenocarcinoma[S]. Washington:NCCN?,2019:PANC-F1-7.
[35] NIETO Y,THALLP F,VALDEZ BC,et al. Phase Ⅱ trial of high-dose gemcitabine/busulfan/melphalan with autologous stem cell transplantation for primary refractory or poor-risk relapsed Hodgkin lymphoma[J]. Biol Blood Marrow Transplant,2018,24(8):1602-1609.
[36] CASALI PG,BIELACK S,ABECASSIS N,et al. Bone sarcomas:ESMO-PaedCan-EURACAN clinical practice guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol,2018,29(Suppl 4):79-95.
[37] CARCELLER F,HIRSCH SG,KHABRA K,et al. High- dose etoposide and cyclophosphamide in adults and children with primary refractory and multiply relapsed acute leukaemias:the royal marsden experience[J]. Leuk Res,2019.DOI:10.1016/j.leukres.2019.106217
[38] BLACK PC,AGARWAL PK,DINNEY CP. Targeted therapies in bladder cancer:an update[J]. Urol Oncol,2007,25(5):433-438.
[39] ANSELL SM,LESOKHIN AM,BORRELLO L,et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkins lymphoma [J]. N Engl J Med,2015,372(4):311-319.
[40] HUGHES PE,CAENEPEEL S,WU LC. Targeted therapy and checkpoint immunotherapy combinations for the treatment of cancer[J]. Trends Immunol,2016,37(7):462- 476.
[41] AKBAY EA,KOYAMA S,CARRETERO J,et al. Activation of the PD-1 pathway contributes to immune escape in EGFR-driven lung tumors[J]. Cancer Discov,2013,3(12):1355-1363.
[42] WOLCHOK JD,KLUGER H,CALLAHAN MK,et al. Nivolumab plus ipilimumab in advanced melanoma[J]. N Engl J Med,2013,369(2):122-133.
[43] LEE L,GUPTA M,SAHASRANAMAN S. Immune che- ckpoint inhibitors:an introduction to the next generation cancer immunotherapy[J]. J Clin Pharmacol,2016,56 (2):157-169.
[44] GAINOR JF,SHAWA T,SEQUIST LV,et al. EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer:a retrospective analysis[J]. Clin Cancer Res,2016,22(18):4585-4593.
[45] HARATANI K,HAYASHI H,TANAKA T,et al. Tumor immune microenvironment and nivolumab efficacy in EGFR mutation-positive non-small cell lung cancer based on T790M status after disease progression during EGFR-TKI treatment[J]. Ann Oncol,2017,28(7):1532-1539.
[46] RITTMEYER A,BARLESI F,WATERKAMP D,et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK):a phase 3,open-label,multicenter randomised controlled trial[J]. Lancet,2017,389(10066):255-265.
[47] 魏巍.我國首个ADC抗癌药物进入临床试验[N].医药经济报,2015-12-07(010).
[48] TATEISHI K,WAKIMOTO H,LAFRATE AJ,et al. Extreme vulnerability of IDH1 mutant cancers to NAD+ depletion[J]. Cancer Cell,2015,28(6):773-784.
[49] 岳雅丽,尹骏,高向东,等.双特异性抗体药物在肿瘤治疗领域的研究进展[J].中国药科大学学报,2019,50(3):289-298.
[50] DAN LU,LIU L,SUN Y,et al. The phosphatase PAC1 acts as a T cell suppressor and attenuates host antitumor immunity[J]. Nat Immunol,2020,21(3):287-297.
[51] KIM ST,CRISTESCU R,BASS AJ,et al. Comprehensive molecular characterization of clinical responses to PD-1 inhibition in metastatic gastric cancer[J]. Nat Med,2018,24(9):1449-1458.
(收稿日期:2019-10-31 修回日期:2020-02-19)
(编辑:唐晓莲)
