胆固醇敏感器SCAP超表达引发人类肾系膜细胞的脂质聚集
2020-04-18王媛媛曲婷婷胡红霞常洁
王媛媛,曲婷婷,胡红霞,常洁
(1河南科技大学第一附属医院,2河南科技大学第二附属医院,河南 洛阳 471000)
早在1982年时,Moorhead就首次提出脂质具有肾毒性,在随后的一系列研究中发现,脂质代谢紊乱是肾脏损害的独立危险因素之一[1-2]。肾脏脂质的异常沉积会促进肾脏系膜细胞泡沫样变,足细胞结构、功能异常及凋亡增加。激活蛋白(SCAP)是一种多聚膜蛋白,它如同一个分子机器,控制着哺乳动物细胞膜内的胆固醇含量。它通过结合胆固醇调节元件结合蛋白(SREBPs)并将他们从内质网(ER)运输到高尔基体进行蛋白水解处理,蛋白水解释放的SREBP转录因子进入细胞核,从而促进胆固醇的合成和摄取。当胆固醇在ER膜上的含量超过一个阈值,固醇结合到SCAP,从而触发一系列的构象变化,从而阻止了SCAP-SREBP复合物离开ER。因此,SREBPs不再被加工,胆固醇合成和摄取受到抑制,胆固醇的稳态得到恢复[3-4]。本文旨在研究SCAP超表达在HMCs中的作用,为进一步探讨脂代谢紊乱引起相关肾脏损害的发生机制打下基础。
1 材料与方法
1.1 材料 人类肾系膜细胞(HMCs)(重庆医科大学);RPMI1640培养基、优等胎牛血清(塞默飞世尔化学制品有限公司);油红O染色试剂、细胞内胆固醇测定试剂盒(美国SIGMA);蛋白提取试剂盒(凯基生物科技发展有限公司);质粒抽提试剂Plasmid Mini KitⅠ(OMEGA公司);转染试剂Lipofectamine 2000(美国Invitrogen公司);DNeasy Blood&Tissure Kit(美国QIAGEN公司);兔源抗SCAP多克隆抗体、兔源抗β-actin多克隆抗体、羊抗兔HRP标记二抗(美国santa cluz);引物合成(生工生物工程);血浆低密度脂蛋白(LDL)(来自健康志愿者血清)。
1.2 方法(1)细胞培养:HMCs含5%优等胎牛血清、5 μg/ml胰岛素,5 μg/ml人转铁蛋白,5 ng/ml亚硒酸钠(Sigma),100 U/ml青霉素,100 μg/ml链霉素的RPMI1640培养基中,于20%O2、5%CO2、75%N2的恒温孵箱中37℃培养。(2)细胞转染:采用转染试剂Lipofectamine 2000,按照试剂说明,按照 DNA(ug):脂质体(ul)为1∶2的比例转染[5]。(3)LDL及oxLDL的制备和电泳[6]:取健康志愿者新鲜血浆,采用密度梯度超速离心法提取脂蛋白。将提取的LDL于4℃PBS中透析24小时;纯化后LDL与5 mol/L硫酸铜于37℃孵育18小时获得oxLDL。(4)油红O染色:将转染后的观察组和对照组HMCs细胞,分别用含和不含LDL干预条件的无血清培养基继续处理24小时后,4%多聚甲醛固定30 min,PBS清洗,1,2-丙二醇孵育2 min后加入0.2%油红O染液染15 min,苏木精染核,甘油明胶封片,正置显微镜高倍视野(×400)下观察拍照。(5)细胞内胆固醇的测定:收集各组细胞悬液,离心后去除上清,加入氯仿/甲醇2∶1溶液混匀,超声震碎后摇床室温震荡15 min,9000 rpm高速离心,取上清液真空干燥后溶于95%乙醇,测量细胞内总胆固醇的含量。离心后白色沉淀物中加入1M NaOH溶解沉淀12小时,然后使用Lowry法做蛋白的均一化分析。(6)实时荧光定量PCR测定和Western blot分析:不同干预条件的观察组细胞,分别提取总RNA和蛋白,检测逆转录后的LDLr,SCAP,HMGCoA的mRNA 表达水平和SCAP、SREBP-2、HMGCoA和β-actin蛋白表达水平。PCR引物见表1。
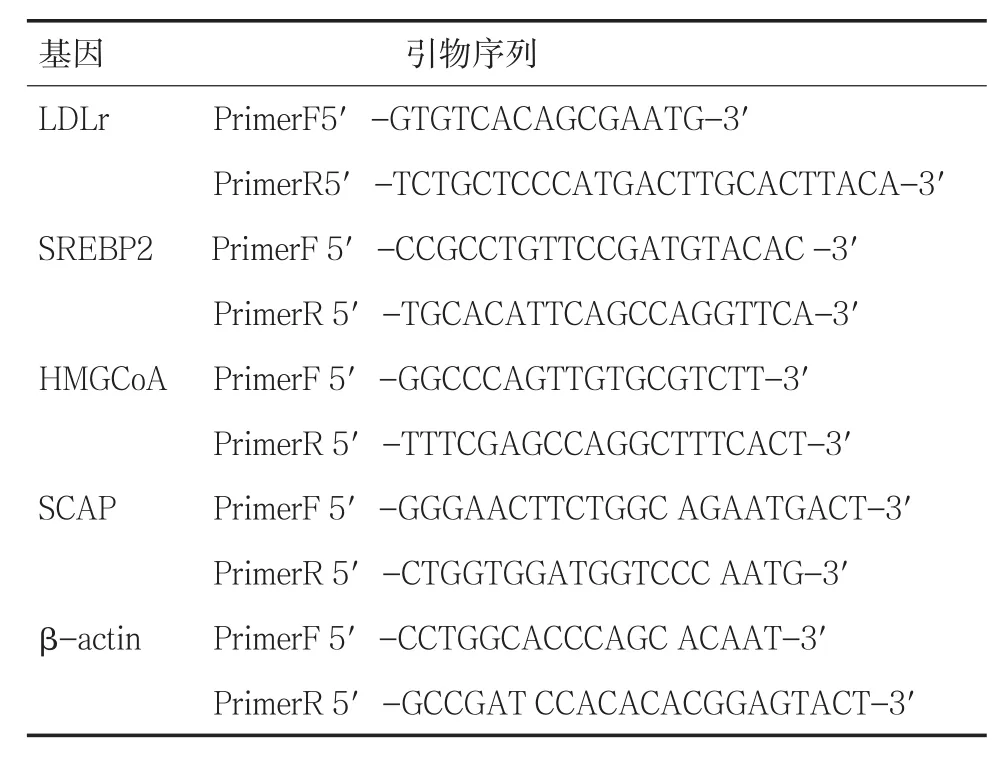
表1 PCR引物序列
1.3 统计学处理 应用SPSS 21.0统计软件,实验数据均以表示,组间比较采用t检验,检验水准为α=0.05。
2 结果
2.1 SCAP超表达于HMCs后的油红O染色结果 见图1。油红O染色用来检测HMCs细胞内中性脂质(胆固醇酯)的聚集情况。结果显示,当培养基不含LDL时,对照组细胞内未见明显脂滴(Ⅰ),SCAP超表达细胞内可见少量红染脂滴出现(Ⅱ),说明超表达促进HMCs对脂质的合成;当采用200 μg/ml LDL实验用培养基进行培养时,对照组细胞内出现明显脂滴(Ⅲ),而SCAP超表达组细胞内胆固醇的积聚异常增加(Ⅳ)。
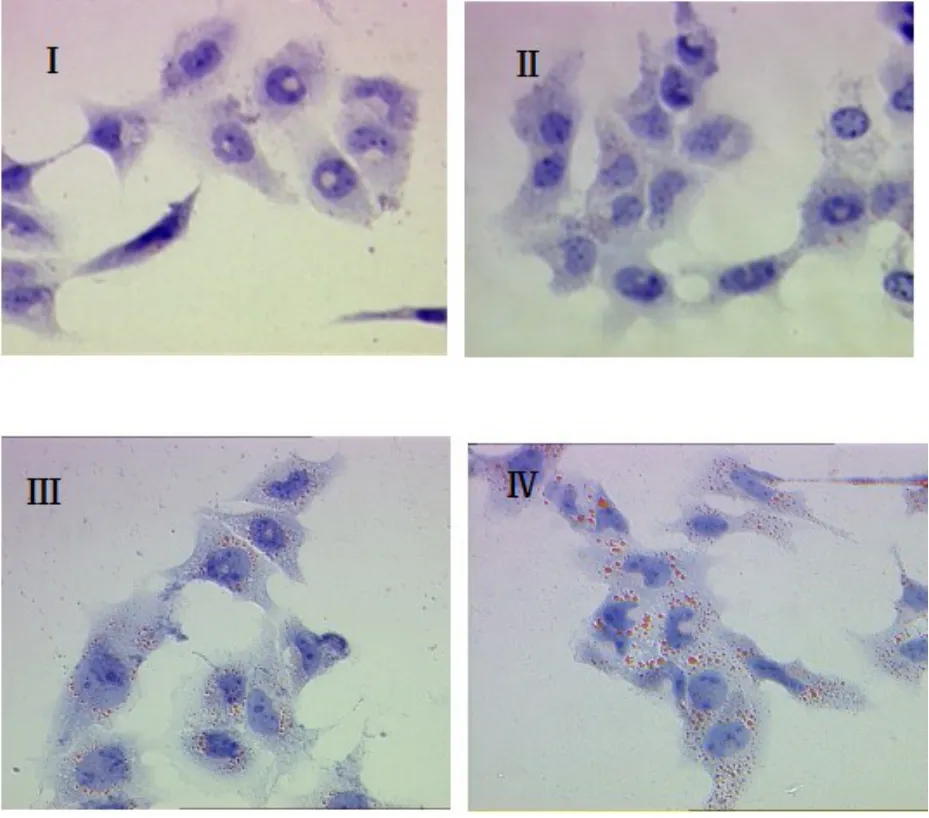
图1 SCAP超表达于HMCs后的油红O染色结果
2.2 SCAP超表达对HMCs细胞内胆固醇水平的影响 见图2。实验为对照组和超表达组HMCs分别在有无LDL培养基培养后的细胞内总胆固醇含量的测定,在无LDL培养基培养的HMCs细胞中,SCAP超表达的细胞内总胆固醇含量高于非超表达组,在200 μg/ml LDL加载的培养基培养的HMCs细胞中,SCAP超表达的细胞内总胆固醇含量同样高于非超表达组。以上数据与油红O染色的结果相一致。
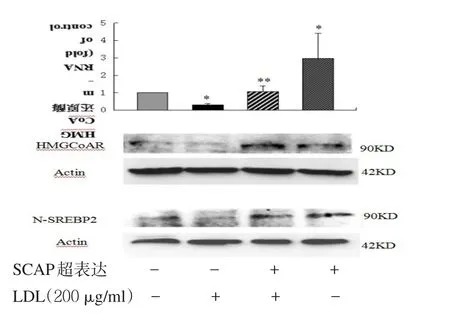
图2 SCAP超表达对HMCs细胞内总胆固醇水平的影响
2.3 SCAP超表达对细胞内LDLr、HMGCoA mRNA和蛋白及细胞核内SREBP2蛋白表达的影响 见表1,图3。转染SCAP后SCAP mRNA和蛋白超表达,200 μg/ml的LDL能使非超表达组的SCAP mRNA和蛋白表达明显下调,而对SCAP超表达组细胞无明显影响。2.4 LDLr、HMGCoA还原酶mRNA、蛋白及核蛋白SREBP2 N末端(N-SREBP2)蛋白表达 见图4。在非SCAP超表达的HMCs细胞中,200 μg/ml的LDL使得LDLr mRNA和蛋白的表达明显下调,同样的LDL处理条件SCAP超表达细胞并没有明显下调。在没有LDL处理条件下,SCAP超表达组细胞与非超表达组比较,LDLr水平有明显增高。
表1 LDL对SCAP、mRNA和蛋白表达的影响
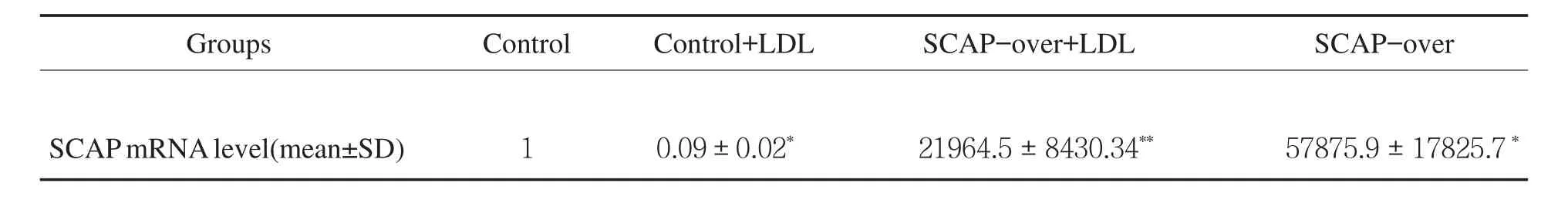
表1 LDL对SCAP、mRNA和蛋白表达的影响
Groups Control Control+LDL SCAP-over+LDL SCAP-over SCAPmRNAlevel(mean±SD) 1 0.09±0.02* 21964.5±8430.34** 57875.9±17825.7*
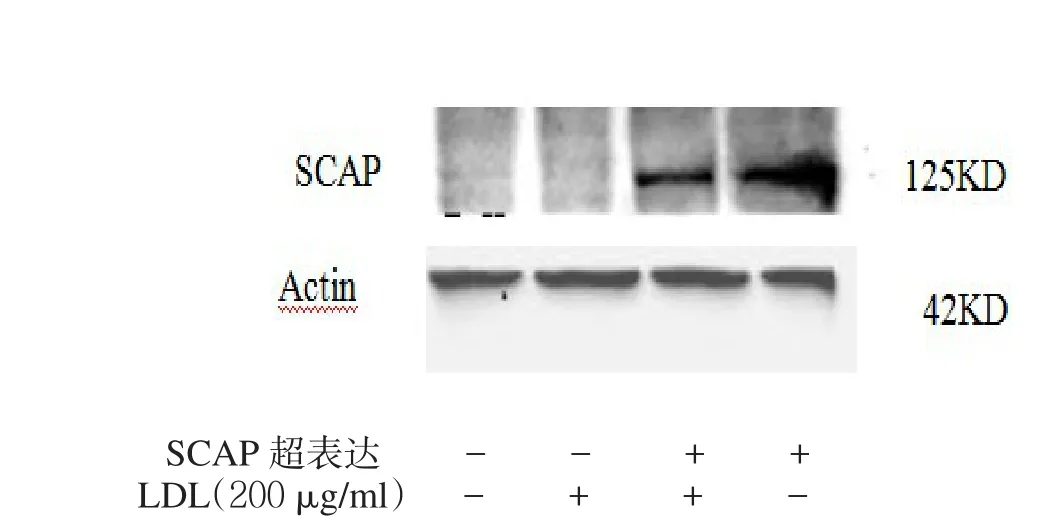
图3 LDL对HMCs细胞内SCAP mRNA和蛋白水平的影响
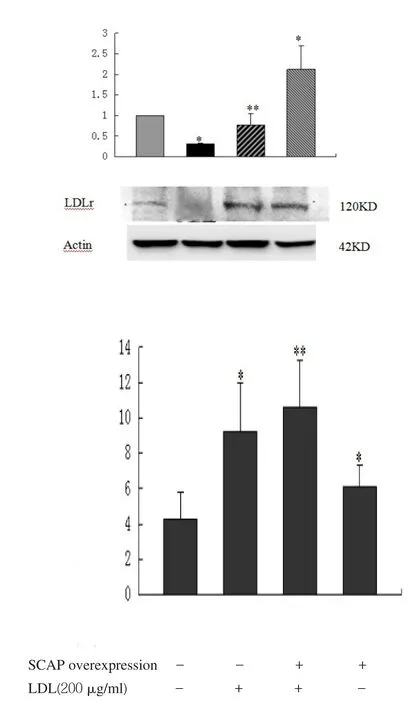
图4 LDL对HMCs细胞内LDLr、HMGCoA mRNA和蛋水平及核内N-SREBP2蛋白水平的影响
3 讨论
实验和临床研究表明,肾脏疾病的进展与血脂异常之间存在相关性,但脂质水平与肾脏疾病进展之间关系的潜在病理生理学机制尚未完全了解[7]。传统上认为清道夫受体是血脂异常和泡沫细胞形成的主要途径,Brown和Goldstein观察到,LDL受体的活性通过依赖于细胞内胆固醇浓度的反馈系统受到严格的代谢控制,该反馈系统保护细胞发生天然LDL的积累[3]。因此,在生理条件下,天然LDL不能产生富含脂质泡沫细胞。但我们以往的研究表明炎症介质等可诱导SCAP过表达,导致LDL受体表达失调[4,8-9]。近年来也有出现SCAP引发的脂代谢紊乱与炎症无关的研究证明[10]。本研究旨在通过破坏SCAP-SREBP介导的LDL受体反馈调控系统,研究单独的SCAP的过表达是否能增加HMCs中未修饰LDL的细胞内积累,为进一步探讨脂代谢紊乱的其他相关机制提供依据。
在HMCs中,我们检测了SCAP和SREBP2的表达和细胞内易位,这是SCAP过表达调控LDLr表达的两个重要分子。近年来,胰岛素诱导基因1(Insig I)被认为是一种甾醇调节的ER保留因子,与ER中的SCAP-SREBP2复合物相互作用。当细胞内胆固醇浓度增加时,insig I与SCAP中的甾醇敏感区域结合,阻止SCAP-SREBP2复合物从ER中退出。研究结果表明,在低密度脂蛋白浓度下,SCAP过表达时,SREBP2蛋白、LDL受体蛋白mRNA、HMGCoA蛋白表达均升高。我们证明SCAP过表达导致SCAP蛋白在LDL浓度较高的情况下被聚集到高尔基体,这表明SCAP过表达破坏了ER与高尔基体之间正常的SCAP转运。SCAP和SREBP2的增加可能反过来增加SCAP/Insig I的比例,导致SCAP-SREBP2复合物在SCAP过表达的ER中逃逸。
近来已经有很多研究证实了VSMCs在泡沫细胞形成中的重要作用[11]。因此我们也制作了原代培养的VSMCs,再次验证了SCAP过表达对该细胞的影响。结果显示,SCAP超表达后LDL受体和HMGCoA的表达增加,以及高浓度的LDL在细胞中沉积,与HMCs相似。因此,SCAP的功能紊乱可能是引发肾小球硬化等肾脏疾病的关键因素。
