一种双响应范围pH荧光探针的合成与性能
2020-04-17罗茜煜黄子杰郑祯凯区芷褀马立军
刘 甜, 罗茜煜, 黄子杰, 郑祯凯, 区芷褀, 马立军
(华南师范大学化学学院, 广州 510006)
pH在化学反应、环境监测以及生物系统等领域扮演着十分重要的角色[1-3],pH的异常将引发一系列不良反应,如导致化学反应失败、环境污染以及生物体病变等. 因此,在这些领域中对pH的准确测定具有非常重要的意义[4]. 传统的pH检测方法主要有指示剂法[5]、电位滴定法[6]、微电极法[7]、吸收光谱法以及电化学法等[8-9],而荧光探针具有高选择性、高灵敏度、高信噪比、操作简单、响应快速、可连续监控等优点[10-11],因此受到越来越多的关注.
迄今为止,许多优异的pH荧光探针已被报道,其中一些探针已经在分析化学、生理学和生物学中得到了广泛应用. 然而,大部分探针只能检测单一酸性[12-13]或碱性[14-15]范围的pH,在实际应用中相对受限,只有很少一部分能够在酸性和碱性2个范围内对pH进行检测[16]. 因此,有必要设计能够覆盖较大pH范围的荧光探针.
芘类化合物具有吸收系数大、单重态寿命长、荧光量子产率高、化学稳定性好等优良的光学性质,因此常被用作荧光团[17]. 目前已报道的少量基于芘的pH荧光探针[18-19]同样存在检测范围有限的问题. 本文以芘甲醛作为荧光发色基团,与水合肼进行简单的席夫碱反应,再与3,4-二羟基苯甲醛相结合,所得荧光探针分子4-((Z)-((E)-(芘-1-基亚甲基)亚肼基)甲基)苯-1,2-二醇(POH)上的亚氨基可以作为H+的识别基团,酚羟基作为OH-的识别基团,可同时检测酸性和碱性溶液的pH.
1 实验部分
1.1 实验仪器和试剂
仪器:荧光分光光度计(F-4600 FL,日本日立)、紫外-可见分光光谱仪(UV-2700,日本岛津)、核磁共振波谱仪(NMR Systems 600 MHz,美国瓦里安);液相色谱-质谱联用仪(LCQ Deca XP MAX,美国赛默飞世尔)、pH计(PHS-3C,上海精密雷磁).
试剂:1-芘甲醛、3,4-二羟基苯甲醛、水合肼(体积分数为80%)、冰醋酸、无水乙醇、二甲基亚砜(DMSO)、柠檬酸(CA)、Na2HPO4、NaH2PO4、NaOH、盐酸等均为分析纯,配制溶液用水为去离子水.
1.2 POH探针的合成与表征
POH探针的合成路线[20]如图1所示,POH探针的合成主要分2步:芘亚甲基联氨(1)的合成、POH(2)的合成.

图1 POH的合成路线
将1-芘甲醛(0.234 5 g,1.00 mmol)溶于20 mL无水乙醇后加入水合肼(0.150 0 g,3.00 mmol),滴加5滴冰醋酸作为催化剂,混合物在室温下搅拌反应约4 h得黄色沉淀,然后用真空泵抽滤,滤饼经过冰乙醇洗涤3次,最后将滤饼置于真空干燥箱中烘干得到0.182 1 g芘亚甲基联氨(1)黄色粉末,产率74.5%.
称取0.182 1 g产物1(0.745 mmol)溶于20.0 mL无水乙醇,加入3,4-二羟基苯甲醛(0.102 9 g,0.745 mmol),再加5滴冰醋酸作为催化剂,混合物在室温下搅拌反应约15 h得到橙黄色沉淀,采用真空泵抽滤,冰乙醇洗涤3次,最后置于真空干燥箱烘干得到0.206 0 g POH(2)橙黄色粉末,产率为75.9%.
化合物POH的1H NMR谱(600 MHz,DMSO)中化学位移分别为:δ9.70 (s,1H), 9.66 (s,1H), 9.38 (s,1H), 9.15 (d,J=9.3 Hz,1H),8.75~8.68 (m, 2H),8.42~8.35 (m,4H),8.32 (d,J=8.9 Hz,1H),8.26 (d,J=8.9 Hz,1H),8.15 (t,J=7.6 Hz,1H),7.46 (d,J=1.8 Hz,1H),7.24 (dd,J=8.1,1.8 Hz,1H),6.89 (d,J=8.0 Hz,1H). ESI-MS(甲醇作溶剂):分子式为C24H16N2O2,相对分子质量理论值、实验值分别为364.12、365.89.
1.3 测试溶液的配制
将POH溶于DMSO中配成浓度为5.0 mmol/L的母液,用CA、Na2HPO4、NaH2PO4分别与去离子水配制成不同pH的缓冲溶液(0.2 mol/L),并用浓度均为1.0 mol/L的盐酸和NaOH溶液对pH进行微调. 取12.0 μL POH母液加入到容积为3.0 mL的离心管中,配制成POH浓度为20.0 μmol/L的含DMSO(体积分数30%)且具有不同pH的缓冲溶液,进行后续的光谱测试.
2 结果与讨论
2.1 探针POH对H+和OH-响应的紫外-可见吸收光谱
为了更直观地观察探针对pH的响应现象,对酸性和碱性2个pH范围内的溶液紫外-可见吸收光谱分别作图(图2). 由于N原子的质子化,POH的谱图在pH小于6.00时出现2个吸收峰(图2A),波长分别为285、310 nm,归因于芘环内部的π-π*跃迁. 当pH从2.00增加到6.43时,在波长为285、310 nm处的吸收峰强度不断减弱; 当pH为6.43时,由于N原子的质子化作用减弱,孤对电子得到释放导致芘环内部的π-π*逐渐消失,n-π*跃迁慢慢增强,在波长约400 nm处开始出现1个新的吸收峰. 当pH持续增加时,该处的吸收峰强度增大且伴随着红移现象,导致溶液的颜色由无色变为浅黄色. 在pH由7.00增加到11.12的过程中(图2B),紫外吸收峰持续红移,与此同时溶液的颜色由浅黄色变为橙黄色. 产生这些变化的原因可能是碱性条件下POH分子上的酚羟基发生去质子化作用,导致推电子能力增强,电子流动性变大使得苯环上电子云密度发生改变,增强了从苯环到N原子上的分子内电荷转移(ICT)作用,从而导致吸收光谱发生明显红移,并且伴随溶液颜色的改变.

图2 不同pH下POH的紫外-可见吸收光谱和颜色变化
Figure 2 The UV-Vis spectra and color transformation of POH at different pH
2.2 探针POH对H+和OH-响应的荧光识别
在酸性条件下,测试激发波长为350 nm时的荧光发射光谱(图3A),POH的缓冲溶液在波长465 nm处有较强的荧光发射峰,且在紫外灯照射下溶液呈现蓝色荧光. 随着pH的不断增大,POH的荧光强度逐渐减弱,在pH=7.00时荧光强度几近猝灭. 产生这种变化的原因是酸性条件下由于N原子的质子化作用,抑制了POH分子内N原子对芘环的光致电子转移(PET)效应,从而使酸性条件下芘环的荧光得以恢复; 中性条件下N原子未被质子化,因此自由电子转入激发态荧光团,使荧光猝灭. 当pH继续增至9.00时(图3B),POH缓冲溶液在波长465 nm处荧光峰的强度又开始逐渐增强,紫外灯下溶液的荧光变为亮蓝色. 这种变化归因于碱性条件下POH分子中苯环上的酚羟基发生去质子化作用,推电子能力增强,电子流动性变大使苯环上电子云密度发生改变从而增强了从苯环到N原子上的ICT作用,同时阻止了N原子对芘环的PET作用而使荧光强度开始增加(图4).

图3 不同pH下POH的荧光光谱
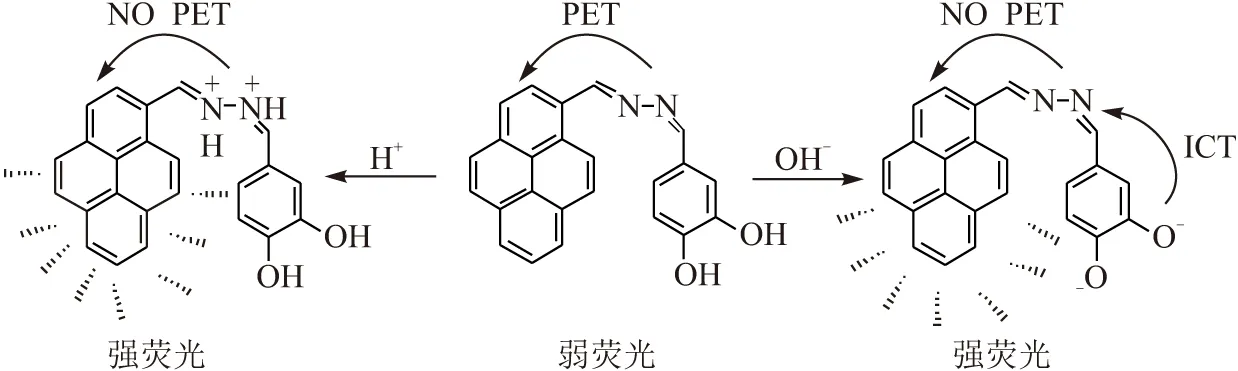
图4 POH探针的酸碱响应过程
根据方程[21]
pKa=pH+lg[(Fmax-F)/(F-Fmin)]
可以计算出2个范围内POH的pKa,pH在1.85~7.62酸性范围时pKa=4.69(图5A),pH在7.51~11.12碱性范围内POH的pKa=10.40(图5B),说明POH在酸性和碱性2种条件下都能很好地检测溶液的pH[22],是一种检测范围很宽且灵敏度高的pH荧光探针.
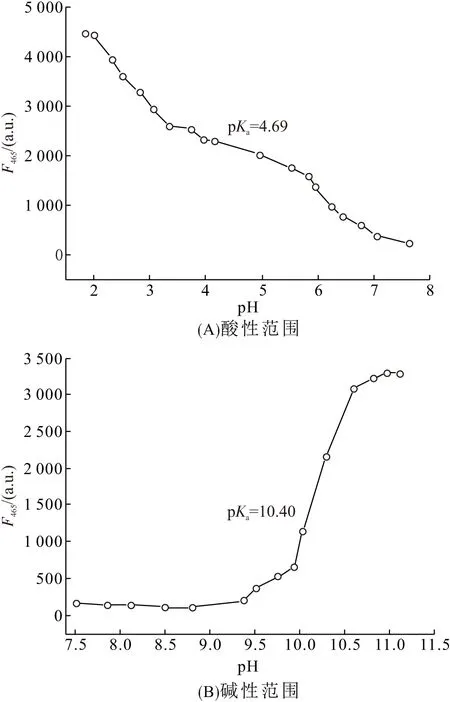
图5 POH的荧光发射峰强度与pH的关系
Figure 5 The intensity of the fluorescence emission peak of POH at different pH
2.3 探针POH的抗干扰性
为了研究探针POH的实用性,对其进行干扰性实验检测. 在pH为2.34和10.21的POH缓冲溶液中分别加入10倍浓度的常见金属离子,并测试其荧光发射光谱(图6). 在酸性溶液中,金属离子的加入对POH溶液的荧光峰强度影响不大(图6A);而在碱性溶液中,除了Hg2+、Mn2+和Co2+等少数金属离子干扰较大外,其余金属离子对pH的检测几乎无影响. 总体上,POH是一种具有实际应用潜力的高选择性pH荧光探针.
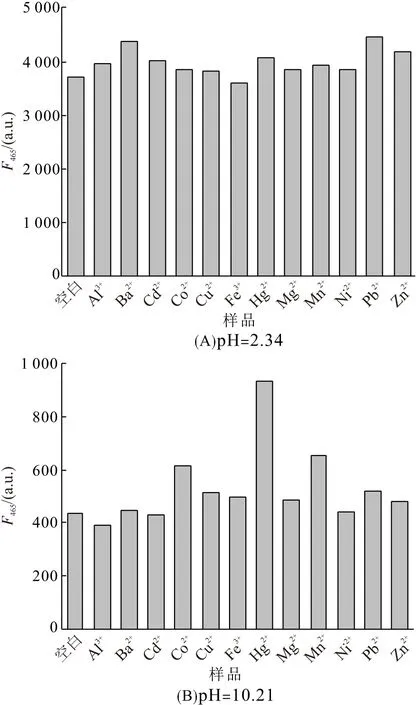
图6 不同pH下POH溶液的抗干扰性检测
3 结论
采用芘甲醛与3,4-二羟基苯甲醛通过与水合肼之间的席夫碱反应合成了一种高灵敏性、高选择性的pH荧光探针POH,并表征了它的结构. 通过对紫外-可见吸收光谱和荧光发射光谱的测试,发现探针POH在酸性和碱性条件下对缓冲溶液的pH均表现出比色和荧光的双重识别响应,并且溶液颜色有明显的转变. 同时在不同pH下与其他常见金属离子共存时对pH检测的干扰影响不大,是一种可以检测很宽范围pH的高潜力应用型荧光探针.
