外源GA3对油茶花器官内源激素与坐果率的影响
2020-04-16葛晓宁钟秋平曹林青郭红艳袁婷婷周幼成
葛晓宁,钟秋平,罗 帅,曹林青,郭红艳,袁婷婷,周幼成
(中国林业科学研究院亚热带林业实验中心,江西 分宜 336600)
油茶(Camellia oleifera Abel.)属山茶科(Theaceae)山茶属(Camellia L.)植物,为灌木、小乔木或中乔木,雌雄同花,花果同期,是我国特有的木本食用油料树种[1-3]。目前,在生产栽培中,油茶自交可育性低,若花期遇到阴雨天气会严重影响授粉受精,导致落花落果严重,极大地影响油茶产业高产高效的发展[4]。在我国南方,低温霜冻严重,油茶幼果在树上过冬,不同品种与立地条件下的油茶产量差距很大[5]。因此,如何使油茶多花多果、提高坐果率、减少落果以促其丰产稳产,成为生产中亟待解决的问题。
植物生长发育的控制发生在3个层次上:胞内控制、胞间控制和胞外控制,其中,胞间控制主要受植物激素调控,协调不同组织和细胞间的生理活动。激素在控制植物生长发育过程中起着关键的调控作用。植物激素作为一种化学信号,介导细胞与细胞间、器官与器官间、环境与植物间的相互作用,贯穿在整个植物生长发育的全过程[6]。开花是植物生长发育过程中尤为重要的组成部分[7]。植物在开花结实过程中,激素水平与花器官发育以及植物坐果率息息相关[8-11]。油橄榄(Olea europaea L.)、库尔勒香梨(Pyrus brestschneideri Rehd.)、扁桃(Amygdalus communis L.)等果树花期喷施外源激素可显著提高其坐果率和产量[12-14]。赤霉素(GAs)是一种二萜酸类植物激素,能够防止植株花期落花,提高坐果率[15]。目前,通过喷施外源GA3来调控花卉作物开花坐果的研究较多[16-19],而喷施GA3对油茶花器官内源激素等影响的研究鲜有报道。本文以9年生‘长林4号’油茶为研究对象,探究不同浓度的外源GA3对油茶花器官内源激素及坐果率的影响,分析油茶花器官内源激素与坐果率间的相关性,为油茶高产栽培和科学管理提供技术依据。
1 材料与方法
1.1 研究区概况与试验材料
试验于2017年在江西省分宜县中国林科院亚热带林业实验中心油茶繁育基地(114°29′ E,27°33′ N)进行。该地为低山丘陵地形,海拔100 m,亚热带季风性湿润气候,年平均气温17.2℃,年平均降水量1 600 mm,降水量主要集中在春夏季 3—6月,全年无霜期 270 d。试验林面积1.33 hm2,土壤为红壤土,每年3月份施有机肥。供试材料为9年生油茶优良无性系‘长林4号’,生长良好、长势一致,地径6.5~9.0 cm,树高1.8~2.5 m,冠辐 1.8~2.5 m。
1.2 试验设计
试验于2017年10月进行,采用单因素试验设计,每个处理设3个重复,每个重复6株,处理之间留1株作为保护株,留1行作为保护行,并设置1个空白对照组(CK),共6个处理(表1)。每隔7 d进行叶面喷施,分别于10月25日(未开花)、11月3日、11月10日、11月18日喷施外源GA3,对照组喷施清水,喷施至滴水状为止。
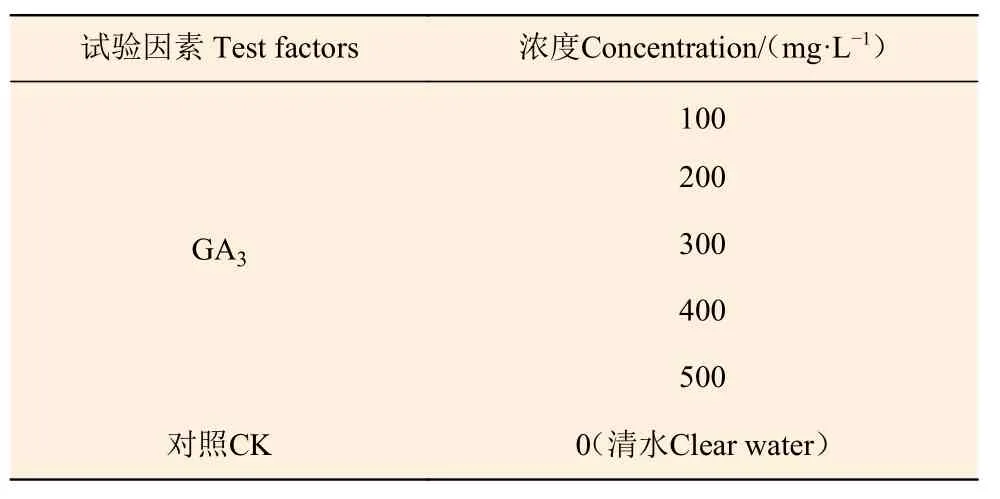
表 1 外源激素单因素试验设计Table 1 Test factors level of hormone
1.3 调查方法
在试验前期,将试验树编号标记挂牌,根据生长势、枝粗以及枝位等指标选出标准枝,分别标记。于2017年11月15日最后一次喷施外源激素前统计各处理中每株的花朵数。于2018年4月8日坐果后调查记录各处理中每株的坐果数,按照以下公式计算坐果率:坐果率=坐果数(个)/开花数(个)×100%。
1.4 采样与测定方法
分别于2017年11月2日、11月9日、11月17日和11月26日采集油茶开花的4种状态即含苞、半开、全开与初萎的样品,每个处理采取15朵,迅速将雌蕊、雄蕊分离,分别取样于锡箔纸内,各1 g,置于存有足量液氮的泡沫箱中速冻,超低温冰箱保存备用,用于植物内源激素的测定。花器官中内源激素生长素(IAA)、赤霉素(GA3)、细胞分裂素(ZR)与脱落酸(ABA)采用酶联免疫法(ELISA)测定,试剂盒来源于中国农业大学农学与生物技术学院。
1.5 统计分析
试验数据采用Excel 2016、SPSS Statistics17.0软件进行Duncan多重比较与Kendall显著差异性分析,并用Origin7.5软件进行二阶指数线性回归。
2 结果与分析
2.1 不同浓度外源GA3对油茶坐果的影响
由图1可见:喷施低浓度的GA3可显著提高油茶坐果率;对照组CK坐果率为46.30%,喷施100 mg·L-1GA3的油茶坐果率最高,为70.38%;200 mg·L-1GA3处理的油茶坐果率低于对照组,为 44.65%;300、400、500 mg·L-1GA3处理的油茶坐果率依次降低,分别为42.10%、38.61%、32.48%,均低于对照。说明在试验水平范围内,低浓度的外源GA3处理有助于提高油茶坐果率,高浓度的外源GA3处理则起到抑制作用。
对油茶坐果率(y)与外源GA3浓度(x)进行单因素回归分析,通过对单因素回归方程式求导可知,当x=0时,y=46.30,即a点代表对照组的坐果率;当x=xc=66.69±5.72时,y=77.05,此时b点y值达到最大,且坐果率增幅达到66.40%;当y=46.30时,可得d点外源GA3的浓度值x=132.63;当 x=100时,c点坐果率增幅达 40.00%;当33.03≤x≤100时,y≥64.98,才能达到油茶坐果率增幅大于或等于40.00%的效果。因此,提高油茶坐果率的最佳GA3浓度为66.69 mg·L-1,外源GA3浓度在 33.03~100.00 mg·L-1能获得坐果率增幅大于或等于40.00%的效果,当外源GA3浓度超过132.63 mg·L-1时,对油茶坐果产生抑制作用。
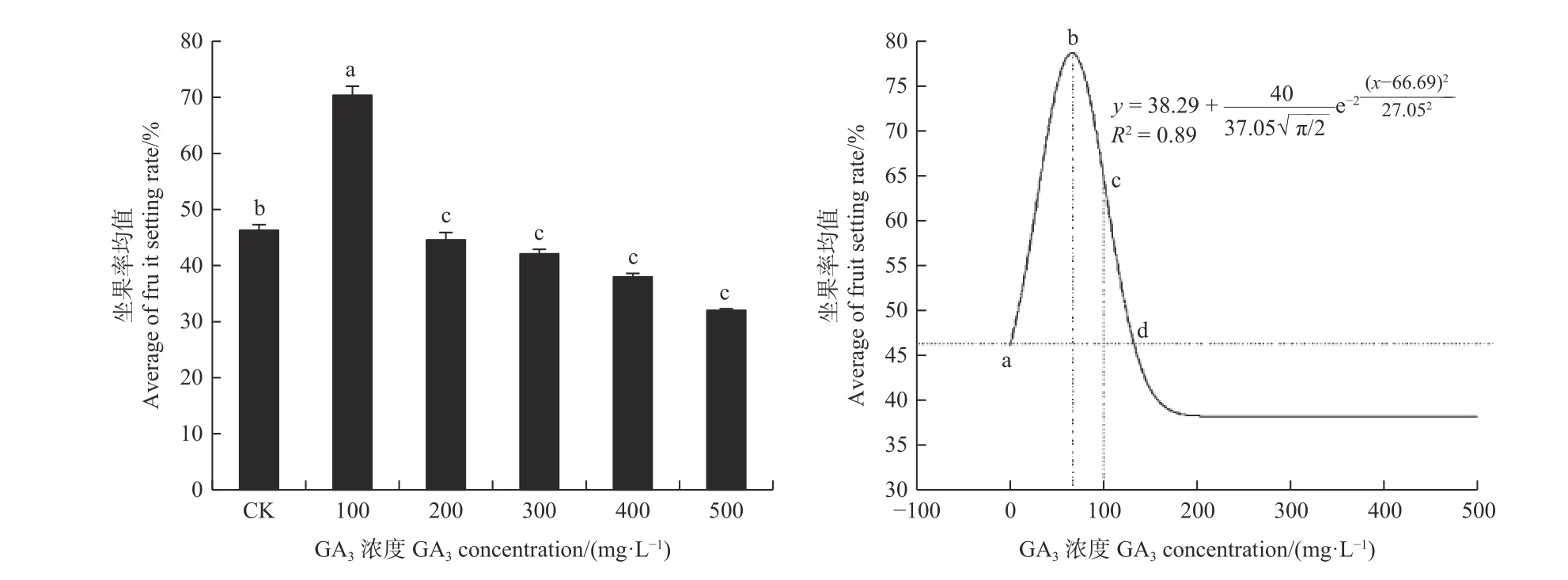
图 1 不同浓度GA3对油茶坐果率的影响Fig. 1 Effects of different concentrations of GA3 on the fruit setting rate of C. oleifera
2.2 不同浓度外源GA3对油茶花器官内源激素含量的影响
2.2.1 外源GA3对油茶雌蕊ABA含量的影响 由图2可见:含苞时期,不同浓度GA3处理油茶雌蕊ABA含量与对照差异均显著,其中200 mg·L-1GA3处理的雌蕊ABA含量显著高于对照,其它浓度GA3处理的雌蕊ABA含量均显著低于对照;半开时期,与对照相比,300 mg·L-1GA3处理的雌蕊ABA含量显著高于对照,100、200、400 mg·L-1GA3处理的雌蕊ABA含量显著低于对照;全开时期,与对照相比,400、200、100 mg·L-1GA3处理的雌蕊 ABA含量显著高于对照,300 mg·L-1GA3处理的雌蕊ABA含量显著低于对照;初萎时期,与对照相比,300 mg·L-1GA3处理的雌蕊ABA含量显著高于对照,100、500、200 mg·L-1GA3处理的雌蕊ABA含量显著低于对照。
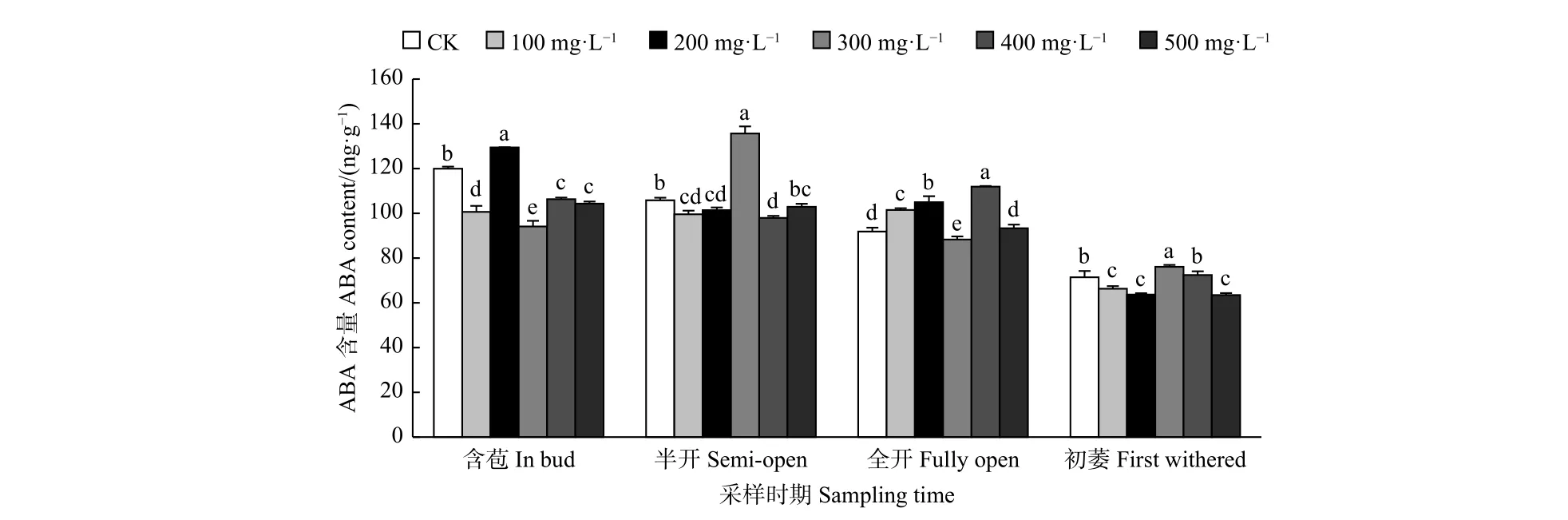
图 2 GA3处理对油茶雌蕊ABA含量的影响Fig. 2 Effects of GA3 treatment on the contents of ABA in pistil of C. oleifera
2.2.2 外源GA3对油茶雌蕊ZR含量的影响 由图3可见:含苞时期,与对照相比,200、300 mg·L-1GA3处理的雌蕊ZR含量显著高于对照,500 mg·L-1GA3处理雌蕊ZR含量显著低于对照;半开时期,与对照相比,500、100、300 mg·L-1GA3处理的雌蕊ZR含量显著高于对照,其它处理的雌蕊ZR含量显著低于对照;全开时期,与对照相比,100、400、300、200 mg·L-1GA3处理的雌蕊 ZR含量显著高于对照,500 mg·L-1GA3处理的雌蕊ZR含量显著低于对照;初萎时期,与对照相比,400、500、100 mg·L-1GA3处理的雌蕊ZR含量显著高于对照,其它处理的雌蕊ZR含量显著低于对照。
2.2.3 外源GA3对油茶雌蕊GA3含量的影响 由图4可见:含苞时期,与对照相比,200、500、400 mg·L-1GA3处理的雌蕊GA3含量显著高于对照,300、100 mg·L-1GA3处理的雌蕊GA3含量显著低于对照;半开时期,300、100、500 、400 mg·L-1GA3处理的雌蕊GA3含量显著高于对照;在全开时期,不同浓度GA3处理的雌蕊GA3含量均显著高于对照;初萎时期,与对照相比,100、400、300、200 mg·L-1GA3处理的雌蕊GA3含量均显著高于对照,500 mg·L-1GA3处理的雌蕊GA3含量显著低于对照。

图 3 GA3处理对油茶雌蕊ZR含量的影响Fig. 3 Effects of GA3 treatment on the contents of ZR in pistil of C. oleifera
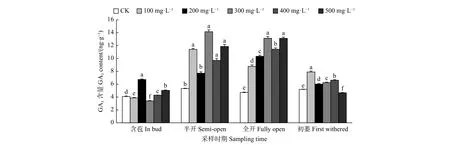
图 4 GA3处理对油茶雌蕊GA3含量的影响Fig. 4 Effects of GA3 treatment on the contents of GA3 in pistil of C. oleifera
2.2.4 外源GA3对油茶雌蕊IAA含量的影响 由图5可见:含苞时期,与对照相比,300、400 mg·L-1GA3处理的雌蕊IAA含量显著高于对照,其它处理的雌蕊IAA含量显著低于对照;半开时期,与对照相比,100 mg·L-1GA3处理的雌蕊IAA含量显著低于对照;全开时期,与对照相比,300、400、100、500 mg·L-1GA3处理的雌蕊IAA含量显著高于对照;初萎时期,与对照相比,100 mg·L-1GA3处理的雌蕊IAA含量显著高于对照,其它处理的雌蕊IAA含量显著低于对照。总体来看,随着采样时期的进行,喷施外源GA3使雌蕊IAA含量呈先上升后下降的变化趋势。
2.2.5 外源GA3对油茶雄蕊ABA含量的影响 由图6可见:含苞时期,与对照相比,400、500、200、300 mg·L-1GA3处理的雄蕊ABA含量显著高于对照,100 mg·L-1GA3处理的雄蕊ABA含量显著低于对照;半开时期,与对照相比,200、300、400 mg·L-1GA3处理的雄蕊ABA含量显著高于对照,500 mg·L-1GA3处理的雄蕊ABA含量显著低于对照;全开时期,与对照相比,100、400 mg·L-1GA3处理的雄蕊ABA含量显著高于对照,200、300、500 mg·L-1GA3处理的雄蕊ABA含量显著低于对照;初萎时期,与对照相比,不同浓度GA3处理的雄蕊中ABA含量显著低于对照。
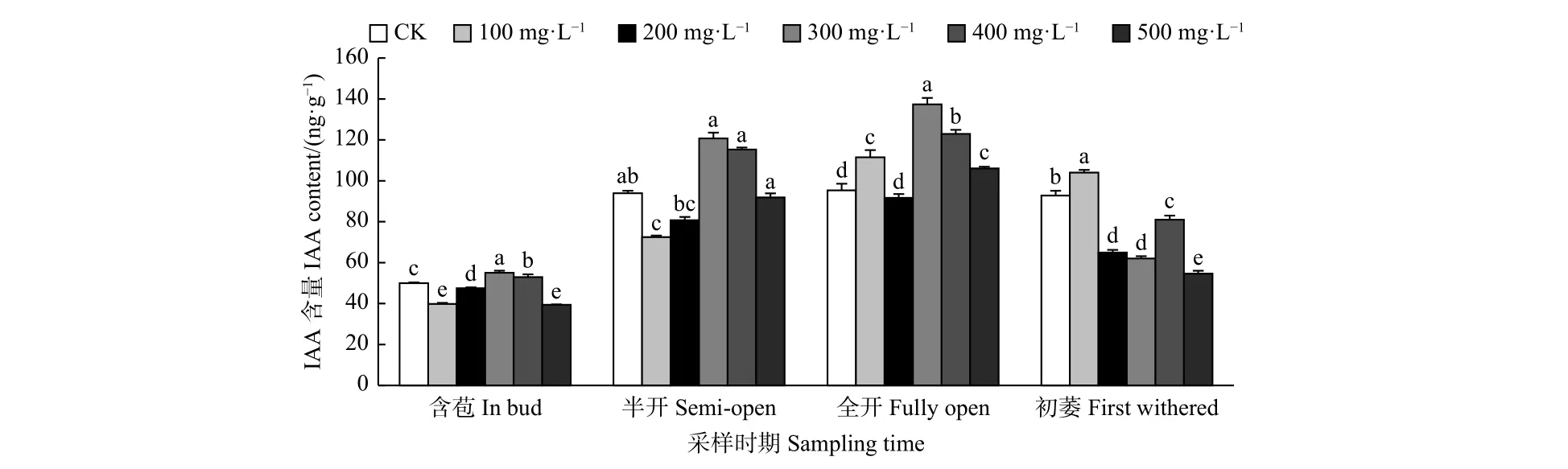
图 5 GA3处理对油茶雌蕊IAA含量的影响Fig. 5 Effects of GA3 treatment on the contents of IAA in pistil of C. oleifera

图 6 GA3处理对油茶雄蕊ABA含量的影响Fig. 6 Effects of GA3 treatment on the contents of ABA in stamen of C. oleifera
2.2.6 外源GA3对油茶雄蕊ZR含量的影响 由图7可见:含苞时期,与对照相比,200、500、100、300 mg·L-1GA3处理的雄蕊ZR含量显著高于对照;半开时期,与对照相比,不同浓度GA3处理的雄蕊ZR含量均显著低于对照;全开时期,与对照相比,200、400、100 mg·L-1GA3处理的雄蕊ZR含量显著高于对照;初萎时期,与对照相比,100、500、300 mg·L-1GA3处理的雄蕊ZR含量显著高于对照,200 mg·L-1GA3处理的雄蕊ZR含量显著低于对照。
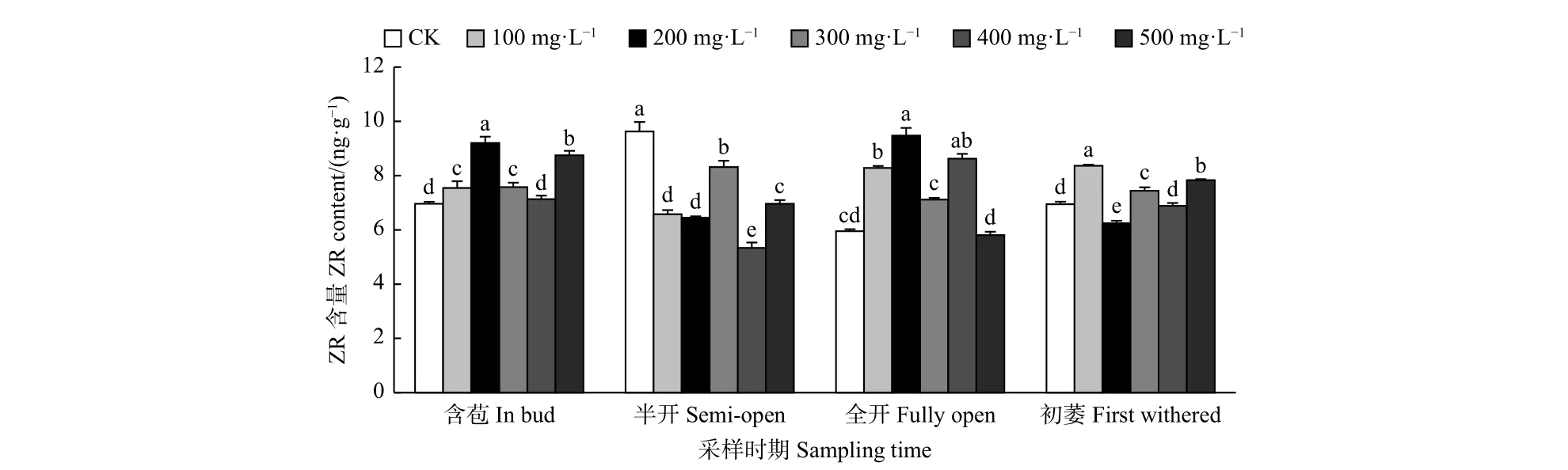
图 7 GA3处理对油茶雄蕊ZR含量的影响Fig. 7 Effects of GA3 treatment on the contents of ABA in stamen of Camellia oleifera
2.2.7 外源GA3对油茶雄蕊GA3含量的影响 由图8可见:含苞时期,与对照相比,100、300、400、500 mg·L-1GA3处理的雄蕊GA3含量显著高于对照,200 mg·L-1GA3处理的雄蕊GA3含量显著低于对照;半开时期,与对照相比,400、300、500、100 mg·L-1GA3处理的雄蕊GA3含量显著高于对照,200 mg·L-1GA3处理的雄蕊GA3含量显著低于对照;全开时期,与对照相比,200、400、100 mg·L-1GA3处理的雄蕊GA3含量显著高于对照,500、300 mg·L-1GA3处理的雄蕊GA3含量显著低于对照;初萎时期,与对照相比,不同浓度GA3处理的雄蕊GA3含量均显著低于对照。
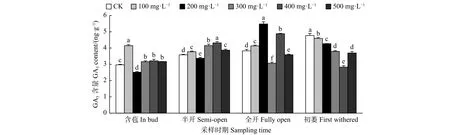
图 8 GA3处理对油茶雄蕊GA3含量的影响Fig. 8 Effects of GA3 treatment on the contents of ABA in stamen of C. oleifera
2.2.8 外源GA3对油茶雄蕊IAA含量的影响 由图9可见:含苞时期,与对照相比,300 mg·L-1GA3处理的雄蕊IAA含量显著高于对照,其它浓度GA3处理的雄蕊IAA含量显著低于对照;半开、全开时期,与对照相比,不同浓度GA3处理的雄蕊IAA含量均显著低于对照;初萎时期,与对照相比,100、300、400、200 mg·L-1GA3处理的雄蕊IAA含量显著高于对照。总体来看,在初萎时期喷施外源GA3可显著提高雄蕊IAA的含量。
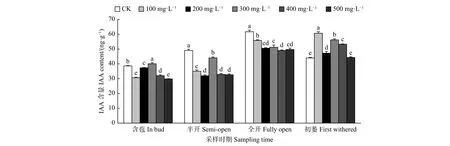
图 9 GA3处理对油茶雄蕊IAA含量的影响Fig. 9 Effects of GA3 treatment on the contents of IAA in stamen of C. oleifera
2.3 外源GA3与油茶雌蕊、雄蕊内源激素和坐果率的相关性分析
2.3.1 外源GA3与油茶雌蕊内源激素和坐果率的相关性分析 由表2可见:外源GA3与油茶雌蕊ABA在含苞时期呈极显著负相关(P<0.01),在半开时期呈显著负相关(P<0.05),在全开时期呈极显著正相关(P<0.01);外源GA3与油茶雌蕊ZR在半开、全开时期均呈极显著正相关(P<0.01),在初萎时期呈显著正相关(P<0.05);外源GA3与油茶雌蕊GA3在半开、全开与初萎时期均呈极显著正相关(P<0.01);外源GA3与油茶雌蕊IAA在含苞、半开时期均呈极显著负相关(P<0.01),外源GA3与油茶雌蕊IAA在全开、初萎时期均呈极显著正相关(P<0.01)。初萎时期雌蕊ABA与坐果率呈显著负相关(P<0.05)。外源GA3与油茶坐果率呈正相关,相关性不显著。在试验水平范围内,喷施较低浓度外源GA3可能通过调控不同时期油茶雌蕊内源ABA、ZR、GA3、IAA含量,影响油茶雌蕊内源激素间的平衡,从而降低初萎时期油茶雌蕊ABA含量,进而提高油茶坐果率。
2.3.2 外源GA3与油茶雄蕊内源激素和坐果率的相关性分析 由表3可知:外源GA3与油茶雄蕊ABA在含苞、初萎时期均呈极显著负相关(P<0.01),在全开时期呈极显著正相关(P<0.01);外源GA3与油茶雄蕊ZR在含苞时期呈显著正相关(P<0.05),在半开时期呈极显著负相关(P<0.01),在初萎时期呈极显著正相关(P<0.01);外源GA3与油茶雄蕊GA3在含苞、半开时期呈极显著正相关(P<0.01),在全开时期呈显著正相关(P<0.05);外源GA3与油茶雄蕊IAA在含苞、半开与全开时期均呈极显著负相关(P<0.01),在初萎时期呈极显著正相关(P<0.01)。

表 2 外源GA3与油茶雌蕊内源激素和坐果率的相关性分析Table 2 Correlation analysis between exogenous GA3 and pistil endogenous hormones,fruit setting rate of C. oleifera
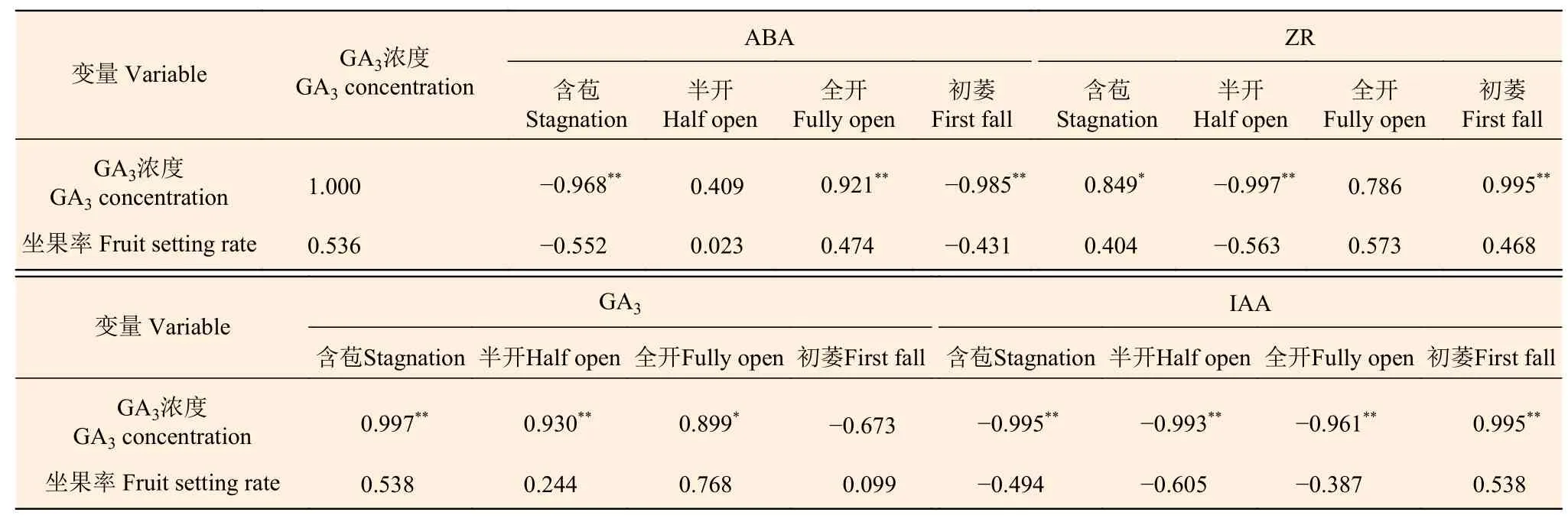
表 3 外源GA3与油茶雄蕊内源激素和坐果率的相关性分析Table 3 Correlation analysis between exogenous GA3 and stamen endogenous hormones, fruit setting rate of C. oleifera
3 讨论
赤霉素是一种重要的植物激素,在种子萌发、茎杆伸长、花粉成熟、开花诱导和花器官发育等方面具有重要作用[20-22]。开花作为植物由营养生长向生殖生长转变的关键环节,受光周期途径、春化途径、自主途径、环境温度途径以及赤霉素途径等多种途径调控[23]。已有研究证实,喷施低浓度的GA3对提高植物坐果率具有促进作用,如喷施浓度过大,易造成果实日灼、采前落果和耐贮性降低等问题[24-27]。本研究表明:在试验水平范围内,油茶花期喷施低浓度外源GA3有利于提高油茶坐果率;提高油茶坐果率的外源GA3最佳喷施浓度为66.69 mg·L-1。这与杜研[28]、董胜利等[29]的研究结果相似。
外源激素通过改变植物IAA、ABA、GA3、ZR等内源激素含量,影响内源激素间的平衡来调节自身的代谢水平,从而影响植株的开花和坐果[30]。脱落酸含量的升高将会加速植物果实离层的产生,从而导致植物果实的衰老脱落[31]。细胞分裂素可促进植物坐果和果实发育[6],生长素恰恰对离区水解酶含量的升高有抑制作用[32-33]。赤霉素作为植物内源激素与植物成花息息相关,具有促进细胞伸长,加速生长和发育,使作物提早成熟,减少器官脱落,提高果实的结实率等作用[34-35]。已有研究报道,喷施外源GA3使杜鹃(Rhododendron hybridum Planch)内源GA3含量上升[36-37];于冬枣(Zizyphus jujuba Mill. cv. Dongzao)花期喷施外源GA3可提高树体内GA3、IAA与ZR的含量。本研究表明:油茶花期喷施 100 mg·L-1外源 GA3使油茶雌蕊ABA含量降低,这与吴建明等[38]喷施外源GA3降低甘蔗(Saccharum officinarum)幼茎的内源ABA含量的研究结果相似;于油茶花期喷施100 mg·L-1外源GA3使油茶雌蕊GA3含量升高,与陈显[39]喷施低浓度的外源GA3可提高油茶内源GA3含量的研究结果相似。于油茶花期喷施100 mg·L-1外源GA3使油茶雌蕊ZR含量升高,IAA含量先降低后升高,这与李田等[40]研究结果相似,而内源IAA含量降低可能与油茶花苞片的脱落有关。油茶花期喷施100 mg·L-1外源GA3使雄蕊内源ABA含量先升高后降低,ZR、GA3含量升高,IAA含量先降低后升高,其中,内源ABA含量先升高后下降,这可能是由于随着油茶花的开放,雄蕊逐渐脱落造成的。由此可知,油茶花期喷施100 mg·L-1的外源GA3可能通过调节油茶花器官的内源激素含量,进而影响油茶坐果率。本研究通过对试验各测定指标进行相关性分析得出,100 mg·L-1的外源GA3可能通过调控油茶雌蕊内源激素ZR、IAA、ABA、GA3间的平衡来降低油茶初萎时期雌蕊的ABA含量,进而提高油茶坐果率,这与前述推论相印证。此外,油茶雄蕊各内源激素与坐果率相关性均不显著,这可能是由于油茶雄蕊在开花后期脱落造成的,而油茶雌雄蕊间内源激素的关系还有待进一步研究。本文仅对外源GA3对油茶开花过程中花器官内源激素与坐果率的影响进行初步研究,而外源GA3对油茶花器官其它内含物质是否存在影响还有待进一步试验和探讨。
4 结论
本研究表明:在试验水平范围内,喷施低浓度外源GA3有利于提高油茶坐果率,提高油茶坐果率的外源GA3最佳喷施浓度为66.69 mg·L-1。油茶花期喷施低浓度的外源GA3使油茶雌蕊内源ABA含量降低,GA3含量升高,ZR含量升高,IAA含量先降低后升高,雄蕊内源ABA含量先升高后降低,ZR、GA3含量升高,IAA含量先降低后升高。通过相关性分析可知,在试验水平范围内,喷施低浓度外源GA3可能通过调节油茶花器官内源ZR、IAA、ABA、GA3含量来影响其ABA含量,进而影响油茶坐果率。
