磁化处理促进施氮条件下葡萄氮素的代谢和分布*
2020-04-08孔令刚张志浩毕思圣凌春辉王华田马风云刘秀梅陈淑英丛桂芝
朱 红, 孔令刚, 张志浩, 毕思圣, 凌春辉, 韦 业, 颜 攀, 王华田, 马风云, 刘秀梅, 唐 金, 陈淑英, 丛桂芝
磁化处理促进施氮条件下葡萄氮素的代谢和分布*
朱 红1,2, 孔令刚3, 张志浩1, 毕思圣1, 凌春辉1, 韦 业1, 颜 攀1, 王华田1, 马风云1, 刘秀梅4**, 唐 金5, 陈淑英5, 丛桂芝5
(1. 黄河下游森林培育国家林业和草原局重点实验室 泰安 271018; 2. 山东农业大学植物保护学院 泰安 271018; 3. 济南市林业科技推广站 济南 250000; 4. 上海市环境学校 上海 200135; 5. 伊犁州林业科学研究院 伊宁 835000)
以‘夏黑’葡萄扦插苗为试验材料, 采用盆栽试验方法, 分析了磁化水灌溉后葡萄叶片、茎和根系中不同形态氮素含量、氮素代谢关键酶活性以及不同氮源的贡献率, 探讨磁化作用对‘夏黑’葡萄扦插苗生长以及氮素吸收、分配和利用的影响。以15N为外源氮肥, 分3次施入土壤中。试验设置4个处理, 包括: 磁化水灌溉处理、非磁化水灌溉处理、磁化水灌溉+施氮处理、非磁化水灌溉+施氮处理。磁化处理组中利用磁化装置处理灌溉水。结果表明: 1)施氮条件下, 与非磁化处理相比, 磁化处理后葡萄叶片、根系和全株的全氮量提高, 但是肥料中15N对不同器官中氮素的贡献率无显著差异; 叶片和根系的氮素利用率显著提高; 全氮在叶片中分配率显著提高, 在茎中的分配率则显著降低。2)与非磁化处理相比, 磁化处理后葡萄叶片中谷氨酰胺合成酶和谷氨酸合酶活性显著提高, 根系中显著降低。3)与单独施氮相比, 磁化水灌溉+施氮提高了土壤氮含量; 氮肥中15N利用率提高, 损失率降低。由以上研究结果可以看出, 磁化水灌溉不仅可提高氮素代谢关键酶活性, 而且可提高不同器官中氮素营养的吸收和利用, 从而改变了氮素在不同器官中的分布。
磁化处理; 氮素代谢; 氮素利用效率; 营养分布; ‘夏黑’葡萄

1 材料与方法
1.1 试验材料
磁化处理和施氮试验于2016年3—9月进行。试验材料为1年生‘夏黑’葡萄扦插苗, 于3月下旬选地径(0.95±0.05) cm、茎高25 cm、长势一致、无病虫害的植株于陶土盆(规格为上口径30 cm、下口径24 cm、高26 cm)中栽植, 每盆1株。试验土壤为壤质土, 每盆装土14 kg。6月下旬移入遮雨棚中, 对扦插苗进行统一抹芽以及病虫害防治等田间管理措施。7月28日选取长势一致的苗木进行试验处理。
1.2 试验设计
施氮处理选用15N标记尿素(上海化工研究院生产, 丰度为10.22%)。尿素施入量为3.0 g·株-1; 灌溉处理开始时, 氮肥随灌溉水源进入土壤, 尿素分3次施入, 间隔10 d。采用磁化装置(U050, Magnetic Technologies, L.L.C.)处理灌溉水源。共4个处理, 分别为: 磁化水灌溉处理(M0)、非磁化水灌溉处理(NM0)、磁化水灌溉+施氮处理(MN)、非磁化水灌溉+施氮处理(NMN)。采用随机区组试验设计, 5盆为一小区, 3次重复。每7 d灌溉处理1次, 每盆灌水1 000 mL。
9月上旬试验结束后, 对葡萄植株进行收获处理, 同时采集根系分布层土壤(0~10 cm), 去除根系和杂物, 风干过筛, 等量均匀混合后用于测定土壤氮素含量。
1.3 指标测定和计算方法
1.3.1 全氮含量和15N丰度测定以及计算方法
称取风干土样0.5 g于消煮管中, 采用H2SO4-H2O2消煮至内容物为透明色后, 采用凯氏定氮法测定土壤全氮含量[11]。
收获时(9月上旬), 每小区选取3盆长势均匀一致的植株, 重复3次, 全株取出带回实验室。植株解析为根系、茎、叶片3部分。选取一部分样品按照清水→洗涤剂→清水→1%盐酸→3次去离子水的顺序冲洗样品[12], 用纱布将样品表面水分擦干, 105 ℃杀青30 min后, 85 ℃烘干至恒重, 粉碎后过60目筛, 混合均匀后备用。
称取一定量烘干后的植物样品, 用Flash 2000 HT同位素比质谱仪(美产)联用元素分析仪(Thermo Scientific Flash 2000 HT; Thermo Fisher)进行全氮含量测定。用CNOHS同位素质谱仪(Isotope Ratio Mass Spectrometer; DETAV Advantage; Thermo Fisher)进行15N丰度的测定, 并通过植物根系、茎和叶片中15N丰度、全氮含量以及生物量计算以下参数:
各器官(根系、茎、叶片)全氮量(g)=各器官(根茎、叶片)全氮含量(%)×各器官生物量(g) (1)
植株全氮量(g)=根系全氮量(g)+茎全氮量(g)+叶片全氮量(g) (2)
15N原子百分超=样品中15N丰度-自然丰 (3)
肥料15N量对各器官全氮的贡献率(Ndff, %)=(样品15N丰度-自然丰度)/(肥料15N丰度-自然丰度)×100 (4)
土壤氮对各器官全氮的贡献率(Ndfs, %)= 1-Ndff (5)
各器官全氮量中来自肥料的15N量(g)=各器官Ndff×各器官全氮量(g) (6)
各器官全氮量中来自土壤的氮量(g)=植株各器官Ndfs×各器官全氮量(g) (7)
植株全氮量中来自氮肥的15N量(g)=叶片全氮中来自氮肥的15N量(g)+茎全氮中来自氮肥的15N量(g)+根系全氮中来自氮肥的15N量(g) (8)
植株全氮量中来自土壤的氮量(g)=叶片全氮中来自土壤的氮量(g)+茎全氮中来自土壤的氮量(g)+根系全氮中来自土壤的氮量(g) (9)
各器官的氮素分配率(%)=各器官全氮量(g)/植株全氮量(g) (10)
各器官肥料15N的分配率(%)=各器官来自肥料的15N量(g)/植株来自肥料的15N量(g) (11)
各器官土壤氮的分配率(%)=各器官来自土壤的氮量(g)/植株来自土壤的氮量(g) (12)
植株各器官的氮肥利用率(%)=植物各器官中15N吸收量(g)/肥料的15N施入量(g)=[各器官氮含量(%)×各器官生物量(g)×各器官15N原子百分超]/[施肥量(g)×肥料含氮量(%)×肥料15N原子百分超] (13)
肥料15N的利用率(%)=植株全氮中来自氮肥的15N量(g)/肥料的15N施用量(g) (14)
肥料15N的残留率(%)=土壤全氮量(g)×土壤Ndff(%)/肥料的15N施用量(g) (15)
肥料15N的回收率(%)=肥料15N的利用率(%)+肥料15N的残留率(%) (16)
肥料15N的损失率(%)=1-肥料15N的回收率 (17)
式中:15N自然丰度为0.366%。
1941年4月4日,熊式辉向蒋介石进言:“领袖只宜以思想领导干部,功名利禄,只能奔走一般中下之士,凡为革命奋斗冒险犯难而不辞者,皆思想上信仰力之驱使,故把握正确的思想路线是第一要务。”㊾实则亦是针对蒋以功名利禄笼络干部的做法提出的改进意见。
1.3.2 葡萄氮代谢酶活性的测定
葡萄植株收获后, 分别采集幼嫩根系和叶片50 g, 重复3次, 蒸馏水清洗, 纱布擦干后, 置于-80 ℃保存, 用于氮素关键酶活性测定。硝酸还原酶(nitrate reductase, NR)活性测定参照李忠光等[13]的试验方法; 亚硝酸还原酶(nitrite reductase, NiR)活性测定参照Martínez-Espinosa等[14]的试验方法; 谷氨酰胺合成酶(glutamine synthetase, GS)活性测定参照Fedorova等[15]的试验方法; 谷氨酸合酶(glutamic synthase, GOGAT)活性测定参照Cordovilla等[16-17]的试验方法。
1.4 数据处理
用SAS 9.0软件进行统计分析。采用单因素方差分析(One-way ANOVA)进行差异显著性检验(α=0.05); 采用Duncan新复极差法进行多重比较。采用Excel 2013进行数据整理和作图。
2 结果与分析
2.1 磁化处理和施氮条件下葡萄体内全氮含量的变化
施氮后葡萄各器官和全株全氮量提高, 且处理间总体呈显著差异水平(表1)。其中, 与NM0处理相比, NMN处理葡萄叶片、茎、根系和全株全氮含量提高30.25%~106.28%; MN处理比M0处理提高7.09%~52.33%, 茎全氮含量的提高未达显著水平。与非磁化处理相比, 磁化处理后植株各器官和全株的全氮量提高, 其中M0比NM0处理葡萄叶片、茎、根系和全株全氮含量提高21.12%~315.58%, MN处理较NMN处理, 葡萄叶片、根系和全株全氮含量显著提高58.47%~191.35%, 而茎中全氮含量无明显差异。
从氮源角度分析, 施氮后磁化处理显著提高了葡萄各器官中来自肥料供应的全氮量, 其中与NMN相比, NM处理下葡萄叶片、茎、根系和全株全氮含量提高5.45%~184.23%。而从植株中来自土壤的全氮量分析可知, 施氮条件下葡萄叶片、根系和全株从土壤中吸收累积的全氮量均显著提高, NMN较NM0提高28.22%~50.50%, 茎中全氮量无显著差异。磁化处理下, 与M0相比, MN处理叶片、根系和全株全氮量提高6.47%~17.57%, 茎中全氮量显著降低19.12%。与非磁化处理相比, 磁化处理后葡萄叶片、根系和全株从土壤中吸收累积的全氮量显著提高56.88%~315.58%; 但是, 施氮后茎中全氮量的提高幅度降低。
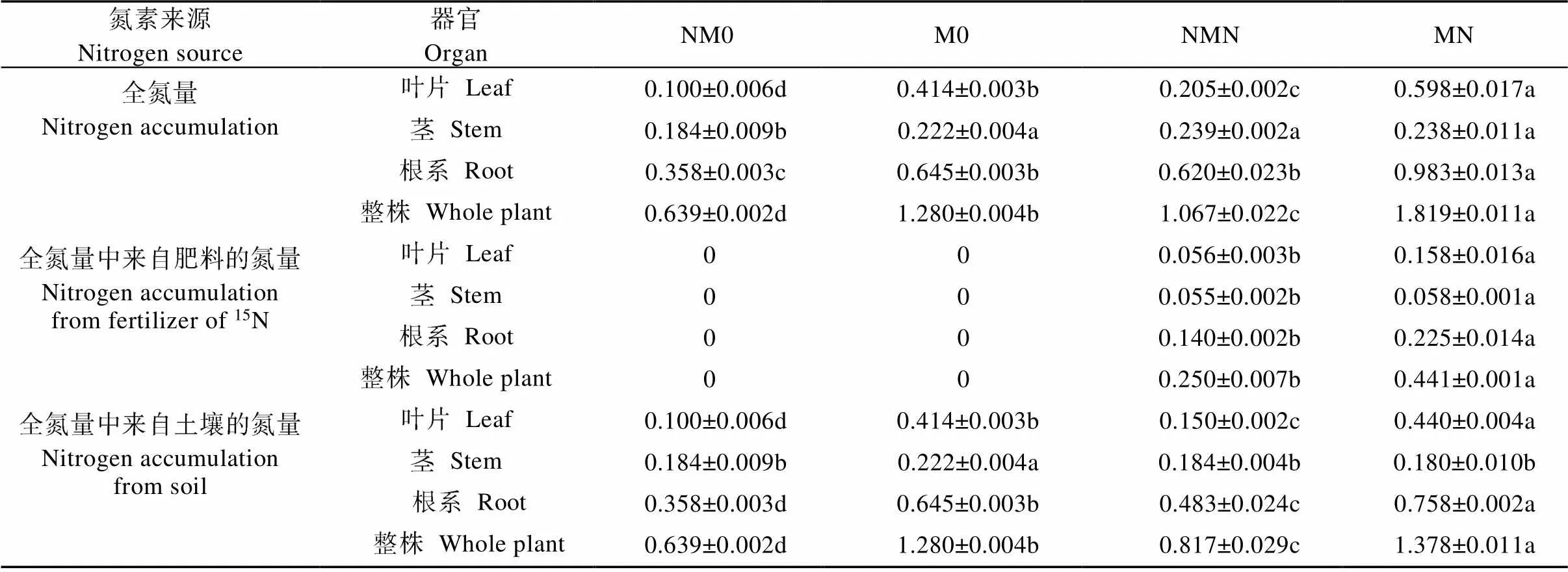
表1 磁化和非磁化水灌溉对施氮条件下葡萄不同器官中全氮量的影响
0: 磁化水灌溉+未施氮处理; NM0: 非磁化水灌溉+未施氮处理; MN: 磁化水灌溉+施氮处理; NMN: 非磁化水灌溉+施氮处理。表中同行不同小写字母表示处理间差异显著(<0.05)。M0: treatment of magnetized water irrigation without nitrogen fertilization; NM0: treatment of non-magnetized water irrigation without nitrogen fertilization; MN: treatment of magnetized water irrigation with nitrogen fertilization; NMN: treatment of non-magnetized water irrigation with nitrogen fertilization. Different lowercase letters in the same row indicate significant differences among four treatments at< 0.05 level.
2.2 磁化处理和施氮条件下葡萄的氮素吸收、分配及利用
15N对植株全氮含量的贡献率(Ndff)和土壤中氮量对植株全氮含量的贡献率(Ndfs)在葡萄不同器官中表现有所差异。其中, Ndff表现为叶>茎>根, 土壤氮素贡献率Ndfs则与Ndff表现相反(表2)。施氮条件下, 磁化处理对葡萄各器官中Ndff和Ndfs的影响不显著。氮肥利用率是植物体内全氮量中氮肥供应部分占施氮量的比例。与非磁化处理相比, 磁化处理下葡萄叶片和根系的氮肥利用率显著提高61.42%~184.71%。
2.3 磁化处理和施氮条件下葡萄不同器官中氮素分配率的变化
葡萄体内的氮素主要源于土壤, 因而各器官中来自土壤的氮素分配率与全氮分配率基本一致(表3)。较非施氮处理相比, 施氮后葡萄根系氮素分配率提高4.55%~7.32%, 茎中氮素分配率则下降21.76%~24.67%, 且不同处理间差异显著。叶片氮素分配率变化在磁化与非磁化处理间存在差异, 其中NMN较NM0相比, 叶片氮素分配率显著提高23.84%, MN较M0则差异不显著。这表明氮素供应水平影响了葡萄各器官间的氮素分配, 施氮处理提高葡萄叶片和根系对氮素的征调能力, 而降低了茎的分配比率。与非磁化处理相比, 磁化水灌溉植株叶片全氮分配率提高70.65%~107.53%(<0.05); 茎和根系中降低7.28%~41.76%(<0.05)。
施氮条件下, 来自不同氮源中氮素的分配率在葡萄叶片和根系中存在差异(表3)。较未施氮处理相比,15N在葡萄叶片和根系中的分配率分别提高22.12%~35.75%、51.04%~55.86%; 以土壤为氮源的氮素在葡萄叶片、根系中的分配率分别提高18.41%~31.96%、55.01%~59.01。可见与土壤相比, 外源氮肥所供给的氮素较少分配给根系, 而是更多地被叶片吸收。与土壤中氮素分配率相似的是, 磁化水灌溉同样改变了葡萄茎和叶片间的15N分配, 主要表现为, 与NMN相比, MN处理后叶片氮素分配率显著提高, 茎分配率则显著降低。
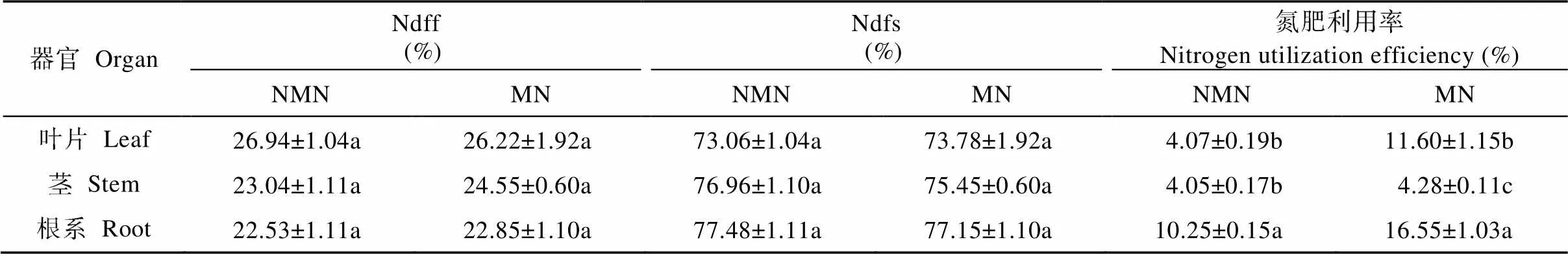
表2 磁化和非磁化水灌溉对施氮条件下葡萄各器官中不同氮素来源对全氮量的贡献率及氮肥利用率的影响
Ndff: 肥料氮对葡萄全氮的贡献率; Ndfs: 土壤氮对葡萄全氮的贡献率。MN: 磁化水灌溉+施氮处理; NMN: 非磁化水灌溉+施氮处理。同行不同小写字母表示处理间差异显著(<0.05)。Ndff: contribution rate of fertilizer nitrogen to grapevine nitrogen; Ndfs: contribution of soil nitrogen to grapevine nitrogen. MN: treatment of magnetized water irrigation with nitrogen fertilization; NMN: treatment of non-magnetized water irrigation with nitrogen fertilization. Different lowercase letters in the same row indicate significant differences among four treatments at< 0.05 level.

表3 磁化和非磁化水灌溉对施氮条件下葡萄各器官中氮素分配率的影响
M0: 磁化水灌溉+未施氮处理; NM0: 非磁化水灌溉+未施氮处理; MN: 磁化水灌溉+施氮处理; NMN: 非磁化水灌溉+施氮处理。同行不同小写字母表示不同处理间差异显著(<0.05)。M0: treatment of magnetized water irrigation without nitrogen fertilization; NM0: treatment of non-magnetized water irrigation without nitrogen fertilization; MN: treatment of magnetized water irrigation with nitrogen fertilization; NMN: treatment of non-magnetized water irrigation with nitrogen fertilization. Different lowercase letters in the same row indicate significant differences among four treatments at< 0.05 level.
2.4 磁化处理和施氮条件下代谢酶活性变化
如图1A、图1B所示, 不同处理葡萄叶片中硝酸还原酶(NR)活性始终高于根系, 且处理间根系NR活性无显著差异。施氮处理下葡萄叶片中的NR活性较非施氮处理提高15.57%~27.46%; 同浓度氮素环境下, 磁化处理植株叶片中NR活性较非磁化处理提高41.04%~55.55%, 且差异显著。
图1C、图1D施氮和磁化处理均显著提高了葡萄叶片和根系中的亚硝酸还原酶(NiR)活性, 且对根系的提高幅度远大于叶片。施氮处理对葡萄叶、根中NiR活性的影响在磁化和非磁化处理条件下表现相反; 其中与NM0处理相比, NMN处理叶片、根系中NiR活性显著提高5.72%~90.58%; MN比M0处理叶片和根系中NiR活性则显著降低2.85%~11.15%。施氮条件下, 磁化处理对葡萄叶片、根系中NiR活性的影响也存在差异; M0处理比NM0处理葡萄叶片、根系中NiR活性提高25.06%~102.31%; 施氮条件下MN比NMN处理葡萄叶片NiR活性提高14.92%, 根中降低5.68%, 且均呈显著差异。
如图1E、图1F所示, 磁化处理下葡萄叶片和根系的谷氨酰胺合成酶(GS)活性发生了显著变化。其中非磁化处理下, 葡萄根系中GS活性明显高于叶片; 磁化处理下植株叶片、根系GS活性水平表现相反。磁化与非磁化处理相比, 施氮对葡萄体内GS活性的影响存在差异; 其中非磁化条件下NMN处理较NM0处理葡萄叶片和根系中GS活性显著提高11.75%~22.77%; 磁化条件下MN处理比M0处理葡萄叶片和根系GS活性则显著降低7.63%~21.40%。相同氮处理下, 与非磁化处理相比, 磁化处理植株叶片GS活性显著提高, 根系GS活性显著降低; 其中M0处理比NM0处理叶片GS活性提高94.96%, 根系则降低25.92%; MN处理较NMN处理叶片GS活性提高61.15%, 根系降低52.57%。
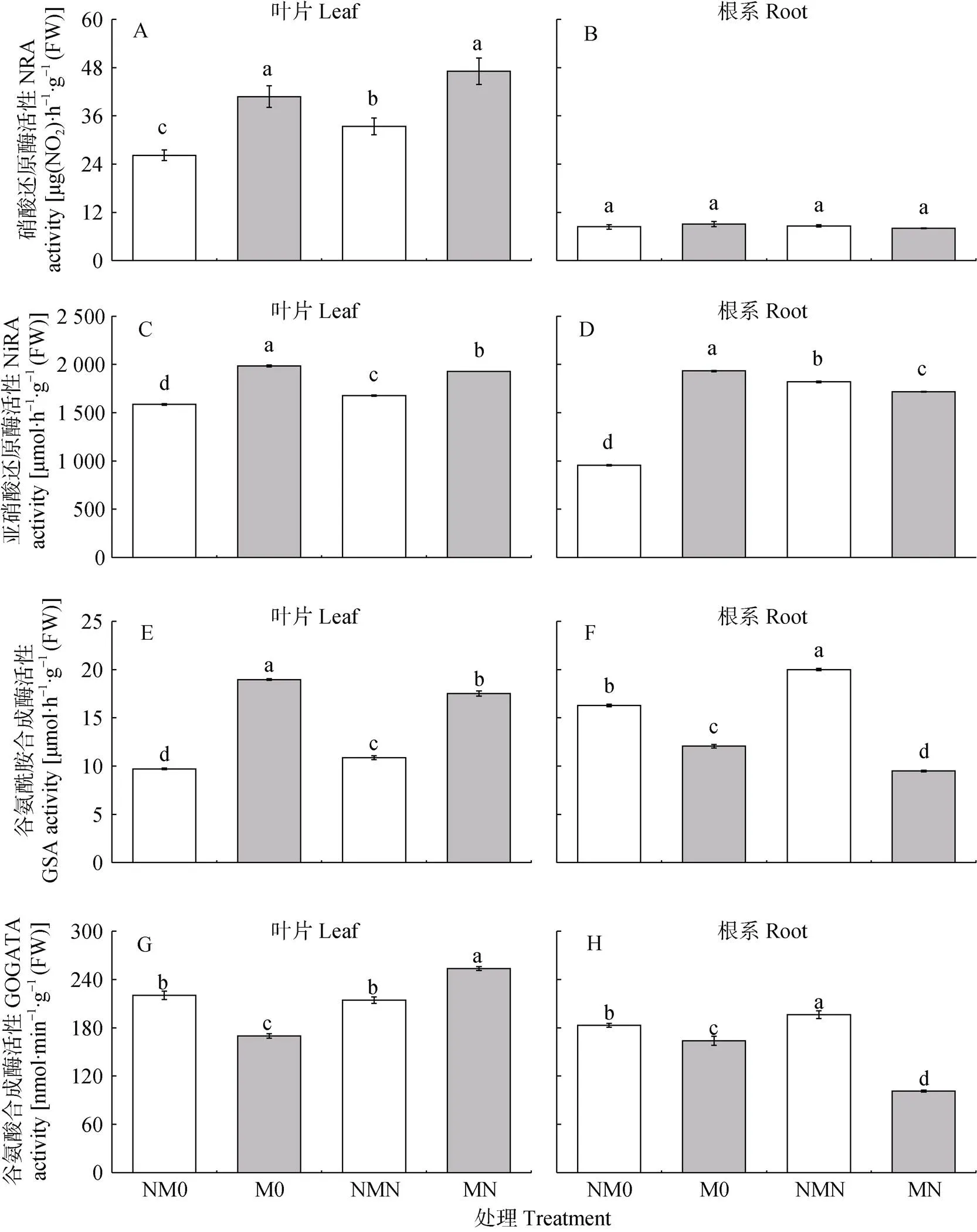
图1 磁化和非磁化水灌溉对施氮条件下葡萄氮代谢酶活性的影响
M0: 磁化水灌溉+未施氮处理; NM0: 非磁化水灌溉+未施氮处理; MN: 磁化水灌溉+施氮处理; NMN: 非磁化水灌溉+施氮处理。不同小写字母表示处理间差异显著(<0.05)。M0: management of magnetized water irrigation without nitrogen fertilization; NM0: treatment of non-magnetized water irrigation without nitrogen fertilization; MN: treatment of magnetized water irrigation with nitrogen fertilization; NMN: treatment of non-magnetized water irrigation with nitrogen fertilization. NRA: nitrate reductase; NiRA: nitrite reductase; GSA: glutamine synthetase; GOGATA: glutamate synthetase. Different lowercase letters show significant differences among four treatments at< 0.05 level.
如图1G、图1H所示, 与GS活性相似, 磁化与非磁化处理条件下, 施氮对葡萄体内谷氨酸合成酶(GOGAT)活性的影响同样存在差异; 其中非磁化条件下NMN处理与NM0相比, 葡萄叶片中GOGAT活性无明显差异, 根系中GOGAT活性显著提高7.36%(<0.05); 磁化条件下MN处理较M0处理叶片中GOGAT活性显著提高49.31%, 根系显著降低38.22%。磁化处理对葡萄GOGAT活性的影响于施氮后有明显变化。M0处理较NM0处理葡萄叶片、根系中GOGAT活性显著降低, 分别降低22.94%和10.45%; 施氮条件下MN处理比NMN处理葡萄叶中GOGAT活性显著提高18.27%, 根系中显著降低48.46%。
2.5 磁化处理和施氮条件下土壤中氮肥去向
由表4可知, 施氮处理提高了土壤全氮量, 其中NMN处理较NM0处理提高11.26%, MN处理较M0处理提高11.85%, 磁化处理下施氮对土壤全氮量的提高幅度达显著水平。磁化处理组土壤全氮量均高于非磁化处理组, 其中M0处理较NM0处理提高2.49%, MN处理较NMN处理提高3.03%。表明磁化水灌溉有利于土壤供氮水平的提高。磁化处理显著提高了肥料中氮素的利用率、残留率和回收率, 显著降低肥料中氮素的损失率。MN处理后土壤中肥料15N的利用率、残留率和回收率较NMN处理分别提高76.50%、36.39%和55.31%,15N损失率降低了35.33%

表4 磁化和非磁化处理对土壤中全氮量和肥料15N去向的影响
M0: 磁化水灌溉+未施氮处理; NM0: 非磁化水灌溉+未施氮处理; MN: 磁化水灌溉+施氮处理; NMN: 非磁化水灌溉+施氮处理。同列不同小写字母表示处理间差异显著(<0.05)。M0: treatment of magnetized water irrigation without nitrogen fertilization; NM0: treatment of non-magnetized water irrigation without nitrogen fertilization; MN: treatment of magnetized water irrigation with nitrogen fertilization; NMN: treatment of non-magnetized water irrigation with nitrogen fertilization. Different lowercase letters in the same column indicate significant differences among four treatments at< 0.05 level.
3 讨论
3.1 磁化水灌溉对施氮条件下葡萄氮素吸收、利用、分配和氮代谢的影响
氮素营养和氮素分配不仅影响植物的生长潜力, 同时也决定了植物的物质生产力[18]。研究发现, 施氮处理和磁化水灌溉均有效提高了葡萄各器官的全氮量, 表明磁化水灌溉改善了土壤的供氮水平, 促进了葡萄的氮素吸收。另外, 磁化水灌溉后提高了葡萄植株各器官对氮素的吸收水平, 这是由于磁化水灌溉提高了土壤的持水力, 促进了土壤中养分的溶解和运输, 进而提高了葡萄的水肥吸收效率[19-20]。施氮条件下, 磁化水灌溉显著提高了葡萄叶片、根系和全株全氮量, 但提高幅度均小于非磁化处理, 且茎、根系中氮含量降低。这是由于, 首先, 单独磁化水灌溉显著提高了葡萄的氮累积量, 而葡萄对氮素的营养利用水平存在阈值, 所以磁化处理和施氮处理共同作用下有利于葡萄生长, 但增施氮肥对葡萄生长的影响作用有所降低[21]; 其次, 磁化水灌溉后葡萄体内的氮素运输和氮代谢加速, 促使葡萄能够高效利用所吸收的氮素, 同时改变了氮素在不同器官中的分配格局[22]。
从氮源角度分析, 施氮条件下葡萄对氮素的吸收以土壤氮素为主, 外施氮源为辅, 分别占葡萄体内全氮量的75%和25%左右, 且两者在葡萄体内的分布存在细微的差异; 土壤氮素在根系中分配比例较高, 外施氮素则更多在叶片富集, 这与氮素形态差异导致的代谢途径不同有关[23]。而磁化水灌溉并未影响氮肥对葡萄体内氮素累积的贡献度(Ndff), 表明磁化处理下葡萄氮素利用能力的提高, 可能与氮肥形态差异无直接关系。施氮处理和磁化水灌溉均提高了葡萄叶片、根系的氮素分配率(包含来自土壤和肥料的氮素吸收), 而对茎的氮素分配影响降低, 两者提高幅度表现为叶>根, 这与汪新颖等[24]的研究结果一致。表明氮素将优先向叶片和根系富集, 构建良好的冠—根形态是葡萄提高自身生长能力和养分利用效率的重要策略。而施氮条件下磁化水灌溉植株叶片和根系氮素利用率显著提高, 且全氮含量在叶片的分配率显著提高, 茎中显著降低, 表明磁化水灌溉能够进一步提高葡萄叶片和根系对体内氮素的征调能力, 优化了葡萄物质分配格局, 为葡萄对氮肥的高效利用提供了良好基础。
3.2 磁化水灌溉对施氮条件下土壤中氮肥去向的影响
氮肥的有效性不仅受限于在植物的吸收效率, 同时也受土壤固氮能力的影响。氮肥施入土壤后通过转化成为土壤氮库的一部分进入土壤-植物氮循环中, 部分被植物吸收, 但仍有大量的氮素矿化、分解后被土壤微生物固定下来成为潜在氮源, 两者共同构成植物的氮源。而当外源氮素输入超出土壤负荷时, 过量氮肥就会通过径流、淋溶、氨挥发及硝化反硝化等途径的损失, 造成环境污染[30]。也有研究认为生态系统中氮的临界负荷值高低与水分含量的高低有关[31]。施氮条件下, 磁化水灌溉提高了土壤全氮量, 表明磁化水灌溉有效提高了土壤的养分供应能力。而对施入土壤的氮肥去向分析发现, 肥料15N的利用率为18.37%~32.43%, 回收率为38.98%~60.54%, 损失率为61.02%~39.46%。磁化处理显著提高了肥料中氮素的利用率、残留率和回收率, 显著降低了氮素损失率。表明磁化处理能够提高土壤中氮素的有效性, 同时改善土壤胶体对氮素的固持能力, 有效避免了氮素损失造成的浪费和环境污染。这与刘秀梅等[32]之前对欧美杨的研究结果一致。主要原因在于磁化水灌溉能够促进土壤的矿化能力, 改善土壤结构; 同时, 磁化水灌溉下土壤持水力和养分运移速率提高, 能够快速地将肥料中的氮素淋溶进植物的细根分布区, 从而达到根层施肥的效果, 提高植物的氮素利用率, 有效避免土壤浅层氮肥以氨挥发的形式散失。
4 结论
通过对磁化和非磁化水灌溉后对施氮条件下葡萄不同器官中氮素含量、氮素利用率以及氮素代谢关键酶活性的影响发现:
1)外源施氮条件下, 磁化水灌溉促进了葡萄对氮素的吸收, 显著提高了葡萄叶片的氮含量和叶片、根系、全株中的氮素累积及叶片、根系的氮素利用率; 改变了氮素在葡萄不同器官中的分布。
2)磁化水灌溉显著提高了葡萄叶片中GS、GOGAT活性, 改善了葡萄叶片的氮素同化能力, 并将氮代谢的主要器官由根系变为叶片。
3)磁化水灌溉能够有效提高葡萄对氮肥的利用效率和土壤的固氮能力。
[1] 陆景陵. 植物营养学[M]. 第2版. 北京: 中国农业出版社, 2003 LU J L. Plant Nutriology[M]. 2nd ed. Beijing: Chinese Agricultural Press, 2003
[2] CORUZZI G, LAST R. Amino acids[M]//BUCHANAN B B, GRUISSEM W, JONES R L. Biochemistry and Molecular Biology of Plants. Rockville: Wiley & Sons, 2000: 370–371

[4] 钱晓晴, 王娟娟, 周明耀, 等. 不同水、氮供应条件下水稻锰素营养状况研究[J]. 作物学报, 2006, 32(11): 1689–1694 QIAN X Q, WANG J J, ZHOU M Y, et al. Characteristics of manganese nutrition of rice (L.) cultivated under different water and nitrogen management conditions[J]. Acta Agronomica Sinica, 2006, 32(11): 1689–1694
[5] 樊卫国, 刘进平, 向灵, 等. 不同形态氮素对刺梨生长发育的影响[J]. 园艺学报, 1998, 25(1): 27–32 FAN W G, LIU J P, XIANG L, et al. Effects of nitrogen form on the growth and development of[J]. Acta Horticulturae Sinica, 1998, 25(1): 27–32
[6] 周显骥. 巨峰葡萄施氮技术研究[J]. 湖南农业大学学报, 1999, 25(3): 188–190 ZHOU X J. Studies on application of nitrogen to Jufeng grape[J]. Journal of Hunan Agricultural University, 1999, 25(3): 188–190
[7] 王剑, 李炳锐, 李晓鹏, 等. 利用葡萄氮代谢基因的表达评价不同氮肥肥效[J]. 园艺学报, 2016, 43(1): 1–14 WANG J, LI B R, LI X P, et al. Evaluation of N fertilizers effects based on the expression of N metabolic genes[J]. Acta Horticulturae Sinica, 2016, 43(1): 1–14
[8] 聂百胜, 丁翠, 李祥春, 等. 磁场对矿井水表面张力影响规律的实验研究[J]. 中国矿业大学学报, 2013, 42(1): 19–23 NIE B S, DING C, LI X C, et al. An experimental study of the influence of magnetic field on the surface tension of mine water[J]. Journal of China University of Mining & Technology, 2013, 42(1): 19–23
[9] 王俊花, 邵林生, 宋敏丽, 等. 磁化水对甜玉米增产效果的研究[J]. 玉米科学, 2006, 14(3): 110–111 WANG J H, SHAO L S, SONG M L, et al. Research on effect of increasing production of magnetized water in sweet maize[J]. Journal of Maize Sciences, 2006, 14(3): 110–111
[10] 周敏, 廖淼玲, 郑辉艳, 等. 夏黑无核葡萄肥料效应研究[J]. 中国土壤与肥料, 2015, (6): 87–91 ZHOU M, LIAO M L, ZHENG H Y, et al. Fertilizer effect on summer black seedless grape[J]. Soils and Fertilizers Sciences in China, 2015, (6): 87–91
[11] 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000 BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd ed. Beijing: China Agricultural Press, 2000
[12] 李红波, 姜远茂, 魏绍冲, 等. ‘嘎啦’苹果对一次和分次施入15N-尿素的吸收、分配和利用[J]. 园艺学报, 2011, 38(9): 1727–1732 LI H B, JIANG Y M, WEI S C, et al. Effect of once and split fertilization on characteristics of absorption, distribution and utilization of15N-urea for Gala/[J]. Acta Horticulturae Sinica, 2011, 38(9): 1727–1732
[13] 李忠光, 龚明. 磺胺比色法测定植物组织硝酸还原酶活性的改进[J]. 植物生理学通讯, 2009, 45(1): 67–68 LI Z G, GONG M. Improvement of determination of nitrate reductase activity in plant tissues by sulfa colorimetry[J]. Plant Physiology Communications, 2009, 45(1): 67–68
[14] MARTÍNEZ-ESPINOSA R M, MARHUENDA-EGEA F C, BONETE M J. Purification and characterisation of a possible assimilatory nitrite reductase from the halophile archaeon[J]. FEMS Microbiology Letters, 2001, 196(2): 113–118
[15] FEDOROVA K, KAYUMOV A, WOYDA K, et al. Transcription factor TnrA inhibits the biosynthetic activity of glutamine synthetase in[J]. FEBS Letters, 2013, 587(9): 1293–1298
[16] CORDOVILLA M D P, PÉREZ J, LIGERO F, et al. Partial purification and characterization of NADH-glutamate synthase from faba bean () root nodules[J]. Plant Science, 2000, 150(2): 121–128
[17] ROBINSON S A, SLADE A P, FOX G G, et al. The role of glutamate dehydrogenase in plant nitrogen metabolism[J]. Plant Physiology, 1991, 95(2): 509–516
[18] SCHIEFELBEIN J W, BENFEY P N. The development of plant roots: New approaches to underground problems[J]. The Plant Cell, 1991, 3(11): 1147–1154
[19] 周胜, 张瑞喜, 褚贵新, 等. 磁化水在农业上的应用[J]. 农业工程, 2012, 2(6): 44–48 ZHOU S, ZHANG R X, CHU G X, et al. Effects of magnetized water in agriculture[J]. Agricultural Engineering, 2012, 2(6): 44–48
[20] SURENDRAN U, SANDEEP O, MAMMEN G, et al. A novel technique of magnetic treatment of saline and hard water for irrigation and its impact on cow pea growth and water properties[J]. International Journal of Agriculture Environment and Biotechnology, 2013, 6(1): 85–92
[21] 葛顺峰, 姜远茂, 魏绍冲, 等. 不同供氮水平下幼龄苹果园氮素去向初探[J]. 植物营养与肥料学报, 2011, 17(4): 949–955 GE S F, JIANG Y M, WEI S C, et al. Nitrogen balance under different nitrogen application rates in young apple orchards[J]. Plant Nutrition and Fertilizer Science, 2011, 17(4): 949–955
[22] HOAGLAND L, CARPENTER-BOGGS L, GRANATSTEIN D, et al. Orchard floor management effects on nitrogen fertility and soil biological activity in a newly established organic apple orchard[J]. Biology and Fertility of Soils, 2008, 45: 11
[23] 李宝珍, 范晓荣, 徐国华. 植物吸收利用铵态氮和硝态氮的分子调控[J]. 植物生理学通讯, 2009, 45(1): 80–88 LI B Z, FAN X R, XU G H. Molecular regulation for uptake and utilization of ammonium and nitrate in plant[J]. Plant Physiology Communications, 2009, 45(1): 80–88
[24] 汪新颖, 周志霞, 王玉莲, 等. 不同施肥深度红地球葡萄对15N的吸收、分配与利用特性[J]. 植物营养与肥料学报, 2016, 22(3): 776–785 WANG X Y, ZHOU Z X, WANG Y L, et al. Characteristics of absorption, distribution and utilization of15N in red globle grape under fertilizer application in different depths[J]. Journal of Plant Nutrition and Fertilizers, 2016, 22(3): 776–785
[25] MARSCHNERT H, KIRKBY E A, ENGELS C. Importance of cycling and recycling of mineral nutrients within plants for growth and development[J]. Botanica Acta, 1997, 110(4): 265–273
[26] OH K, KATO T, XU H L. Transport of nitrogen assimilation in xylem vessels of green tea plants fed with NH4-N and NO3-N[J]. Pedosphere, 2008, 18(2): 222–226
[27] HUUSKONEN H, LINDBOHM M L, JUUTILAINEN J. Teratogenic and reproductive effects of low-frequency magnetic fields[J]. Mutation Research/Reviews in Mutation Research, 1998, 410(2): 167–183
[28] TABUCHI M, ABIKO T, YAMAYA T. Assimilation of ammonium ions and reutilization of nitrogen in riceL.)[J]. Journal of Experimental Botany, 2007, 58(9): 2319–2327
[29] 孙永健, 孙园园, 蒋明金, 等. 施肥水平对不同氮效率水稻氮素利用特征及产量的影响[J]. 中国农业科学, 2016, 49(24): 4745–4756 SUN Y J, SUN Y Y, JIANG M J, et al. Effects of fertilizer levels on nitrogen utilization characteristics and yield in rice cultivars with different nitrogen use efficiencies[J]. Scientia Agricultura Sinica, 2016, 49(24): 4745–4756
[30] 周伟, 吕腾飞, 杨志平, 等. 氮肥种类及运筹技术调控土壤氮素损失的研究进展[J]. 应用生态学报, 2016, 27(9): 3051–3058 ZHOU W, LV T F, YANG Z P, et al. Research advances on regulating soil nitrogen loss by the type of nitrogen fertilizer and its application strategy[J]. Chinese Journal of Applied Ecology, 2016, 27(9): 3051–3058
[31] 张林海, 曾从盛, 胡伟芳. 氮输入对植物光合固碳的影响研究进展[J]. 生态学报, 2017, 37(1): 147–155 ZHANG L H, ZENG C S, HU W F. Reviews on effects of nitrogen addition on plant photosynthetic carbon fixation[J]. Acta Ecologica Sinica, 2017, 37(1): 147–155
[32] 刘秀梅, 毕思圣, 张新宇, 等. 磁化微咸水灌溉对欧美杨I-107微量元素和碳氮磷养分特征的影响[J]. 生态学报, 2017, 37(20): 6691–6699 LIU X M, BI S S, ZHANG X Y, et al. Effects of magnetized brackish water on the absorption and distribution of microelements, carbon, nitrogen and phosphorus in‘Neva’[J]. Acta Ecologica Sinica, 2017, 37(20): 6691–6699
Effect of applying nitrogen fertilizer on nitrogen metabolism and distribution in grapevine under magnetic treatment of water*
ZHU Hong1,2, KONG Linggang3, ZHANG Zhihao1, BI Sisheng1, LING Chunhui1, WEI Ye1, YAN Pan1, WANG Huatian1, MA Fengyun1, LIU Xiumei4**, TANG Jin5, CHEN Shuying5, CONG Guizhi5
(1. State Forestry and Grassland Administration Key Laboratory of Silviculture in Downstream Areas of the Yellow River, Tai’an 271018, China; 2. College of Plant Protection, Shandong Agricultural University, Tai’an 271018, China; 3. Jinan Extension Station of Forestry Science and Technology, Jinan 250000, China; 4. Shanghai Environment College, Shanghai 200135, China; 5. Yili Academy of Forestry Science, Yining 835000, China)
The aim of this study was to investigate nitrogen (N) absorption and distribution, as well as nitrogen-use efficiency, of grape seedlings grown in magnetic and non-magnetic water treatments. One-year-old grape(×L. hybrid) seedlings were planted in pots and fertilized with exogenous15N, and then grown under different magnetic water treatments or a control (untreated irrigated water). The proportional content of different forms of N, the activities of key enzymes relative to N metabolism, and the fate of N in leaves, stems, and roots of treated grape seedlings were analyzed. Under N application, we found that compared with the non-magnetic treatment (NMT), the magnetic treatment of water (MTW) appeared to promote N uptake and N-use efficiency in treated grape seedlings, while also optimizing the N allocation pattern and improving N assimilation ability of N fertilizer. We also identified that the total content of N in the leaves and roots (and in the plant generally) of treated seedlings were significantly increased when grown in the MTW. Conversely, the degree of contribution by N fertilizer (Ndff) to total N was not significantly different. Notably, the N utilization efficiencies of leaves and roots was significantly increased under MTW compared to that of the NMT treatment. The N allocation rate in leaves showed a marked increase under MTW, while that in stems showed a significant decrease. Additionally, it was found that the activities of glutamine syntheses and glutamic synthase increased significantly in the leaves, but decreased in the roots of treated seedlings. Finally, we identified that MTW increased the N-use efficiency and fixing capacity of plants and, additionally, alleviated the loss of N fertilizer in grape seedlings. Compared with treatments applying N fertilizer, the content of inorganic N and total N were promoted by 3.03%-3.45% in soil when exposed to MTW with N application. The utilization rate, residual rate, and recovery rate of seedlings increased by 36.39%-76.50% under MTW after the addition of15N, and the loss rate of15N decreased significantly (35.33% reduction). Based on our findings, it appears that the magnetic treatment of water can be effective in promoting N absorption and allocation in grape seedlings while also improving the plant fertilizer use efficiency from soil.
Magnetic treatment; Nitrogen metabolism; Nitrogen use efficiency; Nutrient distribution;בSummer Black’

S512; S562
10.13930/j.cnki.cjea.190648
朱红, 孔令刚, 张志浩, 毕思圣, 凌春辉, 韦业, 颜攀, 王华田, 马风云, 刘秀梅, 唐金, 陈淑英, 丛桂芝.磁化处理促进施氮条件下葡萄氮素的代谢和分布[J]. 中国生态农业学报(中英文), 2020, 28(4): 535-544
ZHU H, KONG L G, ZHANG Z H, BI S S, LING C H, WEI Y, YAN P, WANG H T, MA F Y, LIU X M, TANG J, CHEN S Y, CONG G Z. Effect of applying nitrogen fertilizer on nitrogen metabolism and distribution in grapevine under magnetic treatment of water[J]. Chinese Journal of Eco-Agriculture, 2020, 28(4): 535-544
* 山东省农业重大应用技术创新项目(鲁财农指[2016]36号)和国家引进国际先进林业科学技术计划(2011-4-60)资助
刘秀梅, 主要从事林木生理生态以及土壤生态修复研究。E-mail: xiaomi8869@163.com
朱红, 主要从事林木生理生态及氮素循环利用研究。E-mail:meige1988@126.com
2019-09-04
2019-11-28
* The study was supported by the Agricultural Major Application Technology Innovation Program of Shandong Province (Financial and Agricultural Indicators, [2016]36) and the National Program of the International Introduction of Advanced Science and Technology in Forestry of China (948 Program, 2011-4-60).
, E-mail: xiaomi8869@163.com
Sep. 4, 2019;
Nov. 28, 2019
