青钱柳对糖尿病小鼠肝脏糖脂代谢影响及机制研究*
2020-04-06秦灵灵吴丽丽张程斐吴呦呦孙伯菊刘铜华
秦 帅 ,秦灵灵 ,吴丽丽 ,张程斐 ,吴呦呦 ,孙伯菊 ,刘铜华 ,**
(1. 成都中医药大学临床医学院 成都 610036;2. 北京中医药大学教育部中医养生学重点实验室 北京 100029;3. 北京中医药大学东方医院 北京 100078)
2 型糖尿病(Type 2 diabetes mellitus, T2DM)在全球的迅速流行使其成为最严重、最具挑战性的健康问题之一。其中T2DM 占所有糖尿病的90%,其发病的核心病机是胰岛素抵抗(Insulin resistance,IR)和胰岛β细胞功能障碍[1]。IR是一种病理状态,是由于外周组织(如:骨骼肌,肝脏和脂肪)无法有效响应正常的胰岛素循环浓度而引起的。作为全世界最主要的慢性非传染性疾病之一,糖尿病给社会及家庭所带来的疾病负担越来越严重,糖尿病及其并发症严重影响人类的生活及生存质量,如何有效防治2 型糖尿病成为当前研究的热点。
肝脏作为调节机体能量代谢平衡的重要器官之一,在调节机体糖脂代谢平衡中起重要作用,是胰岛素作用的主要靶组织,其在IR 的发生、发展中扮演者重要角色。在生理情况下,胰岛素可通过促进肝脏对葡萄糖的摄取以及调节肝糖原的分解来维持机体血糖的稳定。在病理状态下,特别是肝脏脂肪变性时导致胰岛素抵抗[2,3],胰岛素抑制肝脏糖原分解能力下降,同时对外周葡萄糖的摄取利用减少,肝糖原合成能力减弱,从而导致机体血糖升高。因此,通过调节肝脏糖脂代谢,特别是抑制脂质在肝脏的沉积可改善胰岛素抵抗,进而防治糖尿病。
腺苷酸活化蛋白激酶(AMP activated protein kinase, AMPK)是一种广泛参与多种代谢活动的调节激酶,近年来成为研究糖尿病等代谢疾病的重要作用靶点。相关研究表明AMPK 的激活可抑制肝脏糖异生,减少肝糖原的分解,降低血糖,研究发现AMPK 有α、β、γ三种亚基,其中 AMPK 的β、γ亚基不参与糖脂代谢的调节,而α亚基Thr172 在发生磷酸化后被激活,参与机体能量代谢的调节[4]。过氧化物酶增殖体激 活 受 体γ共 激 蛋 白 1α(Peroxisome proliferatorsactivated receptor-γcoactivator-1α,PGC-1α)能够激活大鼠肝脏和肝细胞糖异生相关基因的表达,观察发现在T2DM 患者肝脏内,PGC-1α蛋白表达增加,PGC-1α可激活肝脏糖异生相关基因的表达,从而增加肝糖原分解促使肝糖的输出量增加,升高血糖[5,6]。
青钱柳作为我国民间广泛饮用的中草药药茶,是核桃科菊属植物。据《中国中药资源志要》记载青钱柳叶具有清热解毒、生津止渴的功效[7,8],民间主要用于防治肥胖、高血脂、高血糖、脂肪肝等慢性代谢性疾病。近年来研究发现青钱柳含多糖、黄酮类、皂苷、三萜等多种生物活性成分[9],具有降血糖[10]、降血脂、降血压等药理作用[11-13]。课题组前期研究发现青钱柳水提物可通过激活胰岛素信号通路抑制过多的能量摄入改善代谢小鼠的肥胖状态[14]。但青钱柳对肝脏糖脂代谢的影响及其机制尚不明确。本研究应用自发性2型糖尿病db/db 小鼠观察青钱柳水提物对肝脏糖脂代谢的影响,并通过检验其对AMPK 及PGC-1α的影响来探讨其作用机制,为青钱柳防治慢性代谢性疾病提供理论依据。
1 材料
1.1 青钱柳水提物制备
青钱柳干叶购自江西修水县醉美农业有限公司(批号:20190914)。由北京中医药大学中药学院徐墩海教授鉴定为青钱柳原叶。提取步骤:1 kg 青钱柳干叶加10 倍水(质量/体积),用沸水浸泡3 次,每次20 min,收集3次浓缩溶液并在真空冷冻器下干燥得干膏(提取率约为16.5%)。放入4℃冰箱备用,应用时取适量粉末溶解于生理盐水。
1.2 实验动物
选雄性SPF级自发性2型糖尿病db/db小鼠30只,4 周龄,体质量(30 ± 2)g,同周龄 C57BL/6J 雄性小鼠10 只,均购自江苏集萃药康生物科技有限公司(动物批号:1908160016)。小鼠饲养于北京中医药大学SPF级动物实验室。饲养环境及条件:温度(24±2)℃,湿度(50± 10)%,12 h/12 h 光黑循环,自由摄食饮水,进食普通饲料。适应性喂养1周后开始灌胃进行后续实验。本实验经北京中医药大学动物实验伦理审查通过。批准编号:BUCM-2019082801-3085。
1.3 试剂及仪器
盐酸二甲双胍片(中美上海施贵宝制药有限公司,批号:ABL9900),葡萄糖(Glucose)测定试剂盒(北京索莱宝公司,批号:BC2505),TG、TC 及FFA 试剂盒(北京华英生物技术研究所);胰岛素放免试剂盒(北京华英生物技术研究,批号:HY-10069);糖原PAS 染色试剂盒(南京建成生物工程研究所);苏木素/伊红(北京索莱宝公司,批号:G1140、G1100),一抗PAMPK 及 PGC-1α(美国 CST 公司,批号:8208、2178);二抗(美国CST 公司,批号:0026),BCA 蛋白定量试剂盒(北京solarbio 公司,批号:PC0020)。3K15/10797/9001678型高速低温离心机(美国Sigma公司),7160型全自动生化仪(日本日立公司),酶标仪(美国Promega公司,型号:E9032),凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 动物分组及给药
准备30 只4 周龄SPF 级雄性自发性2 型糖尿病db/db 小鼠,以 10 只 C57/BLKS/Jdb/m 同窝雄性小鼠作为正常对照组(Normal 组)。饲养于北京中医药大学动物实验中心。当非同日连续2 次测随机血糖≥11.1 mmol·L-1作为2 型糖尿病成模条件,并根据血糖、体质量分层随机法分为3 组,每组10 只,分别为模型组(Control 组)、盐酸二甲双胍组(Met 组,0.13 g·kg-1)、青钱柳水提物组(CPAE 组,2 g·kg-1)。其中Normal 组及Control 组给予同等体积的生理盐水灌胃,固定灌胃时间,每日1次,连续6周。
2.2 取材及指标检测
2.2.1 小鼠取材
药物干预6 周后取材,小鼠禁食12 h,眼眶取血,室温静置30 min,4℃,3500 r·min-1,15 min,抽取上清,用于血清生化指标检测及FINS 测定。迅速于冰上剖取小鼠肝脏,分置于4%多聚甲醛固定24 h(用于肝脏HE 染色及肝脏糖原含量测定)和冻存管(用于western blot检测),其中冻存管放置-80℃待用。
2.2.2 一般指标
每周观察并记录小鼠一般指标:包括精神、活动情况,毛色、饮食量、体质量等。
2.2.3 生化指标及空腹胰岛素水平(FINS)检测
采用比色法测定小鼠空腹血糖(FBG)、甘油三脂(TG)、总胆固醇(TC)、游离脂肪酸(FFA)。采用酶联免疫法(Elisa)检测空腹血清胰岛素(FINS),并计算胰岛素抵抗指数(HOMA-IR)=FBG×Fins·22.5-1。
在翻转课堂的实践中,教师的角色不仅仅是课程内容的传授者,更多则转变为学习过程的引导者,学生则由原来被动的接受者,转变为积极主动的参与者[3]。
2.2.4 肝脏HE染色
对固定的肝脏组织进行常规石蜡包埋切片,切片厚度5 um。对切片进行常规梯度脱蜡。脱蜡后,对切片进行复水。采用苏木素-伊红(HE)方法染色,石蜡切片常规脱蜡至水。染色顺序:苏木精染液染色5 s,1%盐酸-乙醇分色30 s,纯水返蓝,伊红染液5 s,再进行常规梯度脱水,树胶封片,光镜下观察肝脏病理变化。
2.2.5 肝脏PAS染色
取肝组织石蜡切片常规脱蜡,双蒸水冲洗后,浸入0.5%的过碘酸溶液中10 min,双蒸水冲洗2 次。切片放入Schiff 试剂中显色15 min,流水冲洗10 min,苏木素染色液复染2 min,1%盐酸-乙醇分化,流水冲洗10 min 返蓝,常规梯度酒精脱水,二甲苯透明,树胶封片。光镜下观察并拍照,用Image-Pro Plus 6.0 软件分析肝糖原含量。
2.2.6 肝脏P-AMPKα及PGC-1α蛋白表达情况
测定肝脏相关蛋白表达,用全蛋白提取试剂盒提取各组小鼠肝脏蛋白,并用BCA 蛋白定量试剂盒进行蛋白定量,调整各组蛋白浓度至统一浓度。SDSPAGE 凝胶电泳,每孔15 ug,先80 V 预电泳10 min,再100 V 电泳60 min;半干法凝胶转膜法转膜,恒流200 mA 转膜 40 min;用 1 × TBS 摇床室温洗 3 次,每次 10 min,Blocking one 或 Blocking one-P 室温封闭 1 h,分别加P-AMPKα、PGC-1α和β-actin(1∶1000 稀释)4℃孵育过夜。次日回收一抗,用1 × TBST 摇床室温清洗3次,每次10 min,加二抗(1∶5000)室温孵育1 h,回收二抗,用1×TBST 摇床室温清洗3 次,每次10 min。加超敏发光液,避光反应1 min,凝胶成像系统显影。用Image J软件对灰度值进行分析。
表1 青钱柳水提物对小鼠饮食量的影响(,单位:g,n=10)
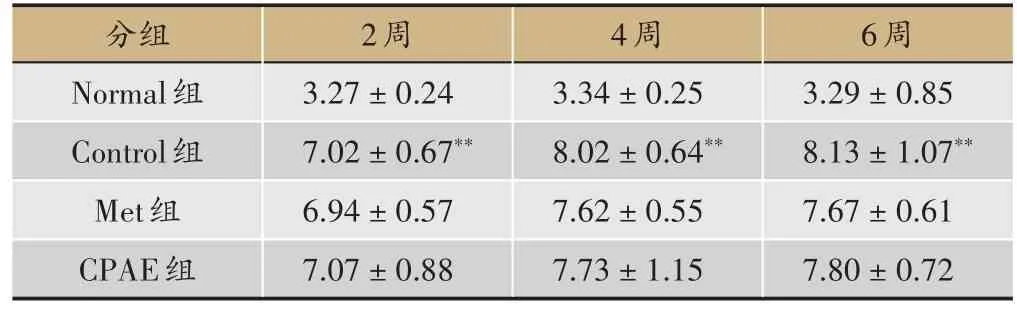
表1 青钱柳水提物对小鼠饮食量的影响(,单位:g,n=10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
6周3.29±0.85 8.13±1.07**7.67±0.61 7.80±0.72分组Normal组Control组Met组CPAE组2周3.27±0.24 7.02±0.67**6.94±0.57 7.07±0.88 4周3.34±0.25 8.02±0.64**7.62±0.55 7.73±1.15
表2 青钱柳水提物对小鼠体质量的影响(,单位:g,n=10)
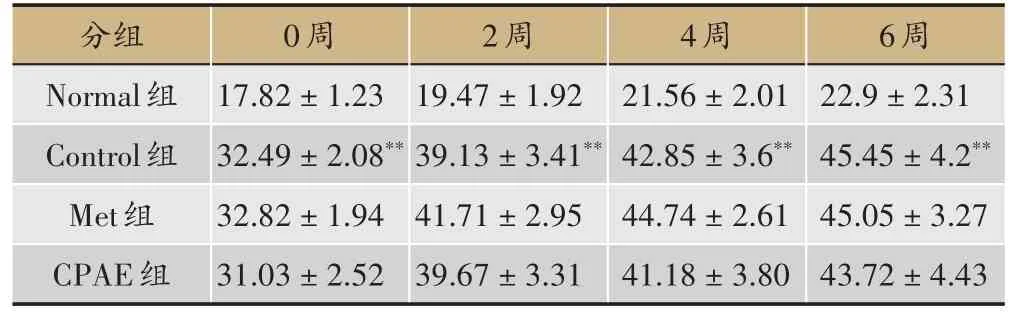
表2 青钱柳水提物对小鼠体质量的影响(,单位:g,n=10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
6周22.9±2.31 45.45±4.2**45.05±3.27 43.72±4.43分组Normal组Control组Met组CPAE组0周17.82±1.23 32.49±2.08**32.82±1.94 31.03±2.52 2周19.47±1.92 39.13±3.41**41.71±2.95 39.67±3.31 4周21.56±2.01 42.85±3.6**44.74±2.61 41.18±3.80
2.3 统计方法
3 结论
3.1 CPAE对小鼠一般情况的影响
对小鼠体质量的影响:与Normal 组小鼠比较,随着小鼠周龄的增加,Control 组小鼠体质量明显增加(P< 0.01);与Control组相比,Met及CPAE组可减轻小鼠的体质量,但无明显差异(P> 0.05)(表2)。
3.2 CPAE对小鼠FBG、TG、TC、FFA的影响
与Normal组小鼠比较,Control组小鼠FBG 明显升高,且随周数增加,FBG 增高愈明显(P< 0.01);与Control 组相比,Met 及 CPAE 组可降低小鼠 FBG 水平(P< 0.01),且随周数增加,降糖效果愈明显(表3)。
与Norma 组小鼠比较,Control 组小鼠TG、TC、FFA水平均明显升高,且具有极显著差异(P<0.01);与Control组相比,Met可一定程度上降低TG、TC水平,无显著差异(P> 0.05),但可显著降低 FFA 水平(P<0.05),CPAE 组TG 水平稍升高,但无统计学意义(P>0.05),CPAE 组可一定程度降低 TC 水平,无显著差异(P> 0.05),但 CPAE 组可显著降低 FFA 水平(P<0.05)(表4)。
3.3 CPAE对小鼠FINS及HOMA-IR的影响
与 Normal 组小鼠比较,Control 组小鼠 FINS 及HOMA-IR 水平均明显升高(P< 0.01),提示Control 组小鼠胰岛素抵抗增加;与Control 组相比,Met 及CPAE组可明显降低FINS 及HOMA-IR 水平,具极显著差异(P< 0.01)(表5),提示CPAE 可改善小鼠胰岛素抵抗,提高胰岛素敏感性。
3.4 小鼠肝脏HE染色结果
Normal 组小鼠肝脏肝小叶结构完整,肝细胞形态正常,排列规则,内未见脂质沉积;与Normal 组比较,Control 组肝小叶结构较紊乱,肝细胞肿大、变形,排列紊乱,且内存在大量脂肪空泡和脂质沉积;与Control组比较,Met 及CPAE 组肝小叶结构排列较整齐,Met组肝细胞大小、形态基本正常,未见明显脂肪空泡,脂质沉积明显减少,CPAE 组肝细胞大小、形态明显改善,其内脂肪空泡数量明显减少(图1)。
3.5 小鼠肝脏PAS染色结果
Normal 组小鼠肝脏PAS 染色糖原呈紫红色,位于细胞质,染色均匀,密度高;与Normal 组相比,Control组肝脏糖原表达密度较低,糖原染色明显少,且分布不均匀,内可见大量脂滴;与Control 组相比,Met 及CPAE 组糖原表达明显增高,染色增多,分布较均匀,内部脂滴量明显少(图2、表6)。
3.6 CPAE 对小鼠肝脏 P-AMPKα 及 PGC-1α 蛋白表达的影响
结果显示,与Normal 比较,Control 组小鼠肝脏PAMPKα蛋白表达水平明显下降(图3),而PGC-1α的表达水平明显增加(P均 <0.01);与Control 组相比,Met 及 CPAE 组均可增加 P-AMPKα蛋白表达水平,同时降低PGC-1α蛋白表达水平(P均 <0.01)(表7)。提示 CPAE 对小鼠肝脏 P-AMPKα及 PGC-1α的蛋白表达具调节作用,其调节db/db 小鼠肝脏糖脂代谢和改善胰岛素抵抗的作用可能是通过调节P-AMPKα及PGC-1α蛋白表达来实现。
表3 青钱柳水提物对小鼠FBG的影响(,单位:g,n=10)
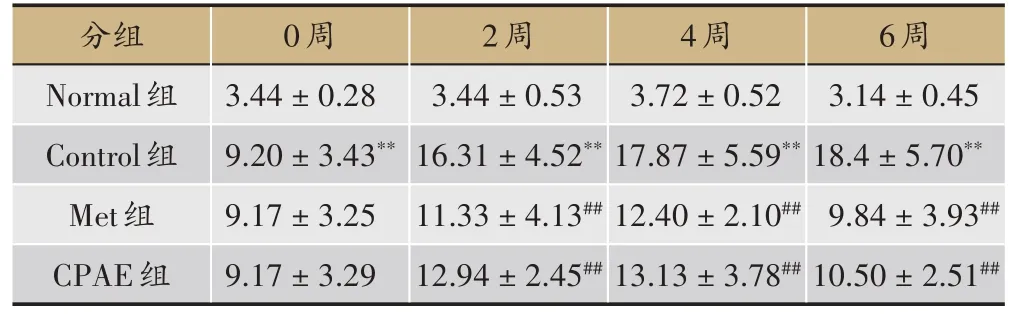
表3 青钱柳水提物对小鼠FBG的影响(,单位:g,n=10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
6周3.14±0.45 18.4±5.70**9.84±3.93##10.50±2.51##分组Normal组Control组Met组CPAE组0周3.44±0.28 9.20±3.43**9.17±3.25 9.17±3.29 2周3.44±0.53 16.31±4.52**11.33±4.13##12.94±2.45##4周3.72±0.52 17.87±5.59**12.40±2.10##13.13±3.78##
表4 青钱柳水提物对小鼠脂代谢的影响(,单位:g,n=10)
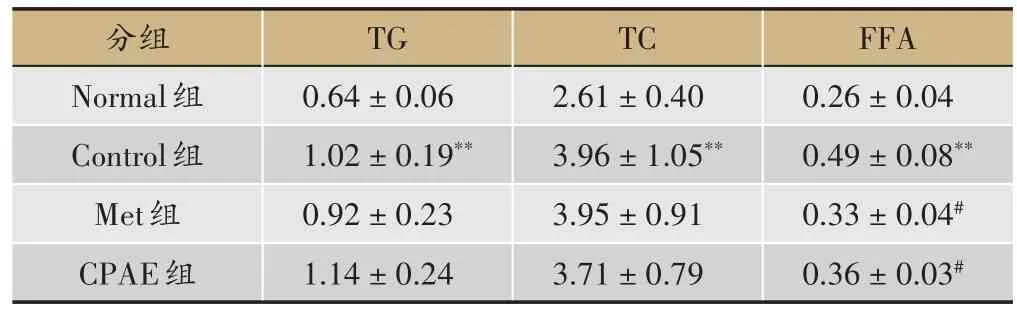
表4 青钱柳水提物对小鼠脂代谢的影响(,单位:g,n=10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
?
表5 青钱柳水提物对小鼠FINS及HOMA-IR的影响(,n=10)
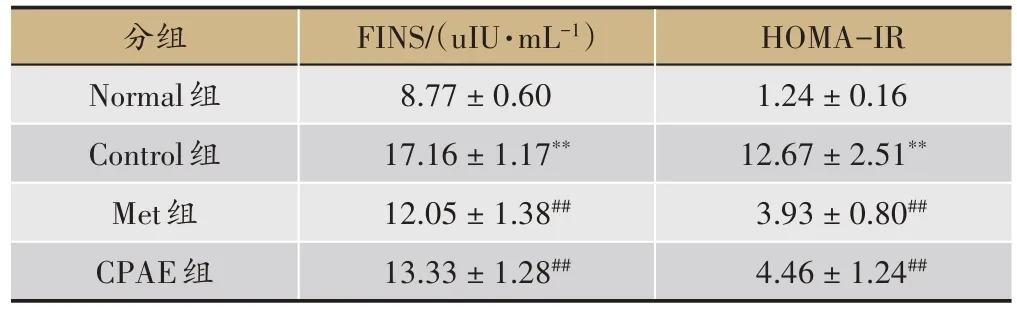
表5 青钱柳水提物对小鼠FINS及HOMA-IR的影响(,n=10)
注:与Normal 比较,*P < 0.05,**P < 0.01;与Control 组对比较,#P < 0.05,##P < 0.01。
HOMA-IR 1.24±0.16 12.67±2.51**3.93±0.80##4.46±1.24##分组Normal组Control组Met组CPAE组FINS/(uIU·mL-1)8.77±0.60 17.16±1.17**12.05±1.38##13.33±1.28##
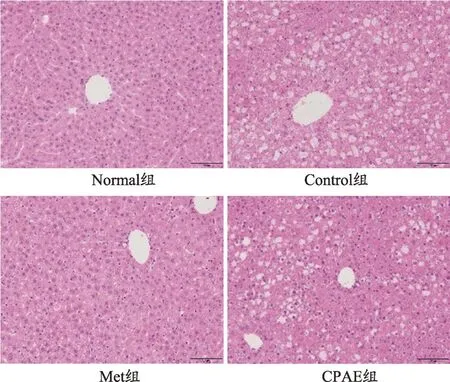
图1 青钱柳水提物对db/db小鼠肝脏形态影响(n=10,×200)
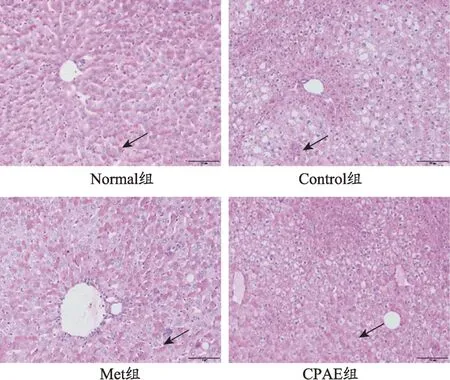
图2 青钱柳水提物对db/db小鼠肝糖原合成的影响(n=10,×200)
表6 青钱柳水提物对小鼠肝脏PAS染色面积的影响(,n = 10)

表6 青钱柳水提物对小鼠肝脏PAS染色面积的影响(,n = 10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
PAS染色面积0.395±0.005 0.184±0.007**0.337±0.006#0.276±0.010#分组Normal组Control组Met组CPAE组
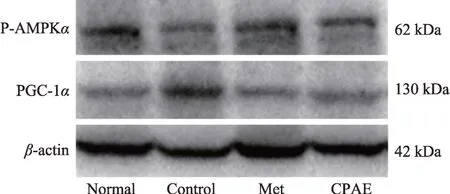
图3 青钱柳水提物对db/db肝脏P-AMPKα及PGC-1α蛋白表达的影响(n=10)
表7 青钱柳水提物对db/db小鼠肝脏P-AMPKα及PGC-1α蛋白的影响(,n=10)
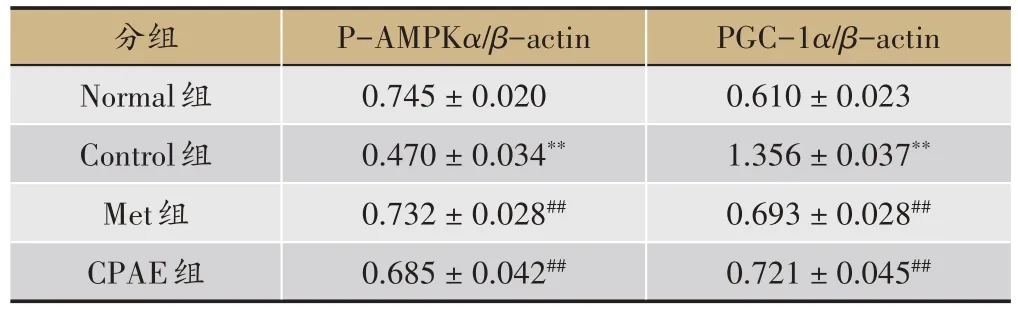
表7 青钱柳水提物对db/db小鼠肝脏P-AMPKα及PGC-1α蛋白的影响(,n=10)
注:与Normal比较,*P < 0.05,**P < 0.01;与Control组对比较,#P < 0.05,##P < 0.01。
PGC-1α/β-actin 0.610±0.023 1.356±0.037**0.693±0.028##0.721±0.045##分组Normal组Control组Met组CPAE组P-AMPKα/β-actin 0.745±0.020 0.470±0.034**0.732±0.028##0.685±0.042##
4 讨论
T2DM 是一种与家族遗传、环境、生活方式等因素密切相关的代谢性疾病,以葡萄糖、蛋白质、脂类代谢异常为主要特征的代谢综合征。其核心病机是胰岛素抵抗和胰岛β细胞功能受损。其中胰岛素抵抗(Insulin resistance,IR)贯穿于T2DM 始终,在T2DM 的发生发展过程中扮演重要角色[15,16]。
肝脏作为机体重要的能量代谢器官,在调节机体能量代谢及胰岛素抵抗方面起重要作用,其中肝脏糖异生作是葡萄糖代谢重要组成部分。肝脏糖原合成及糖异生在糖代谢的紊乱以及胰岛素抵抗中起重要作用,所以抑制肝脏糖异生成为治疗糖尿病的主要方法之一,如防治T2DM 常用药物盐酸二甲双胍片、盐酸吡格列酮片其主要作用机制即抑制肝脏糖异生,增加肝脏、肌肉等组织对葡萄糖的摄取利用,该作用与激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)密切相关[17]。
已知AMPK 是一种与代谢密切相关的应激蛋白激酶,其广泛分布于肝脏、脂肪、肌肉等胰岛素靶组织中,参与调节机体葡萄糖、脂肪及蛋白质代谢[18,19]。AMPK在机体高度保守的,其调控机制较为复杂,一般认为通过其α亚基Thr172 的磷酸化而激活,进而调节与肝脏糖异生相关因子(如:PGC-1α、FOXO1、HNF-4α相关转录因子等)来稳定血糖。研究发现在肥胖2型糖尿病患者或胰岛素抵抗动物模型中发现肝脏、脂肪和肌肉等组织中的AMPK 磷酸化水平下降,而使用AMPK 激活剂后可抑制肝脏糖异生从而降低血糖,同时改善胰岛素抵抗[20,21]。在肝脏,AMPK激活后可调节下游作用靶点PGC-1α,增强线粒体的呼吸功能,调节能量代谢,改善胰岛素抵抗[22-24]。说明AMPK 的磷酸化激活在调节肝脏糖异生及改善胰岛素抵抗中发挥积极作用。在肥胖、胰岛素抵抗或2 型糖尿病患者肝脏PGC-1α高表达,通过调控磷酸烯醇式丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸酶(G-6-Pase)等糖异生关键酶的水平增强肝脏糖异生能力,从而升高血糖,在肝脏胰岛素抵抗以及脂肪肝的形成过程中起重要作用[25,26]。
本研究发现与Normal 组比较,Control 组小鼠的饮食量、体质量、FBG、TG、TC、FFA 及FINS 水平明显升高,FINS及HOMA-IR 亦明显升高,且表现明显的糖尿病症状,而肝脏HE 染色显示肝脏内大量脂质沉积,肝细胞肿大、变形,同时PAS 结果显示小鼠肝脏肝糖原含量明显下降,提示小鼠肝脏脂肪变性,肝脏胰岛素抵抗明显,小鼠糖尿病模型造模成功;当给予Met 或CPAE 干预后,均可一定上程度减少小鼠的饮食量(无统计学意义),但对小鼠体质量无明显影响,考虑小鼠食物摄入量的减少可能与药物改善小鼠葡萄糖代谢有关;无论是Met 还是CPAE 组均可降低小鼠FBG、FINS 及 HOMA-IR 水平,提示 CPAE 可增加小鼠胰岛素的敏感性,改善胰岛素抵抗;在脂代谢方面,虽然CPAE 组轻度升高小鼠TG 水平,但可减低TC 和FFA水平;同时抑制脂质在肝脏沉积,增加肝脏糖原含量,提高P-AMPKα蛋白表达水平,抑制PGC-1α蛋白表达水平。综上提示青钱柳水提物可抑制脂质在db/db 小鼠肝脏的堆积,抑制糖原分解,增加肝糖原的合成,其作用机制可能是通过调节AMPK/PGC-1α信号通路来实现。
