祛风解痉方调节γδT细胞抑制哮喘小鼠气道高反应性的分子机制
2020-04-03樊长征苗青洪巧瑜
樊长征 苗青 洪巧瑜
[摘要] 目的 探討祛风解痉方调节γδT细胞抑制哮喘小鼠气道高反应性的分子机制。 方法 以卵清蛋白滴鼻的方法建立哮喘Balb/c小鼠模型,以祛风解痉方药进行干预,比较祛风解痉方对γδT细胞活化过程中信号通路分子磷酸化水平的干预效果。30只实验小鼠按照随机数字表法分为6组,每组5只,分别为空白对照组、哮喘模型组、醋酸泼尼松组(0.27 mg/d)、祛风解痉方低剂量组(0.59 g/d)、祛风解痉方中剂量组(1.18 g/d)、祛风解痉方高剂量组(2.36 g/d)。各组分别进行干预,1次/d,共给药7 d。给药结束后麻醉处死小鼠,分离纯化及扩增肺气道组织γδT细胞,CCK-8检测γδT细胞的增殖活性,Western blot检测不同信号通路分子的磷酸化水平。 结果 与空白对照组比较,哮喘模型组γδT细胞活性明显增强,差异有统计学意义(P < 0.05)。与哮喘模型组比较,祛风解痉方低剂量组的γδT细胞活性差异无统计学意义(P > 0.05),而祛风解痉方中、高剂量组以及醋酸泼尼松组的γδT细胞活性明显降低,差异有统计学意义(P < 0.05)。与空白对照组比较,哮喘模型组p-ERK1/2、p-P38、β-catenin的蛋白表达量增加,差异有统计学意义(P < 0.05),ERK1/2、P38蛋白表达水平差异无统计学意义(P > 0.05)。与哮喘模型组比较,祛风解痉方低、中、高剂量组以及醋酸泼尼松组p-ERK1/2、p-P38、β-catenin的蛋白表达量减少,差异有统计学意义(P < 0.05),而祛风解痉方中、高剂量组以及醋酸泼尼松组ERK1/2蛋白表达水平增加,祛风解痉方低剂量组以及醋酸泼尼松组P38蛋白表达水平增加,差异有统计学意义(P < 0.05)。 结论 祛风解痉方调节γδT细胞抑制哮喘小鼠气道高反应性的可能分子信号通路机制为抑制p-ERK1/2、p-P38、β-catenin的蛋白表达量,减轻哮喘小鼠气道高反应性,达到治疗哮喘的目的。
[关键词] 祛风解痉方;哮喘;γδT淋巴细胞;信号通路分子
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2020)02(c)-0004-05
[Abstract] Objective To investigate the molecular mechanism of Qufeng Jiejing Prescription in regulating γδT cells to inhibit airway hyperresponsiveness in asthmatic mice. Methods The Balb/c mouse model of asthma was established with the method of ovalbumin nasal drip, and the intervention was conducted with the drugs of Qufeng Jiejing Prescription. The intervention effect of Qufeng Jiejing Prescription on the molecular phosphorylation level of signaling pathway during activation of γδT cells was compared. Thirty experimental mice method was divided into 6 groups according to random number table, each group of 5 mice, respectively for the blank control group, asthma model group, Prednisone Acetate group (0.27 mg/d), Qufeng Jiejing Prescription low dose group (0.59 g/d), Qufeng Jiejing Prescription medium dose group (1.18 g/d), Qufeng Jiejing Prescription high dose group (2.36 g/d). Each group was treated 1 time/d and intervention for 7 days. After administration, the mice were anesthetized and sacrificed, and the γδT cells in the lung airway tissues were isolated, purified and amplified. The proliferation activity of the γδT cells was detected by CCK-8, and the phosphorylation levels of molecules in different signaling pathways were detected by Western blot. Results Compared with the blank control group, the activity of γδT cells in the asthma model group was significantly increased, with statistically significant difference (P < 0.05). Compared with the asthma model group, there was no significant difference in the activity of γδT cells in the Qufeng Jiejing Prescription low dose group (P > 0.05), while the activity of γδT cells in the medium, high dose groups of Qufeng Jiejing Prescription and the Prednisone Acetate group were significantly decreased (P < 0.05). Compared with the blank control group, the protein expression levels of p-ERK1/2, p-P38 and β-catenin in the asthma model group increased, with statistically significant difference (P < 0.05), while the protein expression levels of ERK1/2 and P38 showed no statistically significant difference (P > 0.05). Compared with the asthma model group, the protein expression levels of p-ERK1/2, p-P38 and β-catenin in the low, medium and high dose groups of Qufeng Jiejing Prescription and the Prednisone Acetate group were decreased, with statistically significant differences (P < 0.05). However, ERK1/2 protein expression level increased in the middle and high dose groups of Qufeng Jiejing Prescription and Prednisone Acetate group, and P38 protein expression level increased in the Qufeng Jiejing Prescription low dose group and Prednisone Acetate group, the differences were statistically significant (all P < 0.05). Conclusion The possible molecular signaling pathway mechanism of the regulation of T cells to inhibit airway hyperresponsiveness in asthmatic mice is to inhibit the protein expression levels of p-ERK1/2, p-P38 and β-catenin, so as to reduce airway hyperresponsiveness in asthmatic mice and achieve the treatment of asthma.
[Key words] Qufeng Jiejing Prescription; Asthma; γδT lymphocyte; Signaling pathway molecules
支气管哮喘(以下简称“哮喘”)是由多种细胞,包括嗜酸粒细胞、中性粒细胞、肥大细胞、T淋巴细胞、气道上皮细胞等细胞组分参与的气道慢性炎症性疾病[1]。哮喘主要的免疫学改变是Th1/Th2失衡[2],也是其发生发展的关键。γδT细胞通过影响Th1/Th2应答平衡而左右哮喘气道高反应性的发生发展,并参与了哮喘的炎症及损伤修复过程,使其与哮喘相关性的研究越来越受到重视[3-6]。
本课题组临床研究证明祛风解痉方可控制哮喘发作,改善气道阻塞,明显改善哮喘患者临床症状,减少急性发作[7-8]。同时课题组前期以卵清蛋白滴鼻的方法建立哮喘小鼠模型,以祛风解痉方药进行干预,比较祛风解痉方药对哮喘模型小鼠肺脏组织病理学、气道高反应、γδT细胞的Vγ1 mRNA、Vγ4 mRNA表达量及γδT细胞分泌的细胞因子白细胞介素-5(IL-5)、IL-13、转化生长因子-β(TGF-β)、IL-10、γ-干扰素(IFN-γ)表达水平的干预效果,发现祛风解痉方药可降低γδT细胞的Vγ1 mRNA表达量、增加Vγ4 mRNA表达量,同时降低γδT细胞分泌的细胞因子IL-5、IL-13、TGF-β表达水平,调高IL-10、IFN-γ的表达水平,抑制气道炎性反应,改善哮喘模型小鼠的气道高反应性,初步阐明了祛风解痉中药调节γδT细胞抑制哮喘小鼠气道高反应性的机制。本研究进一步探讨了祛风解痉中药调节γδT细胞抑制哮喘小鼠气道高反应性的可能的分子机制,为临床应用祛风解痉方药治疗哮喘提供有力的支持及实验数据。
1 材料与方法
1.1 材料
1.1.1 试验动物 6~8周雄性Balb/c小鼠,动物体重35 g,清洁级,温度18~22℃,湿度50%~60%,光照/阴暗12 h/12 h。小鼠购自湖北省动物实验中心,实验动物生产许可证号:31162040001417,动物合格证号SYXK(鄂)2013-0069。动物饲养及取材符合中国中医科学院西苑医院(以下简称“我院”)伦理委员会要求。
1.1.2 试剂及药物 卵清蛋白(OVA)(美国Sigma,货号:A5503-1G);氢氧化铝[AL(OH)3](美国Sigma,货号:V900163-500G);p-ERK1/2(美国Affinity公司,货号:AF1015);ERK1/2(美国Affinity公司,货号:AF0155);p-P38(美国Affinity公司,货号:AF4001);P38(美国Affinity公司,货号:AF6456);β-catenin(美国Affinity公司,货号:AF6266);甘油醛-3-磷酸脱氢酶(GAPDH)(美国Affinity公司,货号:AF7021);祛风解痉方:炙麻黄9 g、杏仁10 g、防风10 g、地龙12 g、蝉蜕10 g、柴胡9 g、苍耳子6 g、乌梅6 g、陈皮10 g、半夏9 g、茯苓12 g、甘草6 g(我院中药房);醋酸泼尼松片(天津力生制药股份有限公司,批号:1709111,5 mg/片)。
1.1.3 主要仪器 台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司,H1650R);恒温震荡培养箱(太仓华美生化仪器有限公司,QHZ-12A);电泳仪电泳槽(天能科技有限公司,VE-186);转印槽(Biorad,Trans-Blot SD);脱色摇床(常州澳华仪器有限公司,TS-1);二氧化碳培养箱(日本三洋SANYO,MCO-20AIC);超净工作台(上海博讯,SC-CL-2FD);凝胶成像仪(Biaorad公司,ChemiDoc XRS+System)。
1.2 实验方法
1.2.1 模型制作 在无菌环境中饲养适应1周后,进行第1次致敏,腹腔内注射20 μg OVA和2 mg Al(OH)3;第2、3周后进行第2、3次致敏,腹腔内注射10 μg OVA和1 mg Al(OH)3;第5周开始每天用0.5×磷酸缓冲盐溶液(PBS)配制的5%OVA 40~50 min滴鼻处理。空白对照组致敏用生理盐水,滴鼻处理用0.5×PBS,连续7 d,7 d后评估模型是否成功。
1.2.2 模型成功标准 造模后对各组小鼠的气道反应性进行检测。空白对照组小鼠的呼吸波形图规律且均匀,符合正常动物的生理状态。模型组呼吸波形图的上升支和下降支的斜度减小并伴有顿挫,且呼吸周期之间伴有一段时间的基线段。从气道反应性的结果看,在同一浓度的乙酰胆碱下,哮喘模型鼠的气道反应性值高于空白对照组。表明小鼠哮喘模型成功建立,作为后续研究的实验对象。
1.2.3 分组 将30只小鼠按照随机数字表法将其分为6组,每组5只;空白对照组(不造模,给予等体积生理盐水,灌服);模型组对照组(造模后,给予等体积生理盐水,灌服);祛风解痉方低剂量组(造模后,给予1倍量中药,0.59 g/d,灌服);祛风解痉方中剂量组(造模后,给予2倍量中药,1.18 g/d,灌服);祛风解痉方高剂量组(造模后,给予4倍量中药,2.36 g/d,灌服);阳性对照组(造模后,给予1倍量醋酸泼尼松片,0.27 mg/d,灌服)。祛风解痉方按人体每日用药量的1、2、4倍量给药。醋酸泼尼松片(5 mg/片),成年患者口服10片/d;根据人与小鼠体表面积换算方法计算小鼠给药量,按成年患者用药量的1倍量给药。模型成立后的第2天开始给药,饲料正常给。连续灌胃给药14 d。
1.2.4 肺气道组织γδT细胞的分离纯化及扩增 小鼠麻醉处死后,用无菌手术刀取出各组小鼠肺组织,切碎并用collgenase消化得到的细胞,使用抗TCRγδ磁珠分选,并检测γδT细胞的浓度。将分离纯化的γδT细胞加入50 mL培养瓶中,加入3 mL含10%血清、100 U/mL双抗的RPMI-1640培養基,再加唑来膦酸(终浓度为300 pg/mL)、IL-2(终浓度为200 U/mL),置于5%CO2、37℃恒温培养箱中培养,每3天换1次液,培养9~12 d,调整细胞浓度为106/mL。
1.2.5 CCK-8检测γδT细胞的增殖活性 取扩增10 d的小鼠肺组织γδT细胞,CCK-8检测分选纯化后γδT细胞的增殖活性。接种培养10 d的各组肺气道组织γδT细胞,向每孔加入10 μL CCK-8反应液,然而将培养板置于5% CO2、37℃恒温培养箱内孵育4 h。最后用酶标仪测定在450 nm处的吸光度。
1.2.6 Western blot检测不同信号通路分子的磷酸化水平 收集适量的γδT细胞用含有蛋白酶抑制剂(Complete,Roche)的裂解液进行裂解(50 mmol/L Tris-Cl pH 7.4,1 mmol/L EDTA pH 8.0,250 mmol/L NaCl,1% Triton-X)。蛋白裂解液浓度利用Bradford法进行测量(Bio-Rad No. 5000006)。10 μg细胞裂解液与5×样品缓冲液(15 g SDS, 15.6 mL 2 mol/L Tris pH 6.8,57.5 g glycerol,16.6 mL b-Mercaptoethanol)混合后,将样品上样至10%的聚丙烯酰胺凝胶中,SDS-PAGE分离并转移至PVDF膜上(Bio-Rad. NO. 162-0177)。用含0.1% Tween的4%牛奶进行封闭后,加入以下抗体,4 ℃孵育过夜:p-ERK1/2一抗稀释比1∶500。ERK1/2一抗稀释比1∶1000。p-P38一抗稀释比1∶500。P38一抗稀释比1∶500。β-catenin一抗稀释比1∶500。GAPDH一抗稀释比1∶1000。用含0.1% Tween的PBS溶液将膜洗3遍后,加入含0.1% Tween的4%牛奶以及HRP二抗(Dianova,Hamburg,Germany)在室温条件下孵育2 h。取出膜,在膜上滴加ECL显影液(Bio-Rad. NO. 170-5060)并放入GelDoc成像系统(Bio-Rad)进行拍照。蛋白表达水平用内参蛋白GAPDH进行归一化处理。
1.3 统计学方法
采用SPSS 17.0对所得数据进行统计学分析,符合正态分布的计量资料采用均数±标准差(x±s)表示,多组间比较采用ANOVA检验,组间比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 CCK-8检测γδT细胞的增殖活性
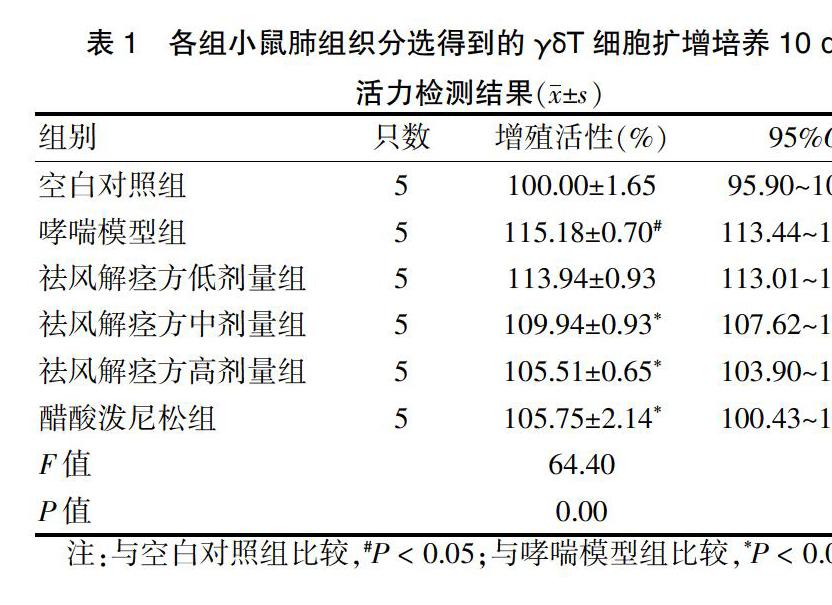
与空白对照组比较,哮喘模型组γδT细胞活性明显增强,差异有统计学意义(P < 0.05)。与哮喘模型组比较,祛风解痉方低剂量组的γδT细胞活性差异无统计学意义(P > 0.05),而祛风解痉方中剂量组、祛风解痉方高剂量组以及醋酸泼尼松组的γδT细胞活性明显降低,差异有统计学意义(P < 0.05)。见表1。
2.2 Western blot检测不同信号通路分子的磷酸化水平
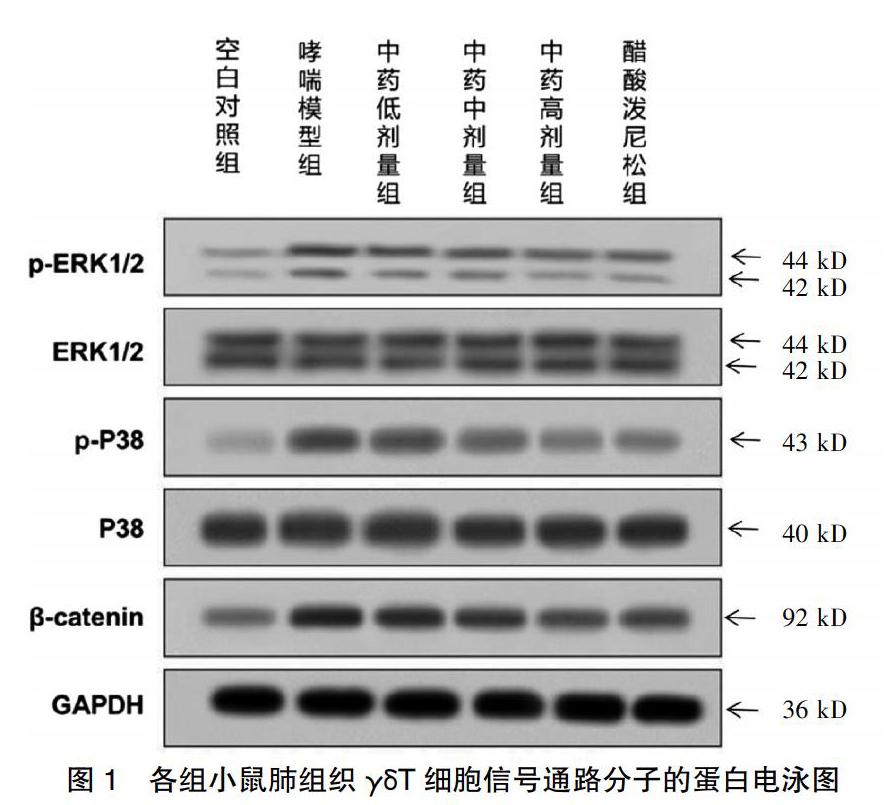
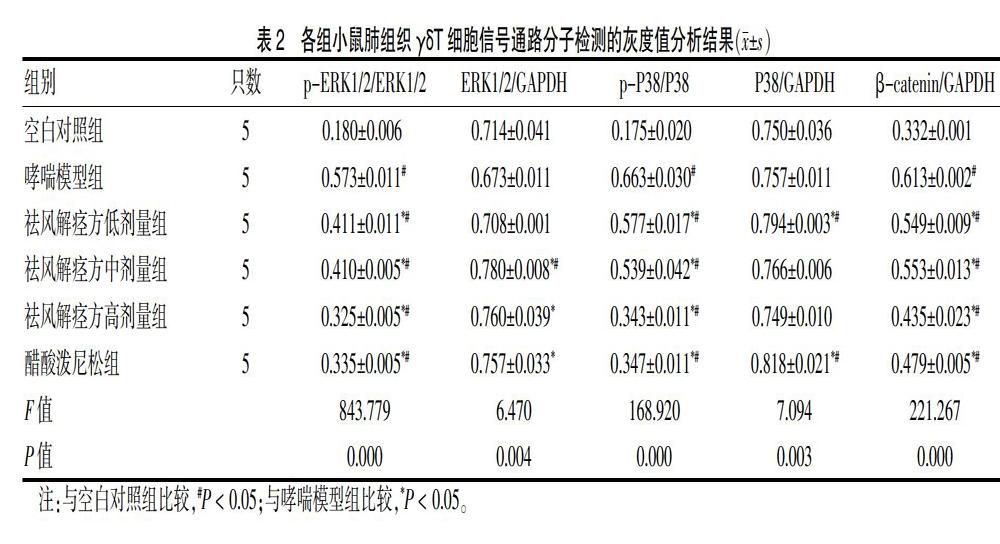
与空白对照组比较,哮喘模型组p-ERK1/2、p-P38、β-catenin的蛋白表达量增加,差异有统计学意义(P < 0.05),ERK1/2、P38蛋白表达水平差异无统计学意义(P > 0.05)。与哮喘模型组比较,祛风解痉方低、中、高剂量组以及醋酸泼尼松组的p-ERK1/2、p-P38、β-catenin的蛋白表达量减少,差异有统计学意义(P < 0.05),而祛风解痉方中、高剂量组以及醋酸泼尼松组ERK1/2蛋白表达水平增加(P < 0.05),祛风解痉方低剂量组以及醋酸泼尼松组P38蛋白表达水平增加,差异有统计学意义(P < 0.05)。见图1、表2。
3 讨论
哮喘的发病机制主要与气道炎症、气道高反应性、神经因素和变态反应等有关[9]。气道高反应性在哮喘诊断、病情评估及预后评价中具有重有意义[10]。哮喘发病迅速,时发时止,反复发作,发时痰鸣气喘,与风邪善行数变的性质相符,本课题组提出“风盛痰阻,气道挛急”是哮喘發作的主要病机之一,并特别指出此风不仅指外风侵袭可致哮病,而且内生肝风,夹瘀犯肺,风摇金鸣,亦可致哮喘即发[11]。“风盛痰阻,气道挛急”既是哮喘发作的病因,又是哮喘发病之结果,“风盛痰阻,气道挛急”的状态贯穿于哮喘的发作期、缓解期、稳定期整个病程中,这与哮喘重要特征气道高反应性存在高度一致。祛风解痉方药依据哮喘气道高反应性的关键病因病机“风盛痰阻,气道挛急”而组成,在临床观察中取得较好的疗效[11]。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是90年代初期分离鉴定的一种蛋白激酶[12]。ERK是MAPKs家族一个重要亚族(ERK又称为MAPK),ERK1和ERK2统称为ERK1/2,是其中的两个重要成员。MAPK信号转导通路是细胞内重要的信号转导系统,MAPK的组成是一种保守的三级激酶模式,包括MAPK激酶激酶、MAPK激酶、MAPK[13],这3种激酶能依次激活,共同调节细胞的生长、分化、迁移、侵袭、凋亡、应激和炎性反应等重要的细胞生理和病理过程[14]。p38促分裂原活化的蛋白激酶(p38 MAPK)在激素抵抗型哮喘的发病过程中起着重要作用[15]。p38通路被促炎因子、细菌病原体及其代谢产物磷酸化激活,激活后的p38 MAPK由胞质进入细胞核内,活化转录因子,调节特定的基因表达参与应激条件下细胞的免疫炎性反应及细胞生长、细胞分化、细胞周期和细胞调死过程[16-17]。β-连环蛋白(β-catenin)最早作为一种黏附因子被发现,主要位于细胞膜,而在胞浆中游离量较少[18]。β-catenin是钙黏蛋白复合体的亚基,并且在Wnt信号途径中起细胞内信号转导的作用[19-20]。T细胞较其他免疫细胞表达更高水平的Wnt分子,预示这一通路在T细胞的应答过程中扮演着更为重要的角色[21]。
本研究结果显示,与空白对照组比较,哮喘模型组γδT细胞的细胞活性显著增强,提示哮喘模型鼠肺组织的炎性反应加重。祛风解痉方中剂量组、祛风解痉方高剂量组及醋酸泼尼松组的γδT细胞的细胞活性显著减弱,提示中药治疗和阳性药物治疗可以显著缓解哮喘模型小鼠肺组织的炎性反应,具有一定的治疗效果。同时本研究也深入研究了该反应途径的信号通路的具体分子机制,其中祛风解痉方药干预后的细胞p-ERK1/2、p-P38、β-catenin的蛋白表达量降低,提示哮喘模型小鼠γδT细胞中的MAPK及Wnt信号通路被激活,通过中药治疗或阳性药物治疗后,MAPK及Wnt信号通路一定程度上被抑制。
综上,祛风解痉方调节γδT细胞抑制哮喘小鼠气道高反应性的可能分子信号通路机制为抑制p-ERK1/2、p-P38、β-catenin的蛋白表达量,降低哮喘小鼠气道高反应性,达到治疗哮喘、改善症状的目的。
[参考文献]
[1] 中华医学会呼吸病学会哮喘学组.支气管哮喘防治指南(2016年版)[J].中华结核和呼吸杂志,2016,39(9):675-697.
[2] 张雷英,吴建奇,刘静,等.γδT细胞参与呼吸道合胞病毒感染对气道变态炎症反应的影响作用[J].中华微生物学和免疫学杂志,2012,32(3):234-238.
[3] Lu H,Li DJ,Jin LP. γδT cells and related diseases [J]. Am J Reprod Immunol,2016,75(6):609-618. doi:10. 1111/aji.12495.
[4] Bonneville M,O′Brien RL,Born WK. Gammadelta T cell effector functions:a blend of innate programming and acpuired plasticity [J]. Nat Rev Irnrnunol,2010,10(7):467-468.
[5] Brannan JD. Bronchial hyperresponsiveness in the assessment of asthma control:Airway hyperresponsiveness in asthma:its measurement and clinical significance [J]. Chest,2010,138(2 Suppl):11S-17S.
[6] 曾胜,刘静,张雷英,等.γδT细胞在过敏性哮喘中作用研究的新进展[J].中国免疫学杂志,2013,29(4):421-425.
[7] 樊长征,苗青,张燕萍.许建中从“虚、痰、毒、瘀”论治支气管哮喘的经验[J].光明中医,2011,26(4):657-658.
[8] 樊长征,裴玉蓁,丛晓东,等.祛风解痉方药对支气管哮喘患者气道高反应性的影响[J].中医杂志,2018,59(24):2107-2110.
[9] Kabelitz D,Marischen L,Oberg HH,et al. Epithelial defence by gamma delta T cells [J]. Int Arch Allergy Immunol,2015,137(1):73-81.
[10] 樊长征,苗青.支气管哮喘气道高反应易感基因原钙黏蛋白1研究进展[J].中华哮喘杂志:电子版,2012,6(2):135-136.
[11] 樊长征,裴玉蓁,张文江,等.风邪恋肺在支气管哮喘慢性持续期中的认识和临床运用[J].中国医药导报,2016, 13(1):102-105.
[12] 王薇.种植体微纳米形貌对成骨细胞行为影响的分子机制研究[D].西安:第四军医大学,2013.
[13] Liang L,Li F,Bao A,et al. Activation of p38 mitogen-activated protein kinase in ovalbumin and ozone-induced mouse model of asthma [J]. Respirology,2013,18 Suppl 3:20-29.
[14] 潘偉东,王东军.ERK1/2研究进展及其与神经胶质瘤相关性[J].海南医学,2011,22(22):121-124.
[15] 穆凯代斯·赛迪,杨晓红.p38 MAPK信号通路与糖皮质激素抵抗型哮喘的关系[J].医学综述,2019,25(4):654-658.
[16] Onions ST,Ito K,Charron CE,et al. The discovery of narrow spectrum kinase inhibitors:New therapeutic agents for the treatment of COPD and steroid resistant asthma [J]. J Med Chem,2016,59(5):1727-1746.
[17] Irusen E,Matthews JG,Takahashi A,et al. p38 Mitogen-activated protein kinase-induced glucocorticoid receptor phosphorylation reduces its activity:Role in steroid-insensitive asthma [J]. J Allergy Clin Immunol,2002,109(4):649-657.
[18] 程云娟,罗新华,程明亮.人原发性肝癌组织中AEG-1、β-catenin和C-myc的表达及其意义[J].贵州医药,2015,39(11):967-969.
[19] 莫文斌,唐玲荣,刘妍雨.Wnt信号通路分子调控细胞迁移的研究进展[J].中国中医药咨讯,2010,2(12):200-201.
[20] 赵东康,骆伟伟,余水平,等.Wnt信号通路与肝纤维化发生发展的关系[J].临床肝胆病杂志,2018,34(11):2415-2419.
[21] Luis TC,Naber BA,Roozen PP,et al. Canonical wnt signaling regulates hematopoiesis in a dosage-dependent fashion [J]. Cell Stem Cell,2011,9(4):345-356.
(收稿日期:2019-09-23 本文编辑:顾家毓)
