苦荞降血糖产品的稳定性研究
2020-04-01张立攀李向力赵梦瑶刘红伟
李 栋, 张立攀, 李向力, 赵梦瑶, 刘红伟
(河南省商业科学研究所有限责任公司,郑州 450002)
苦荞麦学名鞑靼荞麦(Fagopyrum tataricum),被誉为“五谷之王”[1],被评选为新型药食同源食物[2]. 苦荞本身具有很高的营养和保健价值:其淀粉含量59%~80%;苦荞蛋白(清蛋白和球蛋白)组成占其蛋白总含量的48%;苦荞的脂肪含量为2%~3%,包括10种脂肪酸;苦荞维生素含量明显比大米和小麦高;苦荞拥有人体必须矿物质元素,尤其铁元素含量是其他作物的3~5.5 倍;苦荞不含糖和胆固醇[3],具有很多生物活性成分,有降低毛细血管脆性和改善微循环的作用[4].
现代医学研究表明,苦荞含有黄酮等多种具有降血糖作用的生物活性因子,有降血糖的功能. 从苦荞中提取黄酮的方法很多,如热水浸提法[5-6]、醇提取法[7-8]、索氏提取法[9]、超声波提取法[10-12]和HPLC法[13]. 本试验尝试利用超声辅助乙醇提取苦荞黄酮,并与辅料硬脂酸镁、富铬酵母,微晶纤维素按一定比例混合[14],参照胶囊制备工艺制备苦荞黄酮降血糖产品,研究产品稳定性,为今后苦荞黄酮的开发应用提供科学依据.
1 材料与仪器
1.1 材料
苦荞(上海极荞生物科技有限公司);芦丁对照品(上海源叶生物科技有限公司);辅料为硬脂酸镁、富铬酵母和微晶纤维素;硝酸铝、亚硝酸钠、氢氧化钠、乙醇等均为分析纯.
1.2 仪器
XTP-500A型高速多功能摇摆粉碎机(浙江永康市红太阳机电有限公司);SXT-06 索氏提取器(上海洪纪仪器设备有限公司);SCIENIZ-ⅡD 超声波细胞粉碎机(上海净信实业发展有限公司);AB135-S电子天平(梅特勒-托利多(中国));TU-1810紫外可见分光光度计(北京普析通用仪器有限公司);101-1AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司).
2 试验设计
2.1 制作标准曲线
参考文献[15-16]略作修改:准确称取芦丁标品,用体积分数60%的乙醇配制0、1、2、3、4、5 μg/mL芦丁标准使用液;分别吸芦丁标准使用液1 mL于锥形瓶中,加入0.5 mL 5%NaNO2溶液,混匀静置6 min;加入0.5 mL 10%Al(NO3)3混匀静置6 min;最后加入4 mL 4%NaOH溶液混匀放置12 min,并于510 nm处测吸光值. 以横坐标(x)为芦丁浓度,纵坐标(y)为光度值绘制标准曲线.
2.2 工艺优化
2.2.1 原料的处理 将苦荞洗净,用烘箱50 ℃烘干,粉碎,过60目筛备用.
2.2.2 试验方法
1)单因素试验设计. 苦荞黄酮在提取过程主要影响因素有料液比(苦荞(g)∶乙醇(mL))、乙醇体积分数(%)、超声时间(min)和提取温度(℃). 以黄酮得率为指标,分别对这4个影响因素进行单因素试验研究,确定最佳范围. 黄酮得率计算公式如下:

式中:Y 为黄酮得率(%);C 为黄酮质量浓度(g/L);V 为待测液体积(L);N为稀释的倍数;m为称量样品的质量(g).2)试验优化. 对料液比(A)、乙醇体积分数(B)、超声时间(C)、提取温度(D)4个单因素设计正交试验,每个因素均设置3 个水平,进行工艺试验优化,通过正交试验助手进行数据分析(表1).
2.3 制备苦荞黄酮胶囊颗粒
2.3.1 苦荞黄酮的提取 按最佳工艺提取苦荞黄酮,放置于真空干燥箱(温度设置60 ℃)烘干,粉碎过60目筛收集备用.
2.3.2 制备胶囊内容物 参考文献[17]胶囊制备工艺略作修改:①选微晶纤维素、富铬酵母、硬脂酸镁作为辅料,与苦荞黄酮按质量比配制(苦荞黄酮∶硬脂酸镁∶富铬酵母∶微晶纤维素=1.46∶0.04∶0.05∶1.15)后测定混合粉末的相对临界湿度[18];②将实验室湿度控制在相对临界湿度值以下,用85%的食品级乙醇作溶湿剂,制备胶囊颗粒,收集20~60目颗粒于真空干燥箱60 ℃烘4 h,测其休止角[19];③手工制作胶囊,每粒胶囊质量控制在0.5 g左右.

表1 正交实验因素水平表Tab.1 Level of orthogonal experimental factors
2.3.3 计算胶囊装样量差异 取10粒胶囊,精确称取每粒胶囊的质量记为m1,再将其内容物完全倒出称重,记为m2,计算平均装样量和装样量差异.
2.4 胶囊保质期试验
采用保温加速试验[20-22]进行考察. 将装有内容物的胶囊装于包装盒内密封,置于恒温培养箱(40 ℃±2 ℃),相对湿度控制在75%±5%(饱和NaCl溶液),放置6个月. 依据文献[23]检测各项指标:感官性状、产品功效成分(黄酮含量)、水分含量(%)、崩解时限(min)和药品含量(mg/粒).
3 结果与分析
3.1 标准曲线的绘制分析
芦丁的标准曲线为y=0.292 2x-0.004 9(R2=0.999 4),图1显示芦丁标准液质量浓度与吸光度值呈现良好的线性关系.
3.2 单因素试验结果分析
3.2.1 料液比对苦荞黄酮得率的影响 准确称取苦荞粉末1.00 g,用60%乙醇进行溶解,超声30 min,料液比的梯度设置为1∶3、1∶6、1∶12、1∶24、1∶48,提取温度设置为85 ℃. 从图2可以看到,随着溶剂比例的增加,黄酮的得率在料液比为1∶6时达到最高. 以后随着溶剂的增加,苦荞黄酮得率平缓下降,故苦荞与乙醇的料液比为1∶6比较适宜.
3.2.2 乙醇体积分数对苦荞黄酮得率的影响 精确称取1.00 g 苦荞粉末,料液比设置为1∶6,超声时间30 min,乙醇体积分数设置为30%、40%、50%、60%、70%,提取温度设置为85 ℃.从图3可以看出,随着乙醇体积分数的增加苦荞黄酮的得率逐渐增加,当乙醇体积分数为60%时,黄酮得率达到了最高值,以后随着乙醇体积分数的增加黄酮得率呈轻微下降态势,故乙醇体积分数设置为60%左右为宜.
3.2.3 超声时间对苦荞黄酮得率的影响 精确称取1.00 g苦荞粉末,用体积分数60%的乙醇进行溶解,料液比设置为1∶6,超声时间设置为10、20、30、40、50 min,提取温度设置为85 ℃. 从图4 可以看出,随着超声时间的延长,苦荞黄酮得率呈现明显增加,30 min 后开始下降,故超声时间选30 min较为适宜.

图2 料液比对苦荞黄酮的得率的影响Fig.2 Effect of material-liquid ratio on the yield of tartary buckwheat flavonoids

图3 乙醇体积分数对苦荞黄酮得率的影响Fig.3 Effect of ethanol volume fraction on the yield of tartary buckwheat flavonoids
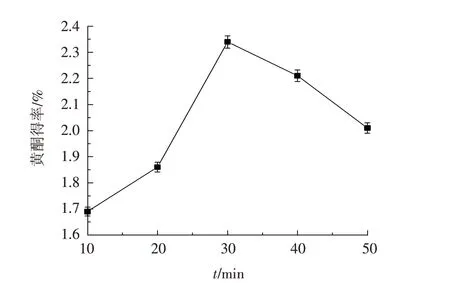
图4 超声时间对苦荞黄酮得率的影响Fig.4 Effect of ultrasonic time on the yield oftartary buckwheat flavonoids
3.2.4 提取温度对苦荞黄酮得率的影响 精确称取1.00 g苦荞粉末,用体积分数60%的乙醇进行溶解,料液比设置为1∶6,超声时间设置为30 min,提取温度分别设置为55、65、75、85、95 ℃.
从图5 可以看出,随着提取温度的增加,苦荞黄酮的得率呈现轻微上升趋势,温度为85 ℃时,苦荞黄酮的得率最高,故提取温度设为85 ℃左右较为适宜.
3.3 苦荞黄酮提取工艺的优化
通过表2,表3 可以看出,对提取苦荞黄酮得率的影响顺序为B、D、C、A. 通过方差分析看出,乙醇的体积分数在整个提取过程中影响显著. 最佳提取小组为A3B2C2D1,即料液比1∶8、乙醇体积分数60%、超声时间30 min、提取温度80 ℃. 验证其准确性,采用最佳工艺条件平行3次得到的提取得率均值为2.48%,实际值与理论值相近.

图5 提取温度对苦荞黄酮得率的影响Fig.5 Effect of extraction temperature on the yield of tartary buckwheat flavonoids

表2 正交试验设计及结果Tab.2 Orthogonal experiment design and results
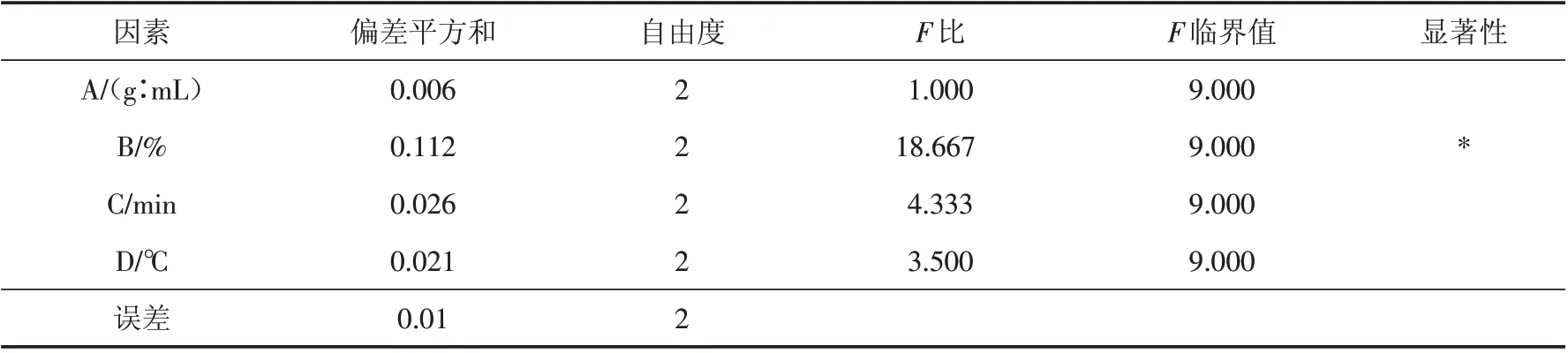
表3 苦荞黄酮的正交试验结果方差分析Tab.3 Variance analysis of orthogonal test results of tartary buckwheat flavonoids
3.4 制备胶囊颗粒的结果分析
3.4.1 混合粉末相对临界湿度 配置不同体积分数的硫酸,使干燥器中的相对湿度为20%、30%、40%、50%、60%、70%、80%. 将一定比例混合好的粉末(苦荞黄酮与辅料的混合物)置于其中,室温放置96 h后测吸湿率.通过Origin软件以切线法求出临界相对湿度为67.5%. 通过图6可以看出在相对湿度小于67.5%时混合粉末的吸湿率有增高趋势但变化不大,但当大于67.5%时混合粉末的吸湿率增高变化十分明显. 故在制备颗粒时实验室湿度需控制在67.5%以下.
3.4.2 休止角 通过表4 可以看出,苦荞黄酮胶囊颗粒的休止角为39.39°,休止角小于40°,说明制备的颗粒具有良好的流动性.

表4 休止角的测定Tab.4 Measurement of repose angle

图6 临界相对湿度Fig.6 Critical relative humidity
3.4.3 装样量差异分析《中国药典(2015 版)》胶囊要求:平均装量在0.3 g(含0.3 g)以上时装样量差异限度为±7.5%. 表5显示本试验平均装样量为0.413 05 g,装样量差异在±7.5%内,符合《中国药典》的要求.

表5 装样量差异测定Tab.5 Determination of difference in sample loading
3.5 胶囊稳定性试验分析
通过表6稳定性试验的结果可以看出,在6个月时间里,产品的形状、颜色、气味、质量、水分、黄酮含量及崩解时限均符合《中国药典(2015版)》胶囊剂的质量要求,制备的苦荞黄酮降血糖产品稳定性良好.
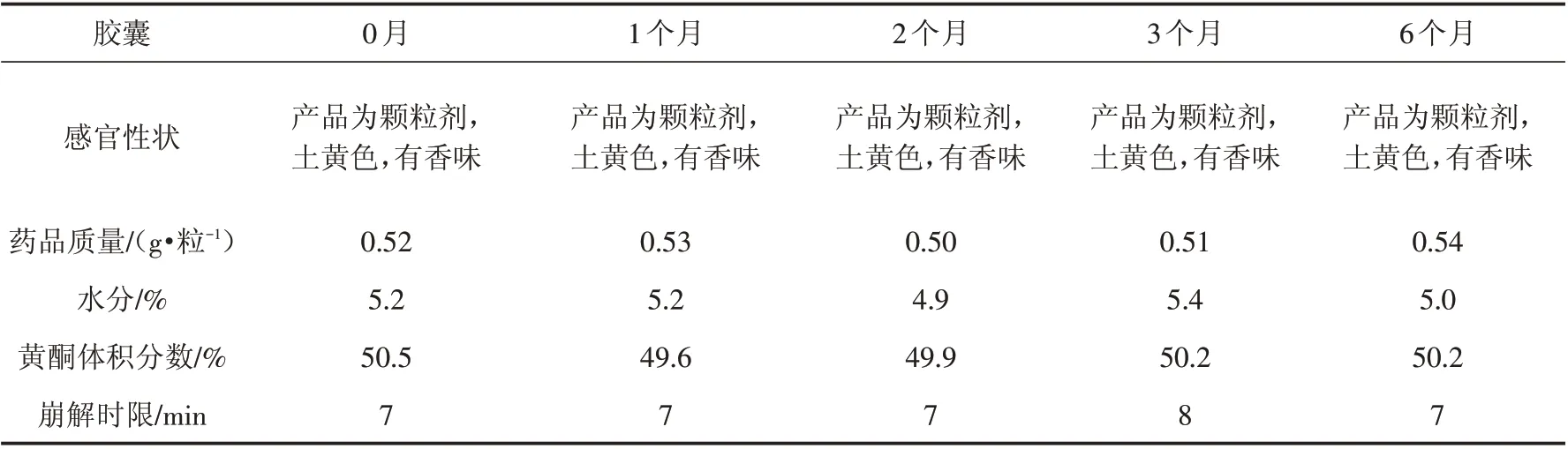
表6 苦荞黄酮胶囊加速稳定性试验Tab.6 Accelerated stability test of tartary buckwheat flavone capsules
4 结论
本试验通过正交试验以乙醇做溶剂提取苦荞黄酮,选辅料微晶纤维素、富铬酵母、硬脂酸镁混合制备胶囊颗粒,并对胶囊的稳定性进行研究. 结论如下:
1)提取苦荞黄酮的最佳工艺条件为料液比1∶8、乙醇体积分数60%、超声时间30 min、提取温度80 ℃,此工艺条件下对提取得率的影响顺序为乙醇体积分数、提取温度、超声时间、料液比,并测其得率为2.48%.
2)以微晶纤维素、富铬酵母和硬脂酸镁为辅料,体积分数85%的食品级乙醇为溶湿剂制粒,测其休止角为39.39°,表明其流动性很好.
3)制备胶囊,并测得其平均装样量为0.413 05 g,平均装样量差异很小. 采用保温加速试验方法测胶囊稳定性,各项指标均在质量规定范围内,表明药物性质比较稳定.
