四硫富瓦烯类染料敏化剂分子内电子转移特性
2020-03-25唐久超
唐久超
(中国石油大学(华东) 理学院, 山东 青岛 266580)
1 引 言
太阳能电池种类繁多,其中染料敏化太阳能电池(DSSCs)因Grätzel教授等将效率提升至7.1%~7.9%而引起了人们的广泛关注[1]。由于理论转换效率高、对温度和入射光角度依赖小、透明度高、在低光通量下仍有高转换率、原料丰富且无毒及可大规模生产等诸多优点,使得DSSCs逐渐成为太阳能光伏发电产业的重要分支,目前已实现超过13%的光电转换效率[1-2]。另外,DSSCs对研发条件及材料纯度要求较低,在形状、颜色及透明度等设计方面都具有很大灵活性[3]。
染料敏化剂是DSSCs中捕获与吸收太阳光、产生及传输电子的关键光电转换材料[4]。敏化剂分子种类繁多,其中金属中心配体染料敏化剂、纯有机分子染料敏化剂是研究较多且有较大进展的两类敏化剂。近年来,纯有机染料敏化剂相比于贵金属中心染料敏化剂,因其具有来源广泛、结构易调节、清洁无污染等诸多优势而得到研究者们的广泛研究[5-7]。理想中的纯有机染料敏化剂分子应该具有良好的太阳光捕获能力,其吸收光谱范围应该尽可能多地覆盖可见光区域和近红外光区域,并且需要具备良好的在半导体表面吸附与电子注入的性能。同时,敏化剂还应具有足够的再生驱动力以满足氧化态染料迅速的还原再生,从而抑制无效的电子复合。并且,为保证染料敏化太阳能电池的稳定性,敏化剂分子还需要具有适宜的光、电、化学稳定性等[8]。
传统的纯有机染料敏化剂基于供体-π桥-受体(D-π-A)结构,对供体、π桥和受体基团进行修饰可以显著改善染料敏化剂的整体性能从而提升DSSCs器件的性能。π桥位基团作为连接供受体的枢纽,是敏化剂分子的重要部位,对敏化剂的光捕获与吸收以及电子传输能力起着决定性的作用,因此研究者对π桥位基团进行修饰是研究高性能敏化剂的常用方法。其中,杂共轭原子环被广泛作为π桥用于染料敏化剂的分子结构中[9-12]。杂共轭原子环由多个杂原子环共轭连接构成,是一种兼具吸电子及供电子能力且电子导通性能良好的分子基团,另外,大多数杂共轭原子环具有刚性骨架结构,能够为染料提供平面性更好的分子结构,从而能够促进染料敏化剂分子内电荷转移过程的发生,同时通过将其杂原子替代为引入烷烃长链即可弥补其容易产生染料聚集的不足[13]。Wang等于2010年以杂共轭原子环作为π桥合成三苯胺类染料C219,可明显调整染料分子的能级且减小能隙,其转化效率达到10.4%[14]。Yamuna等于2017年以杂共轭原子环作为π桥合成烷基化并四噻吩(TTAR)类有机染料TTAR-b8,利用三维光子晶体层来增强相干散射以及增加光吸收,实现了11.18%的高PCE,且TTAR-b8是迄今为止报道的基于熔融噻吩的性能最佳的有机DSSCs染料[15]。Kim等于2017年引入杂共轭原子环作为π桥设计合成了SGT系列纯有机染料敏化剂,其中以thieno[3,2-b]indole (TI)基团作为π桥的染料SGT-136取得了高达12.45%的光电转化效率[10]。
四硫富瓦烯因其具有较强的供电子能力等优点而被广泛用于光电应用以及纯有机染料敏化剂分子的设计与合成中[16-17]。2014年,Liu等将四硫富瓦烯与喹喔啉融合物作为电子供体,设计合成了新型的TTF类纯有机染料敏化剂,呈现出了优异的光谱性能,获得了6.47%的光电转化效率[18]。2017年,Islam等基于硫代烷基取代的四硫富瓦烯作为电子供体基团,氰基丙烯酸作为锚定基团,设计合成了四硫富瓦烯类纯有机染料敏化剂,其中基于染料G3的DSSCs器件的光电转化效率达到7.15%[19]。同年,Islam等通过改变桥位基团和锚定基团设计合成了光电转化效率在4.55%~6.36%的四硫富瓦烯类纯有机染料敏化剂,提高了这类敏化剂的热稳定性以及器件的耐用性[20]。
为提高四硫富瓦烯类染料敏化剂的整体性能,本文采用DFT/TD-DFT方法[21],以G3作为参考染料,设计了一系列以不同杂共轭原子环作为桥位基团的四硫富瓦烯类纯有机染料敏化剂,并对其电子结构、捕获与吸收光性能、分子内及界面间电子转移性能进行了计算模拟研究,通过对比旨在筛选出性能优异的D-π-A型四硫富瓦烯类纯有机染料敏化剂,为实验研究提供理论解释与设计指导。
2 模型与方法
本文所设计的TTF类纯有机染料敏化剂的分子结构示意图如图1所示。我们主要探究了噻吩衍生物以及环戊联噻吩衍生物作为π桥时对TTF类染料敏化剂的光电性能的影响,进而筛选出性能较好的D-π-A型TTF类纯有机染料敏化剂。所设计的TTF类染料均以G3作为参考结构,以四硫富瓦烯基团衍生物作为电子供体,以氰基丙烯酸作为电子受体基团。我们在参考染料G3的基础上逐一引入并二噻吩、并三噻吩、环戊联噻吩及其衍生物基团,从而设计了四种新型染料TTF1~TTF4。
本文所设计的TTF类染料敏化剂的基态结构优化均采用B3LYP交换关联函数[22]和6-31G(d,p)基组[23]在二氯甲烷(DCM)溶液中完成。基于相同水平下的振动频率分析检验优化后基态构型的稳定性。基于优化构型,我们进一步采用相应的TD-DFT方法计算了染料的光谱特性及电子转移特性。DCM溶液效应通过非平衡的极化连续介质模型(C-PCM)模拟获得[24-25]。所有计算均由Gaussian 09软件包完成[26],分子内电子转移(IET)性能分析采用Multiwfn软件[27]完成。

图1 TTF类染料敏化剂的分子结构示意图
Fig.1 Molecular structures of TTF-based dyes
3 结果与讨论
3.1 前线分子轨道(FMOs)
分子轨道分析对于考察染料敏化剂的电荷分离态、电子注入以及染料还原再生等都具有十分重要的意义。根据分子轨道理论,电子激发过程主要发生在最高占据轨道(HOMOs)和最低未占分子轨道(LUMOs)之间。为形成良好的电荷分离态和有效的电子注入,通常需要染料敏化剂分子的最高占据分子轨道(HOMOs)上的大部分电子分布在供体基团,而最低未占分子轨道(LUMOs)上的电子更多地分布在受体基团上[28],即形成清晰的电荷分离态。图2展示了所设计TTF类染料敏化剂HOMO及LUMO轨道电子分布等密度图。
如图2所示,与参考染料G3类似,新设计的TTF类纯有机染料TTF1-4均展现出了适宜的前线分子轨道电子分布,其HOMO轨道上大多数电子分布于四硫富瓦烯衍生物供体基团上,少数电子分布于π桥基团,而LUMO轨道基本分布于π桥以及锚定基团上,因此其HOMO和LUMO两个轨道的电子分布形成了较好的电荷分离态,且在桥位部分有较好的重叠,当电子从HOMO到LUMO形成跃迁,将会非常有利于电子的分离以及促进电子从激发态染料注入半导体。
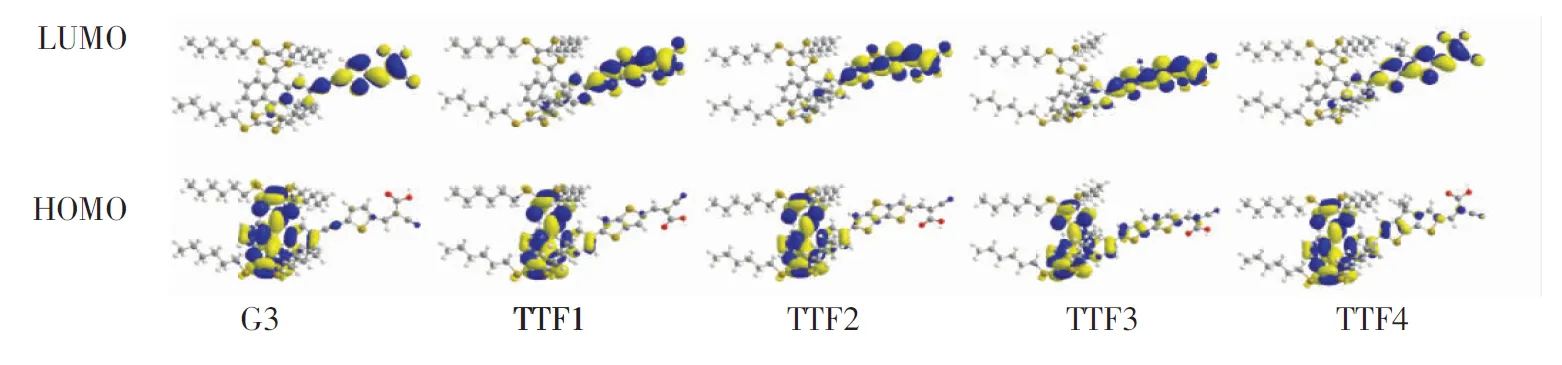
图2 TTF类染料敏化剂的前线分子轨道电子分布图
Fig.2 Electron contributions of the FMOs of TTF-based dyes
3.2 电子激发与吸收光谱
图3绘制出了所设计四硫富瓦烯类纯有机染料敏化剂的模拟紫外-可见吸收光谱。最大吸收波长以及其相对应吸收峰的有效受光跃迁的垂直激发能、吸收强度及相对轨道贡献等相关参数列于表1中。
如图3所示,五种TTF类纯染料敏化剂均具有典型纯有机染料敏化剂的两个主要的吸收带,分别是近紫外光区(350~400 nm)中的相对较窄的吸收带和可见光区(410~550 nm)中的相对较宽的吸收带。其中,第一个吸收带主要归因于TTF类染料主链的局域芳族环π-π*跃迁,第二个吸收带主要来源于分子中电子供体与电子受体之间的电荷转移。对于TTF类染料敏化剂,第二个吸收带是光电转化较为关键的吸收峰,因此我们也是主要对TTF类染料敏化剂在第二个吸收带中的最大吸收峰进行分析。
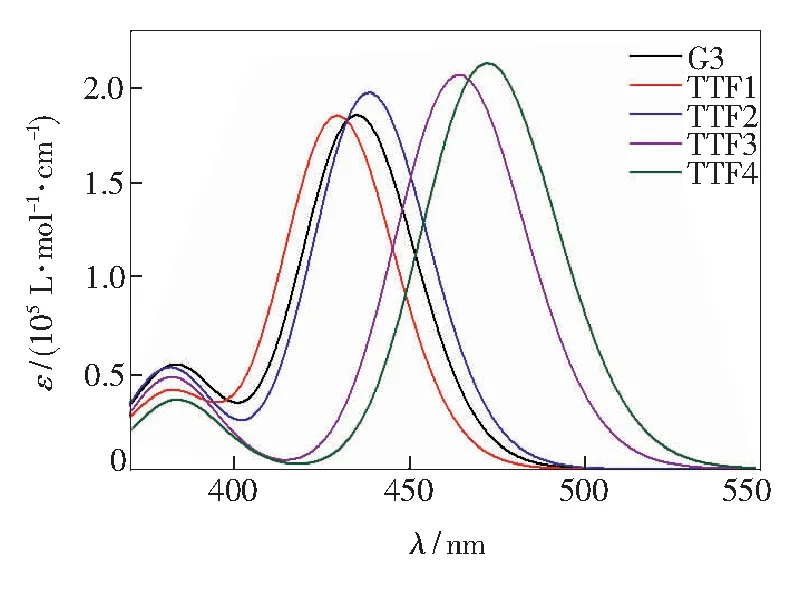
图3 TTF类染料敏化剂的模拟吸收光谱
五种TTF类染料敏化剂的最大吸收波长(λmax)按照以下序列排列:染料TTF4(472.1 nm)>染料TTF3(463.9 nm)>染料TTF2(438.3 nm)>染料G3(434.8 nm)>染料TTF1(429.2 nm)。相对于参考染料G3,所设计四硫富瓦烯类D-π-A型骨架结构的染料TTF2~TTF4的最大吸收峰均分别红移了3.5,29.1,37.3 nm,而TTF1的最大吸收峰蓝移了5.6 nm。五种TTF类染料敏化剂的摩尔消光系数(ε)按照以下序列排列:染料TTF4>染料TTF3>染料TTF2>染料G3>染料TTF1。通过分析发现,TTF类染料分子结构中π桥共轭性能的提升能够进一步拓展染料敏化剂的吸收光谱,同时提高了其吸收强度,且以环戊联噻吩及其衍生物作为π桥的染料TTF3和TTF4的最大吸收波长值最大。其中,染料TTF1与G3相比,由于并二噻吩基团的引入使得其供体与π桥基团的二面角增大,导致共轭程度降低,使得其吸收性能降低。
如表1所示,五种TTF类染料敏化剂的垂直激发能(EA)按照以下序列排列:染料TTF4(2.63 eV)< 染料TTF3(2.67 eV)<染料TTF2(2.83 eV)<染料G3(2.85 eV)<染料TTF1(2.89 eV)。对于光谱的覆盖区域来说,染料TTF1~TTF4相对于G3来说表现出明显的红移和蓝移趋势,这与其最低垂直激发能EA的变化趋势是一致的。根据上述分析可以总结出,染料TTF2、TTF3和TTF4中的桥位基团可以有效地降低EA,进而获得红移的吸收光谱。
此外,以环戊联噻吩及其衍生物作为π桥的染料TTF3和TTF4也表现出了略宽于以噻吩及其衍生物作为π桥的染料TTF1和TTF2的光谱吸收范围,说明在这类染料中环戊二噻吩及其衍生物基团引入后可以更好地提升光吸收性能。另一方面,染料TTF2~TTF4相对于参考染料G3均具有更高的最大吸收峰强度,从而进一步证明了其更优的光谱性能。
表1 TTF类染料最大吸收峰对应光跃迁的垂直激发能(EA)、吸收强度()、相对轨道贡献以及最大光捕获效率和相对光捕获效率
Tab.1 Excitation energies(EA), absorption intensities(), relative orbital contributions, and LHEmaxand RLHE for the optical transition of TTF-based dyes
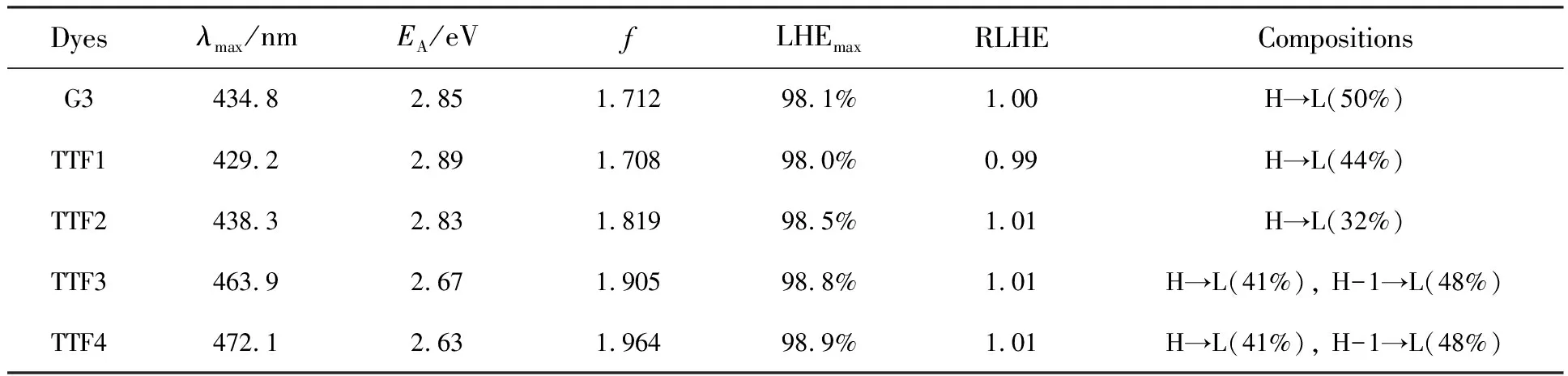
Dyesλmax/nmEA/eVfLHEmaxRLHECompositionsG3434.82.851.71298.1%1.00H→L(50%)TTF1429.22.891.70898.0%0.99H→L(44%)TTF2438.32.831.81998.5%1.01H→L(32%)TTF3463.92.671.90598.8%1.01H→L(41%), H-1→L(48%)TTF4472.12.631.96498.9%1.01H→L(41%), H-1→L(48%)
从表1中可以发现,参考染料G3在434.8 nm处振子强度为1.712的最大吸收峰,主要有效轨道跃迁来自于HOMO →LUMO(50%),以并二噻吩和并三噻吩作为π桥的染料TTF1和TTF2的最大吸收峰的主要有效轨道跃迁的贡献与参考染料G3相似,其中染料TTF1主要是来自于HOMO →LUMO(44%)跃迁的相对贡献,染料TTF2主要是来自于HOMO→LUMO (32%)跃迁的相对贡献。而以环戊联噻吩以及其衍生物作为π桥的染料TTF3和TTF4分别在吸收峰463.9 nm(f=1.905)和472.1 nm(f=1.964)处的电子激发主要是由相同的HOMO/HOMO-1到LUMO的混合跃迁组成,其中41%来自HOMO→LUMO,48%来自HOMO-1→LUMO。由前线分子轨道分析可知,混合跃迁主要是由电子从供体基团和桥位基团跃迁到受体基团和桥位基团组成,LUMO作为受体轨道时可以实现较好的电荷分离和电子注入。
综合上述分析可知,以环戊联噻吩以及其衍生物作为π桥的TTF类纯有机染料敏化剂相对于以噻吩衍生物作为π桥的TTF类纯有机染料敏化剂具有更优的吸收光谱性能,主要表现为更宽的光吸收覆盖范围、更高的最大吸收峰强度及更加适宜的最大吸收峰的轨道跃迁相对贡献。
3.3 光捕获效率(LHE)
光捕获效率是影响入射光电转化效率的重要因素,其代表敏化剂捕获光和产生光电流响应的能力,并且可直接反映出染料捕获光子能力的强弱。我们主要从两方面考察了所设计研究的四硫富瓦烯类纯有机染料敏化剂光捕获效率,第一方面是最强吸收峰所对应的最大光捕获效率值ηLHEmax。ηLHEmax的计算公式如下[29]:
ηLHEmax=1-10-A=1-10-f,
(1)
其中,A(f)表示与λmax对应的振子强度。计算得到的TTF类染料的ηLHEmax以及相对光捕获效率值ηRLHE(ηRLHE=ηLHEmax(dyes)/ηLHEmax(G3))均见表1。
第二方面是光捕获覆盖的光谱范围,其计算公式如下[30]:
ηLHE=1-10-ε(λ)bc,
(2)
式中,ε(λ)是对应波长下的摩尔消光系数,b和c分别是薄膜的厚度和染料的浓度(实验值通常为10 μm 和 300 mmol·L-1)[31-32]。
从表1中可以看出,五种TTF类染料敏化剂的振子强度(f)按照以下序列排列:染料TTF4(1.964)>染料TTF3(1.905)>染料TTF2(1.819)>染料G3(1.712)>染料TTF1(1.708)。相对于参考染料G3,以并三噻吩及环戊联噻吩及其衍生物基团作为π桥的染料TTF2~TTF4的振子强度均增大,从而使其染料的LHEmax值由参考染料G3的98.1%提升至98.9%,其RLHE值均增大了0.01,提高了光捕获效率,而含并二噻吩的染料TTF1的光捕获效率略微减小。更重要的是,以环戊联噻吩及其衍生物基团作为π桥时,TTF类染料的光捕获效率最高,说明环戊联噻吩及其衍生物的引入可以更好地提升染料敏化剂的光捕获能力,从而可以进一步提升其入射光电转换效率。
图4是所研究TTF类染料敏化剂的光捕获效率光谱图。如图4所示,五种四硫富瓦烯类染料敏化剂的光捕获效率光谱的波长范围变化与其吸收光谱表现出同样的趋势,即含并三噻吩和环戊联噻吩及其衍生物基团的染料TTF2~TTF4均呈现出相较于参考染料G3更宽的光捕获范围,且含环戊联噻吩及其衍生物基团的染料具有比含噻吩衍生物基团的染料更宽的光捕获范围。
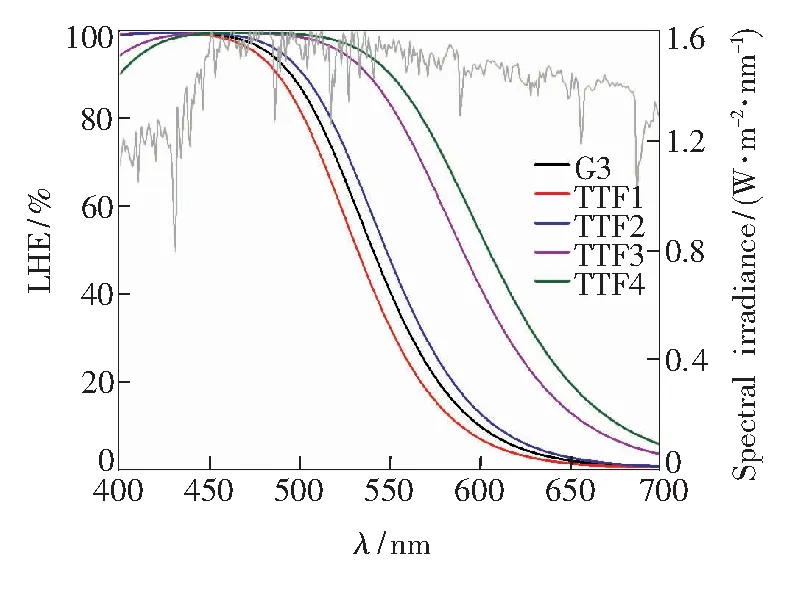
图4 TTF类染料敏化剂的模拟LHE光谱
综上所述,以并三噻吩和环戊联噻吩及其衍生物基团作为π桥的TTF类纯有机染料敏化剂具有更优的光捕获性能,包括更大的光捕获效率和更宽的光捕获光谱范围。
3.4 染料敏化剂IET性质
染料敏化剂在捕获光子后,通过分析染料分子受光激发产生的电子在其分子内部的转移过程来考察染料光电转换与输运性能。
图5所示为TTF类染料基态与激发态之间的电荷密度差分(Δρ)图,其中红色等密度区域代表电子减小的区域,绿色等密度区域代表电子增大的区域。由图5可以看出,所设计的TTF类染料均发生了有效的IET反应过程,即电子密度增加的区域主要集中在电子受体基团,而电子密度减小的区域则主要集中在电子供体基团上,即电子由电子供体部分向电子受体部分转移,呈现出了长程的电荷分离态,反映了电子供体良好的供电子能力。此外,电子转移过程后的电子富集于锚定基团,有利于由染料向半导体的电子注入。
之后又计算了TTF类染料敏化剂相应的IET特性,包括IET转移电量(qET)、转移距离(dET)、H和t指数、电子转移重组能(Ev)以及IET速率(kET)等,结果列于表2中。
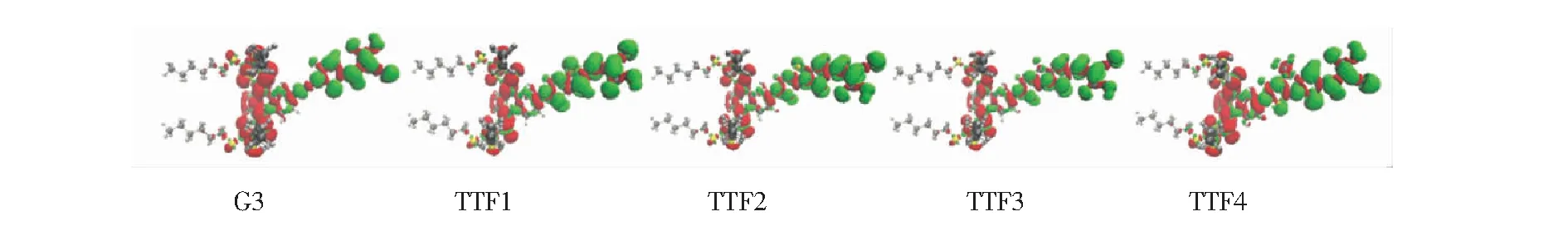
图5 TTF类染料敏化剂基态与激发态之间的电荷密度差分图
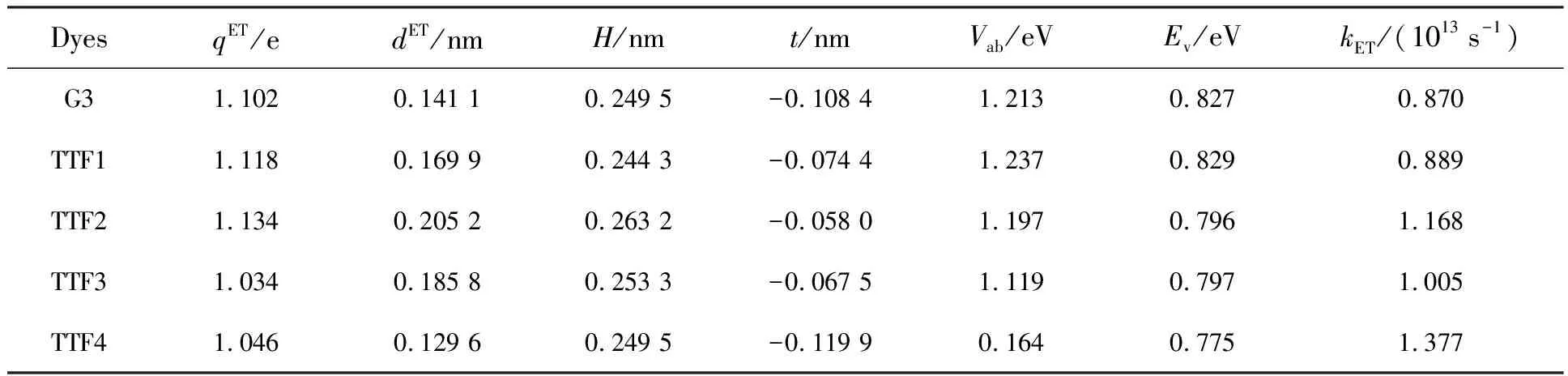
表2 TTF类染料敏化剂的IET参数
电子转移速率kET计算公式如下[33]:
(3)
其中,ћ=h/2π,h为普朗克常数,KB为玻尔兹曼常数,Vab为电子耦合系数。
如表2所示,所研究的TTF类纯有机染料敏化剂均能够在IET反应过程中转移足量的电子,且能够将电子转移至足够远的距离,即表现出了与图5结果一致的长程IET过程,同时均具有较小轨道重叠t值,说明得失电子轨道重叠程度较小。TTF类染料敏化剂的IET速率(kET)按顺序排列:染料TTF4(1.377×1013s-1)>染料TTF2(1.168×1013s-1)>染料TTF3(1.005×1013s-1)>染料TTF1(0.889×1013s-1)>染料G3(0.870×1013s-1)。可以发现所设计的具有不同π桥的染料TTF1~TTF4的IET速率均大于参考染料G3的IET速率,说明对TTF类染料敏化剂结构的修饰可以增大分子内电子转移速率,整体提升TTF类染料敏化剂的IET性能。
4 结 论
本文主要通过结构修饰来改善TTF类纯有机染料敏化剂的性能,利用DFT/TD-DFT方法设计了一系列具有不同π桥的TTF类纯有机染料敏化剂,通过分析敏化剂的几何结构、分子轨道、电子激发和吸收光谱、光捕获效率以及分子内电子转移,对其光电特性及分子内电子转移性质进行了理论研究。结果表明,引入噻吩衍生物及环戊二噻吩衍生物作为TTF类染料敏化剂的桥位基团能够有效改善其整体性能,提升了光吸收与捕获性能、优化轨道电子分布。相比于参考染料G3,染料TTF4 的LHEmax提升至98.9%,其IET速率加快至1.377×1013s-1等。其中以环戊二噻吩衍生物作为π桥时对性能改善效果最佳,包括较适宜电荷分离态、拓宽的光谱吸收范围、提升的光捕获效率以及增强的分子内电荷转移性能等。本文研究的一系列高性能的四硫富瓦烯类染料敏化剂,不仅为设计和筛选性能优异的染料敏化剂起到很好的理论指导作用,还为实验合成提供了设计思路,具有重要的实际应用意义。
