变异猪流行性腹泻病毒M和N双基因融合真核表达及其活性鉴定
2020-03-24王隆柏陈秋勇吴学敏陈如敬车勇良周伦江
王隆柏 陈秋勇 吴学敏 陈如敬 车勇良 周伦江

摘要:【目的】體外表达变异猪流行性腹泻病毒(PEDV)的M-N双基因融合蛋白并明确其生物活性,为开展PEDV新型疫苗及其诊断技术研究提供更多的候选蛋白。【方法】将变异PEDV的M基因克隆至pEASY-Blunt M2(pM2)真核表达载体构建pM2-M真核质粒,通过同源重组将N基因克隆至M2-M基因片段构建pM2-M-N双基因融合重组质粒,然后转染293T细胞表达出M-N双基因融合蛋白。通过Western blotting、ELISA及免疫BLAB/c小鼠试验鉴定表达融合蛋白的生物学活性。【结果】扩增获得的M基因、N基因片段大小分别为678和1359 bp,且与原序列的相似性均达100.0%。将M基因和N基因并连接至pM2真核表达载体成功构建获得pM2-M-N双基因融合重组质粒,M-N双基因片段大小为2004 bp,且与原序列的相似性为99.3%。以pM2-M-N双基因融合重组质粒转染239T细胞,表达出大小约75 kD且具有免疫活性的M-N双基因融合蛋白,纯化的M-N双基因融合蛋白能与PEDV阳性血清反应,与猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)、猪瘟病毒(CSFV)、猪传染性胃肠炎病毒(TGEV)等病毒均无交叉反应;以其免疫BLAB/c小鼠能诱导产生特异性抗体。【结论】通过pM2真核表达载体能构建获得变异PEDV毒株的pM2-M-N融合双基因重组质粒,转染293T细胞后可表达出具有良好免疫活性的M-N双基因融合蛋白,为后期开展变异PEDV基因工程疫苗及其诊断技术研究提供更多的候选蛋白。
关键词: 猪流行性腹泻病毒(PEDV);M基因;N基因;双基因;融合蛋白
中国分类号: S852.43 文献标志码: A 文章编号:2095-1191(2020)12-3083-07
Abstract:【Objective】The protein of M-N double gene fusion protein plasmid of variant porcine epidemic diarrhea virus(PEDV) was expressed in vitro,and clarified the immunological activity of the protein,more candidate fusion proteins were provided to carry out research on new vaccines and diagnostic technologies for PEDV. 【Method】The M gene of variant PEDV was cloned into pEASY-Blunt M2(pM2) eukaryotic expression vector and pM2-M eukaryotic plasmid was built, then N gene was cloned into M2-M gene fragment to construct pM2-M-N double gene fusion recombinant plasmid by homologous recombination, and transformed into 293T cell, M-N double gene fusion protein was expressed accordingly. Biological activity of expressing fusion protein was tested by Western blotting, ELISA and immunity BLAB/c mice test. 【Result】The amplified fragments of M gene and N gene were 678 and 1359 bp respectively, and the similarities compared with the original sequence were both 100.0%. The M gene and N gene were linked into pM2 eukaryotic expression vector, and pM2-M-N double gene fusion recombinant plasmid was built. The amplified fragments of M-N double fusion genes was 2004 bp, and the similarity was compared with the original sequence was 99.3%. pM2-M-N double gene fusion recombinant plasmid transfected 239T cells, and M-N double gene fusion protein(about 75 kD) with immunological competence. The purified M-N double gene fusion protein could react with PEDV positive serum. The fusion protein had no crossreactions with porcine reproductive and respiratory syndrome virus(PRRSV), pseudorabies virus(PRV), porcine circovirus type 2(PCV2), classical swine fever virus(CSFV) and porcine transmissible gastroenteritis virus(TGEV). The BLAB/c mice immunized by it could produce specific antibody. 【Conclusion】The pM2-M-N fusion double gene recombinant plasmid of variant PEDV can be constructed by pM2 eukaryotic expression vector, the M-N double fusion protein with immunological competence is expressed after 293T cell being transfected. More candidate fusion proteins are provided to carry out genetic engineering vaccines and diagnostic techniques for variant PEDV.
Key words: porcine epidemic diarrhea virus(PEDV); M gene; N gene; double genes; fusion protein
Foundation item: Basic Research Project of Fujian Public Welfare Research Institutes(2018R1023-4); Fujian Mo-dern Agricultural Pig Industry Technology System Construction Project(Minnongzong〔2019〕144)
0 引言
【研究意義】猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起,以发病猪呕吐、腹泻、脱水及发病哺乳仔猪高致死率为特征的肠道传染病(Chang et al.,2002;杨晓宇等,2018)。PED最早于1978年在英国报道,随后蔓延至欧洲,我国于1980年首次报道。由于商品化疫苗的广泛使用,该病在一定程度上得到有效控制。但至2010年底,因PEDV变异,原有商品化疫苗对猪群的保护效果不佳,从而致使PED在我国再次大规模暴发流行;且2013年在墨西哥、美国及加拿大等欧美养猪国家也相继再次暴发流行(Huang et al.,2013;Pasick et al,2014;Sun et al.,2016)。因此,开展PEDV变异研究,尤其对变异的结构蛋白M和N双基因进行融合表达,可为进一步研究变异PEDV新型基因工程疫苗及其诊断技术提供候选蛋白。【前人研究进展】PEDV隶属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),其病毒核酸为正义单链RNA,PEDV基因组全长约28 kb(Vlasova et al.,2014),主要结构蛋白有膜蛋白(M)、核衣壳蛋白(N)、小膜蛋白(E)和突糖蛋白(S)(Brian and Baric,2005)。M蛋白是PEDV重要的结构蛋白,在病毒粒子组装及出芽过程中发挥重要作用,能刺激机体产生免疫保护抗体,并介导机体产生α干扰素,可作为新疫苗的候选抗原(Gao et al.,2007)。N蛋白在病毒结构中属于较大的蛋白,在感染宿主细胞内能大量表达,猪群在感染早期即能检测到较高水平的N蛋白抗体(Li et al.,2009;祁光宇等,2018);此外,N蛋白是病毒主要的免疫原蛋白之一,可刺激机体产生有效的免疫应答,抑制细胞产生干扰素,还能诱导辅助特异性体液免疫的Th细胞增殖(Vlasova et al.,2014)。S蛋白具有B淋巴细胞抗原决定簇和宿主细胞氨肽酶受体(PAPN)的识别位点,对病毒的吸附、融合及侵入宿主细胞等过程起重要作用,且在感染宿主体内介导中和抗体产生(Mariela and Laude,1994;Yeo et al.,2003)。E蛋白决定病毒的形状,参与病毒包膜形成和出芽过程,还能诱导细胞凋亡。虽然M基因和N基因相对较保守,但2010年底发现的PEDV变异毒株与经典CV777毒株及早些年份分离获得的毒株相比较,其氨基酸序列已发生变异,在构建的遗传进化树上也处于不同分支(王隆柏等,2014;胡凌等,2015;宋聪等,2016)。至今,已有利用PEDV单个基因片段成功建立ELISA抗体检测方法,并研制出基因工程口服疫苗。姜艳平等(2008)研究表明,以原核表达的重组N蛋白作为检测抗原在监测PEDV感染及评价疫苗免疫效果方面具有较高的应用价值,是代替全病毒作为检测抗原的良好选择。向敏等(2013)将编码PEDV部分S蛋白的保护性抗原基因(COE)插入载真核表达载体pIRES2-EGFP成功构建获得COE核酸疫苗。朱卫霞等(2014)应用原核表达系统成功实现PEDV的N蛋白可溶性表达,并证实该蛋白具有良好的完全抗原活性。姚作俊等(2017)基于S1蛋白成功建立了检测PEDV抗体的间接ELISA方法。朱文姣等(2018)将COE基因克隆至原核表达载体pET-32a(+)构建重组表达质粒pET-32a-COE,经IPTG诱导表达获得的融合蛋白能与抗PEDV的阳性血清发生特异性结合,即具有良好的免疫原性,作为免疫抗原制备的卵黄抗体具有较高抗体效价。【本研究切入点】M基因和N基因是PEDV疫苗研制及其诊断技术重要基因,但至今鲜见基于同源重组原理通过真核表达载体表达出PEDV M-N双基因融合蛋白的研究报道。【拟解决的关键问题】基于同源重组原理,以PEDV变异毒株为研究对象、pEASY-Blunt M2(pM2)为真核表达载体,利用无缝拼接技术构建M和N的双基因质粒并在体外表达出M-N双基因融合蛋白,明确M-N双基因融合蛋白的生物活性,为开展PEDV新型疫苗及其诊断技术研究提供更多的候选蛋白,也为今后开展其他融合蛋白的研究提供技术借鉴。
1 材料与方法
1. 1 试验材料
RNA提取试剂盒、pM2真核表达载体、FastPfu Fly DNA聚合酶、pEASY-UniSeamless Cloning and Assembly Kit、dNTPs、TransStart? KD Plus DNA聚合酶、Trans1-T1感受态细胞及EQKLISEEDL融合蛋白纯化试剂盒等购自北京全式金生物技术有限公司;10%分离胶和转印膜购自上海碧云天生物技术有限公司;羊抗鼠/羊抗兔HRP酶购自武汉博士德生物工程有限公司;BLAB/c小鼠购自福州吴氏实验动物贸易有限公司;PEDV阴性血清购自BioNote公司;变异PEDV-FJFQ2014毒株和兔抗高免血清由福建省农业科学院畜牧兽医研究所保存提供。
1. 2 试验方法
2 结果与分析
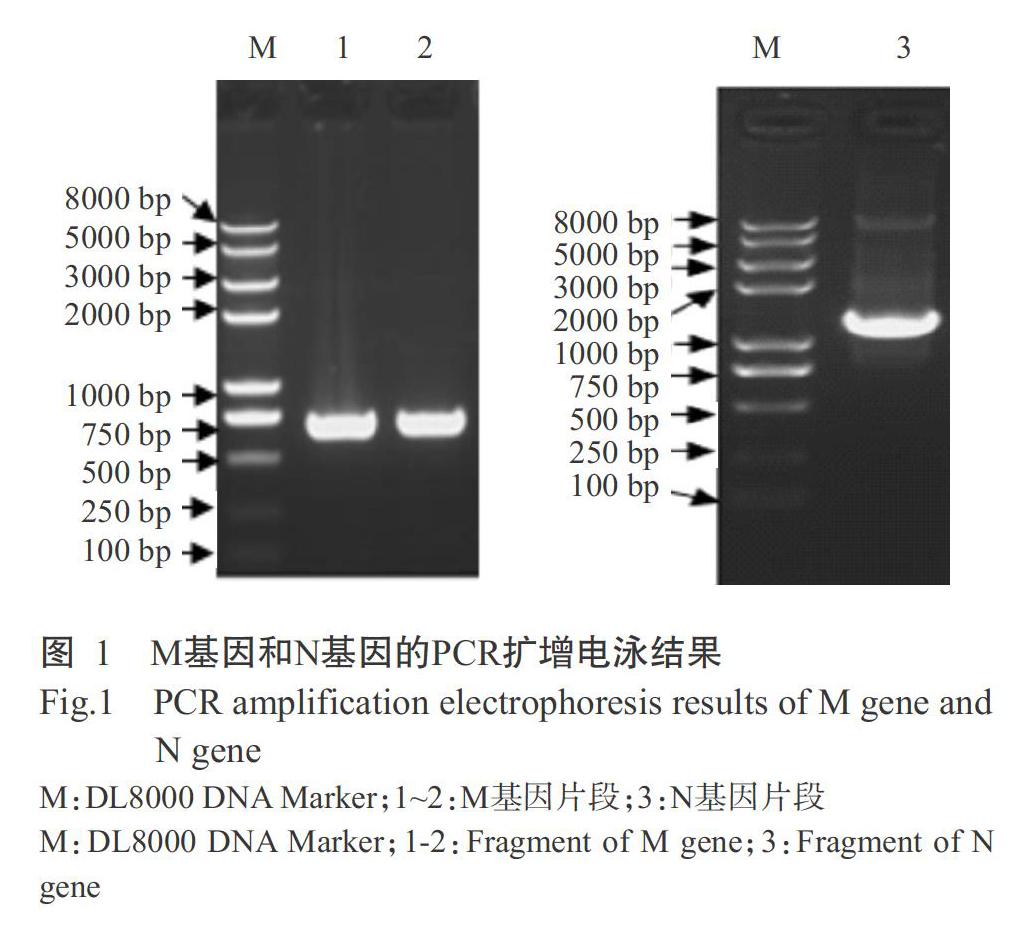
2. 1 M基因和N基因PCR扩增结果
以cDNA为模板,分别进行M基因和N基因PCR扩增,采用1.5%琼脂糖凝胶电泳进行检测,结果(图1)显示,扩增获得的M基因、N基因片段大小约为700和1400 bp,与预期结果相符。经测序得知,扩增获得的M基因、N基因片段大小分别为678和1359 bp,且与原序列的相似性均达100.0%。
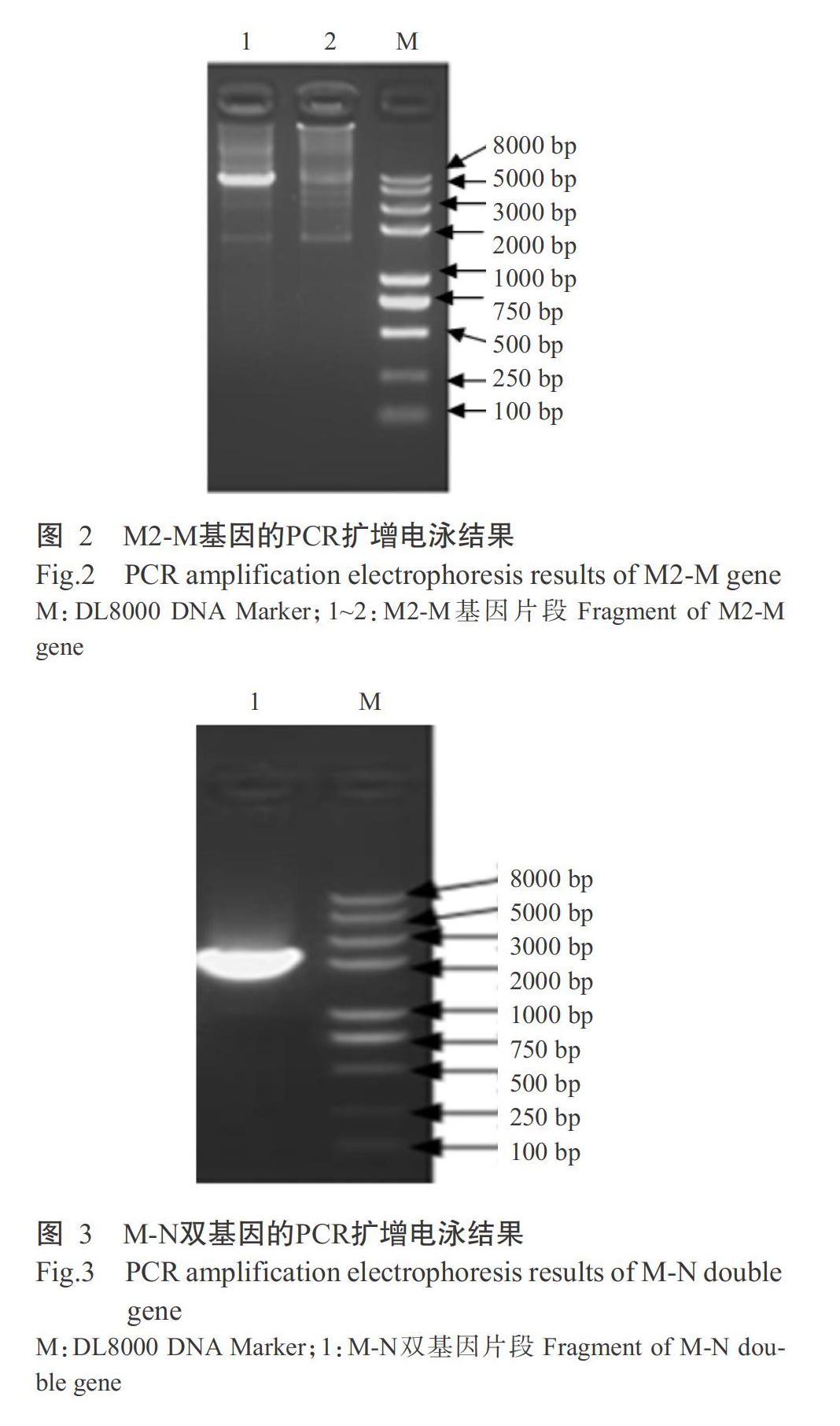
2. 2 pM2-M真核质粒PCR鉴定结果
将M基因与pM2真核表达载体进行连接,转化Trans1-T1感受态细胞,通过PCR鉴定M2-M阳性单克隆,结果获得约6100 bp的片段(图2),与预期结果相符。经测序得知,扩增获得的M2-M基因片段大小为6104 bp,且与原序列的相似性为99.4%。
2. 3 pM2-M-N双基因融合重组质粒PCR鉴定结果
将扩增获得的M2-M基因片段与N基因片段进行无缝拼接,然后全部转化Trans1-T1感受态细胞,通过PCR鉴定M-N阳性单克隆,结果获得约2000 bp的基因片段(图3),与预期结果相符。经测序得知,M-N双基因片段大小為2004 bp,且与原序列的相似性为99.3%。
2. 4 融合蛋白SDS-PAGE电泳分析结果
在pM2-M-N重组质粒转染的293T细胞中,使用10%分离胶进行SDS-PAGE电泳分析,结果显示约在75 kD处检测到对应的目的蛋白条带(图4),而在pM2真核表达载体转染的293T细胞中未检测到对应的目的蛋白条带。
2. 5 融合蛋白纯化结果
按EQKLISEEDL融合蛋白纯化试剂盒说明对原核表达的M-N双基因融合蛋白进行纯化,其SDS-PAGE电泳分析结果表明,纯化的M-N双基因融合蛋白大小约75 kD(图5),与预期结果相符。
2. 6 融合蛋白表达的Western blotting鉴定结果
Western blotting鉴定结果表明,pM2-M-N重组质粒转染293T细胞的总蛋白能与变异PEDV兔抗高免血清反应,获得约75 kD的目的蛋白条带(图6),而pM2真核表达载体转染293T细胞及未转染293T细胞的总蛋白检测结果均呈阴性,进一步说明以pM2-M-N重组质粒转染293T细胞能表达获得M-N双基因融合蛋白,且具有免疫活性。
2. 7 融合蛋白免疫活性的ELISA检测结果
ELISA检测结果(图7)表明,纯化的M-N双基因融合蛋白与PRRSV阳性血清、PRV阳性血清、CSFV阳性血清、PCV2阳性血清及TGEV阳性血清的OD490均小于PEDV阴性血清的OD490,呈阴性,未发生交叉反应;而与PEDV阳性血清的OD490为1.354,说明纯化的M-N双基因融合蛋白能与PEDV阳性血清反应,即具有免疫活性。
2. 8 融合蛋白免疫小鼠的抗体检测结果
以纯化的M-N双基因融合蛋白免疫小鼠后未出现异常临床症状。由图8可看出,二次免疫第1 d在小鼠血清中已能检测到特异性抗体,随后小鼠血清抗体水平逐渐升高,至二次免疫第28 d其血清抗体水平达最高值,OD490为1.771;而阴性对照小鼠血清未检测到相应的抗体,表明注射纯化的M-N双基因融合蛋白能诱导小鼠产生特异性抗体。
3 讨论
鉴于基因组学技术的快速发展,有目的地将两段或多段编码功能蛋白的基因首尾拼接在一起,由同一调控序列控制构成的基因表达后所获得的蛋白产物称为融合蛋白。当前,融合蛋白在双功能酶(多功能酶)、定向药物、溶栓剂及抗菌肽等方面已得到广泛应用。郭建强等(2009)利用pStar、pShuttle-CMV和pGEM-T Easy Vector等3个载体,成功构建出Ad-M1-HA重组腺病毒载体,并在293T细胞中表达出具有免疫原性的融合蛋白。黄小波等(2012)利用pVAX载体构建了TGEV的pVAX-S-N真核重组质粒,以其免疫小鼠也能产生特异性抗体,为TGEV基因工程疫苗研究打下了基础。鉴于M蛋白和N蛋白在PEDV复制及产生免疫功能过程中发挥的重要作用,且至今未见表达变异PEDV毒株M-N双基因融合蛋白的相关研究报道。因此,开展M-N双基因融合蛋白研究可为开展PEDV新型疫苗及其诊断技术研究提供更多的候选蛋白,同时为开展其他融合蛋白的研究提供技术借鉴。
有关PEDV结构蛋白表达的研究,姜艳平等(2008)、向敏等(2013)、朱卫霞等(2014)、姚作俊等(2017)已成功表达出单个N蛋白和截断的S蛋白,并建立了针对N蛋白或S蛋白的ELISA抗体检测方法。王隆柏等(2018)利用pE2原核表达载体在Transetta(DE3)感受态细胞中表达出PEDV的M-N融合双基因蛋白,并证实其具有免疫活性,但该融合蛋白主要以包涵体形式表达,因此溶解纯化相对较困难。本研究选用pM2真核表达载体,利用同源重组和无缝拼接技术,将PEDV的M基因和N基因进行融合,通过增强型CMV启动子高效表达目的基因,转化Trans 1-T1感受态细胞,构建pM2-M-N重组质粒并转染至293T细胞表达出M-N双基因融合蛋白,结果发现在293T细胞及其培养上清液中均能检测到M-N双基因融合蛋白,易于收集和纯化,且具有免疫活性。
本研究结果表明,以pM2-M-N双基因融合重组质粒转染293T细胞表达获得的M-N双基因融合蛋白具有良好免疫活性,且能诱导BLAB/c小鼠产生相应的特异性免疫抗体。通过真核系统表达获得的蛋白,较利用原核载体表达出的蛋白具有天然活性,更适用于免疫功能研究。可见,M-N双基因融合蛋白的成功表达为后期开展变异PEDV基因工程疫苗及其诊断技术研究提供更多的候选蛋白。此外,在基因连接和载体构建方面,pM2真核表达载体两端偶联有拓扑异构酶,此酶具有限制性内切酶和连接酶的功能,构建重组质粒时只需将真核表达载体与特异性基因片段在25 ℃下孵育5~10 min即可获得连接产物,与常规真核表达方法相比,具有反应时间短、操作简单的特点,为其他病毒直接融合相邻双基因载体的构建提供了技术借鉴。
4 结论
通过pM2真核表达载体能构建获得变异PEDV毒株的pM2-M-N融合双基因重组质粒,转染293T细胞后可表达出具有良好免疫活性的M-N双基因融合蛋白,为后期开展变异PEDV基因工程疫苗及其诊断技术研究提供更多的候选蛋白。
参考文献:
郭建强,姚立红,陈爱珺,徐一,贾润清,薄洪,董婕,周剑芳,舒跃龙,张智清. 2009. 共表达甲型流感病毒M1和HA双基因的重组腺病毒的构建及鉴定[J]. 病毒学报,25(2):107-112. [Guo J Q,Yao L H,Chen A J,Xu Y,Jia R Q,Bo H,Dong J,Zhou J F,Shu Y L,Zhang Z Q. 2009. Construction of recombinant adenovirus co-expressing M1 and HA genes of influenza virus type A[J]. Chinese Journal of Virology,25(2):107-112.]
胡凌,王印,杨泽晓,姚学萍,林星宇,李桂黎,彭善珍,陈平,邬旭龙. 2015. 7株猪流行性腹泻病毒M基因的克隆与分析[J]. 中国兽医學报,35(8):1404-1408. [Hu L,Wang Y,Yang Z X,Yao X P,Lin X Y,Li G L,Peng S Z,Chen P,Wu X L. 2015. Cloning and sequence analysis of M gene of seven strain porcine epidemic dirrhea viruses[J]. Chinese Journal of Veterinary Sciences,35(9):1404-1408.]
黄小波,李春松,杨恒,曹三杰,文心田,廖晓丹,张鑫淼. 2012. 携带猪传染性胃肠炎病毒S/N融合双基因的减毒沙门氏菌的构建与鉴定[J]. 畜牧兽医学报,43(8):1273-1280. [Huang X B,Li C S,Yang H,Cao S J,Wen X T,Liao X D,Zhang X M. 2012. Construction and identification of attenuuuated Salmonella typhimutium harbouring S/N double fusion genes of porcine transmissible gastroen-teritis virus[J]. Acta Veterinaria et Zoorechnica Sinica,43(8):1273-1280.]
姜艳平,葛俊伟,汪淼,刘兆磊,裴敦国,韩梓峰,李一经. 2008. 猪流行性腹泻病毒重组核蛋白作为检测抗原的初步应用[J]. 中国预防兽医学报,30(8):587-591. [Jiang Y P,Ge J W,Wang M,Liu Z L,Pei D G,Han Z F,Li Y J. 2008. Preliminary application of the recombinant nucleocapsid protein of porcine epidemic diarrhea virus LJB/03 as detecting antigen in diagnostic assays[J]. Chinese Journal of Preventive Veterinary Medicine,30(8):587-591.]
祁光宇,刘斌,赵兴绪. 2018. 猪流行性腹泻病毒HB2015分离株N基因表达及单克隆抗体的制备[J]. 江苏农业学报,34(1):76-80. [Qi G Y,Liu B,Zhao X X. 2018. Expre-ssion of N gene of porcine epidemic diarrhea virus (PEDV) HB2015 strain and preparation of monoclonal antibodies against PEDV[J]. Jiangsu Journal of Agricultural Sciences,34(1):76-80.]
宋聪,刘宁,李美荃,石於友,李华春,高林,杨荣丽,姚俊. 2016. 猪流行性腹泻病毒云南流行毒株N基因序列分析[J]. 动物医学进展,37(5):15-19. [Song C,Liu N,Li M Q,Shi Y Y,Li H C,Gao L,Yang R L,Yao J. 2016. Sequence analysis of N gene of porcine epidemic diarrhea virus epidemic strains in Yunnan Province[J]. Progress in Veterinary Medicine,37(5):15-19.]
王隆柏,林裕胜,车勇良,吴学敏,陈如敬,邵良平,周伦江. 2014. 猪流行性腹泻病毒S、N和ORF3基因的遗传变异分析[J]. 畜牧兽医学报,45(11):1830-1836. [Wang L B,Lin Y S,Che Y L,Wu X M,Chen R J,Shao L P,Zhou L J. 2014. Genetic variation analysis of S,N and ORF3 genes of porcine epidemic diarrhea virus[J]. Acta Veterinariaet Zoorechnica Sinica,45(11):1830-1836.]
王隆柏,王晨燕,吴学敏,陈秋勇,车勇良,陈如敬,周伦江. 2018. 变异猪流行性腹泻病毒M和N融合双基因的原核表达及表达产物免疫原性分析[J]. 畜牧兽医学报,49(6):1249-1255. [Wang L B,Wang C Y,Wu X M,Chen Q Y,Che Y L,Chen R J,Zhou L J. 2018. Prokaryotic expression and immunogenic analysis of the combined M and N fusion genes for variant porcine epidemic diarrhea virus[J]. Acta Veterinaria et Zoorechnica Sinica,49(6):1249-1255.]
向敏,張洁,高其双,卢顺,陈志华,黄海军,陶弼菲,彭霞,占才耀,夏瑜,童伟文,华娟,王连芳. 2013. 猪流行性腹泻病毒COE核酸疫苗的构建及免疫原性[J]. 中国兽医学报,33(11):1627-1630. [Xiang M,Zhang J,Gao Q S,Lu S,Chen Z H,Huang H J,Tao B F,Peng X,Zhan C Y,Xia Y,Tong W W,Hua J,Wang L F. 2013. Construction of DNA vaccine of porcine epidemic dirarrhea COE and its immunogenicity in mice[J]. Chinese Journal of Veterinary Sciences,33(11):1627-1630.]
杨晓宇,徐雷,殷鑫欢,张继宗,徐志文,朱玲. 2018. 猪非典型性瘟病毒与猪流行性腹泻病毒双重PCR方法的建立与应用[J]. 江苏农业学报,34(5):1081-1086. [Yang X Y,Xu L,Yin X H,Zhang J Z,Xu Z W,Zhu L. 2018. Establishment and application of double PCR method between atypical porcine pestivirus and porcine epidemic diarrhea virus[J]. Jiangsu Journal of Agricultural Sciences,34(5):1081-1086.]
姚作俊,郝达仁,白云,颜国华,王海敏,宋勤叶,李潭清. 2017. 检测猪流行性腹泻病毒S1蛋白抗体的间接ELISA方法[J]. 畜牧兽医学报,48(6):1085-1091. [Yao Z J,Hao D R,Bai Y,Yan G H,Wang H M,Song Q Y,Li T Q. 2017. Indirect ELISA for detecting antibody to porcine epidemic diarrhea virus S1 protein[J]. Acta Veterinaria et Zoorechnica Sinica,48(6):1085-1091.]
朱卫霞,袁万哲,李丽敏,宋勤叶,孙泰然,李潭清. 2014. 截短猪流行性腹泻病毒N蛋白的可溶性表达及其抗原活性[J]. 畜牧兽医学报,45(9):1561-1566. [Zhu W X,Yuan W Z,Li L M,Song Q Y,Sun T R,Li T Q. 2014. Prokaryotic soluble expression of trunked N protein of procine epidemic diarrhea virus and its antigenic activity[J]. Acta Veterinaria et Zoorechnica Sinica,45(9):1561-1566.]
朱文姣,常琛,朱玉虎,周国丽,尹志安,杨国庆,刘慧敏. 2018. 猪流行性腹泻病毒coe基因的克隆表达及卵黄抗体的制备[J]. 河南农业大学学报,52(4):560-565. [Zhu W J,Chang C,Zhu Y H,Zhou G L,Yin Z A,Yang G Q,Liu H M. 2018. Clone and expression of coe gene and preparation of egg yolk antibody against COE of porcine epidemic diarrhea virus[J]. Journal of Henan Agricultural University,52(4):560-565.]
Brian D A,Baric R S. 2005. Coronavirus genome structure and replication[J]. Current Topics in Microbiology and Immunolgoy,287:1-30.
Chang S H,Bae J L,Kang T J,Kim J,Chung G H,Lim C W,Laude H,Yang M S,Jang Y S. 2002. Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J]. Molecules and Cells,14(2):295-299.
Gao S Y,Zha E H,Li B X,Qiao X Y,Tan L J,Ge J W,Li Y J. 2007. High-level prokaryotic expression of envelope exterior of membrane protein of porcine epidemic diarrhea virus[J]. Veterinary Microbiology,123(1-3):187-193.
Huang Y W,Dickerman A W,Pi?eyro P,Li L,Fang L,Kiehne R,Opriessnig T,Meng X J. 2013. Origin,evolution,and genotyping of emergent porcine epidemic diarrhea virus strains in the United States[J]. mBio,4(5):e00737-13. doi:10.1128/mBio.00737-13.
Li J Q,Liu J X,Lan X,Cheng J,Wu R,Lou Z Z,Yin X P,Li X R,Li B Y,Yang B,Li Z Y. 2009. Cloning the structure genes and expression the N gene of porcine epide-mic diarrhea virus DX[J]. Virologica Sinica,24(3):179-186.
Mariela D,Laude H. 1994. Sequuence of the spike srotein of the porcine epidemic diarrhea virus[J]. Journal of Gene-ral Virology,75(5):1195-1200.
Pasick J,Berhane Y,Ojkic D,Maxie G,Embury-Hyatt C,Swekla K,Handel K,Fairles J,Alexandersen S. 2014. Investigation into the role of potentially contaminated feed as a source of the first-detected outbreaks of porcine epidemic diarrhea in Canada[J]. Transboundary and Emer-ging Diseases,61(5):397-410.
Sun D B,Wang X Y,Wei S,Chen J F,Feng L. 2016. Epidemiology and vaccine of porcine epdemic diarrhea virus in China:A mini-review[J]. The Journal of Veterinary Medical Science,78(3):355-363.
Vlasova A N,Marthaler D,Wang Q H,Culhane M R,Rossow K D,Rovira A,Collins J,Saif L J. 2014. Distinct characteristics and complexevolution of PEDV strains,North America,May 2013-February 2014[J]. Emerging Infectious Diseases,20(10):1620-1628.
Yeo S G,Hernandez M,Krell P J,Nagy E E. 2003. Cloning and sequence analysis of the spike gen of porcine epidemic diarrhea virus Chinju99[J].Virus Genes,26(3):239-246.
(責任编辑 兰宗宝)
