三明野生蕉-1,3-葡聚糖酶Mugsp7基因克隆及其在低温处理下的表达分析
2020-03-23徐小萍谢燕萍陈芳兰陈晓慧陈裕坤张梓浩程春振林玉玲赖钟雄
徐小萍 谢燕萍 陈芳兰 陈晓慧 陈裕坤 张梓浩 程春振 林玉玲 赖钟雄

摘 要:以三明野生蕉组培苗为材料,通过RT-PCR技术克隆获得-1,3-葡聚糖酶基因Mugsp7(-1,3-glucanase)的 cDNA 和 gDNA 序列,并对该基因进行生物信息学分析和不同低温下的实时荧光定量PCR表达分析,并进一步测定8 ℃处理1、2、3、4和5 d后三明野生蕉叶片-1,3-葡聚糖酶活性。结果表明:Mugsp7的 gDNA 长 1132 bp,开放阅读框(ORF)长984 bp,具有一个148 bp的内含子,共编码 327 个氨基酸。cDNA、gDNA 的登录号分别为 KU363808和KU363809。生物信息学分析表明,Mugsp7 属于酸性、亲水、稳定性蛋白,不具有信号肽,与小果野蕉、大叶藻、玉米、大麦、水稻等位于同一分支,与小果野蕉亲缘关系较近分为一类。实时荧光定量PCR表明,不同低温处理和8 ℃低温不同时间处理下,Mugsp7 呈现不同表达模式,且三明野生蕉叶片-1,3-葡聚糖酶活性的测定分析也进一步表明,Mugsp7 能进一步响应低温胁迫。因此,推测 Mugsp7 在三明野生蕉抗寒响应中发挥重要作用。
关键词:三明野生蕉;-1,3-葡聚糖酶;Mugsp7;基因克隆;低温胁迫;qPCR
Abstract: The tissue culture seedlings of a wild banana germplasm from Sanming were used to clone the cDNA and gDNA sequences of β-1,3-glucanase gene Mugsp7 by RT-PCR. Bioinformatics and qRT-PCR analysis of the expression at different low temperature were also carried out, and the enzyme activity of mperatureureent lowthe leaves was further determined by treating at 8 ℃ for 1, 2, 3, 4 and 5 days. The gDNA sequence of Mugsp7 was 1132 bp with an open reading frame (ORF) of 984 bp and one intron of 148 bp, which encoding 327 amino acids. Bioinformatics analysis showed that Mugsp7 was an acidic hydrophobic stable protein, and there was no signal peptide. The amino acid sequence of Mugsp7 shared significant similarity with that in Musa acuminata, Zostera marina, Maize, Hordeum vulgare L , Oryza sativa on the same branch, and it was closely related to Musa acuminata. The expression pattern of Mugsp7 under different low temperature treatments was different, suggesting that Mugsp7 was a low temperature stress related gene.
Keywords: wild banana germplasm from Sanming; β-1,3-glucanase; Mugsp7; gene cloning; low temperature stress; qPCR
香蕉屬于芭蕉科(Musaceae)芭蕉属(Musa)植物,是世界第4大粮食作物,具有重要的经济价值。随着全球气候和坏境的变化,植物生长经常会遭受高温、低温、机械伤害、病原菌等不利条件影响。寒害已成为制约我国香蕉产业健康发展的主要灾害之一[1],严重寒害在一定程度上可能会引起香蕉整个植株死亡,导致香蕉产量降低。福建省作为香蕉的重要产区,因其环境因素孕育丰富的野生蕉优质基因资源。但由于地处亚热带,经常遭受寒害侵袭,进而影响到香蕉的产量和品质。目前大量研究表明,野生蕉与栽培香蕉相比具有更强的抗寒性和抗病性,充分开发利用野生蕉的优良特性,对选育抗寒性香蕉品种具有重要意义[2-5]。
β-1,3-葡聚糖酶(β-1, 3-glucanase)基因属于糖基水解酶第17家族成员[6],广泛存在于植物中,已在拟南芥、田菁、可可、玉米、大叶藻、葡萄、白菜、水稻等众多植物中克隆获得。研究发现,β-1, 3葡聚糖酶除了参与调控植物的生长发育[7]和逆境胁迫外[8],还参与植物抗病[9-10]和抗寒[11]。β-1,3-葡聚糖酶是一类重要的PR蛋白[12],其在抗病性方面的研究取得了重大进步[13],但对其抗寒性的研究相对较少。低温会诱导一系列生理生化反应和调节基因的表达产生相应逆境蛋白,如抗冻蛋白(AFP)的产生提高了植物抵抗低温的能力。AFP在鱼类中第1次被发现,前人研究表明[14],将抗冻蛋白基因导入植物后提高了植物抗寒性。Griffit等[14]经过氨基酸的分析,证明冬黑麦3种AFP的N端序列与内切β-1,3-葡聚糖酶具有同源性。为了改良香蕉的抗寒性,可进一步探讨野生蕉β-1,3-葡聚糖酶基因与抗寒性相关性的研究。
目前,关于香蕉β-1,3-葡聚糖酶基因(Mugsp)的克隆也有报道。张妙霞[4]对三明野生蕉β-1,3-葡聚糖酶基因抗寒机理研究表明,Mugsp基因是抗冻蛋白基因,Mugsp1蛋白是抗冻蛋白的同工酶。陈芳兰等[3]通过克隆获得另外5个β-1,3-葡聚糖酶基因(Mugsp1.2、Mugsp2、Mugsp3、Mugsp4和Mugsp5),表明β-1,3-葡聚糖酶基因均在低温处理下增加表达量,提高了植物抵抗低温的能力。
因此,为提高香蕉产量和品质,促进香蕉产业发展。本研究在前人研究的基础上,选用三明野生蕉作为材料,为筛选香蕉抗寒基因资源提供良好的遗传背景,并采用RT-PCR技术克隆得到三明野生蕉的β-1,3-葡聚糖酶基因Mugsp7。对不同低温处理下的Mugsp7进行定量表达分析,进一步测定不同时间低温处理下的三明野生蕉β-1,3-葡聚糖酶活性变化,为进一步研究三明野生蕉β-1,3-葡聚糖酶基因在低温下的功能奠定理论基础。
1 材料与方法
1.1 材料
本研究克隆所用材料是为福建农林大学园艺植物生物工程研究所继代保存的三明野生蕉组培苗。测定β-1,3-葡聚糖酶活性所用材料为长势一致的三明野生蕉第1~2片新叶,采自园艺植物生物工程研究所香蕉种质资源圃。
1.2 方法
1.2.1 Mugsp7的cDNA及gDNA克隆 以三明野生蕉组培苗叶片为材料,参照天泽试剂盒提取植物总RNA,根据琼脂糖凝胶电泳检测 RNA 质量,采用超微量紫外分光光度计测定 RNA 吸光值,以 A260/A280 在 1.9~2.1 之间为宜,采用Thermo公司的RevertAid First Strand cDNA Synthesis Kit试剂盒逆转录成cDNA[16]。采用CTAB改良法提取三明野生蕉叶片的DNA[17]。参照小果野蕉基因组数据库中已经注释的β-1,3-葡聚糖酶基因序列,以标注为“GSMUA_Achr5T08100_001”的基因序列作为参考序列进行同源克隆。采用DNAMAN?6.0 软件,根据引物设计原则设计上、下游引物(Mu?g?sp7-F,Mugsp7-R),用于cDNA及 gDNA的克隆,PCR反应体系延伸时间为70 s。PCR 产物采用 1%琼脂糖凝胶电泳检测,采用Biomega ?PCR产物纯化试剂盒进行回收、TA克隆,最后进行菌液 PCR 鉴定。菌液 PCR 产物经过电泳后,选取阳性克隆子至铂尚公司测序。利用DNAM?A?N? 6.0对克隆所得到的基因与基因组序列进行比对分析。
1.2.2 生物信息学分析 对克隆得到的基因序列和蛋白质序列采用以下的软件进行生物信息学分析,相应的分析软件见表1。
1.2.3 低温下Mugsp7实时荧光定量PCR检测 根据陈芳兰等[3]对三明野生蕉低温响应的研究,分别取生长势相近的三明野生蕉组培苗叶片进行以下处理:28、20、13、4、0、?2、?4、?6 ℃處理36 h,8 ℃下处理0~36 h。经过不同温度处理后提取RNA。实时荧光定量表达分析的cDNA则参照SYBR Ex Script RT-PCR kit进行逆转录。
在靠近序列起始密码区域处设计定量上下游引物,引物序列见表2。将不同处理的三明野生蕉叶片 cDNA 各取1 μL进行混样,对混合的 c?D?N?A ??进行 5、25、125和 625 倍的梯度稀释,荧光定量 PCR试验结果显示,E值在 1.9~2.1 之间,建立的溶解曲线。以 18 s 为内参基因[4],使用罗氏LightCycler? 480 system荧光定量PCR仪进行扩增。以不同处理后稀释10倍的cDNA作为模板进行荧光定量 PCR,对得到的平均 Cp 值采用单基因内参法2ΔΔCT计算基因相对表达量,每个处理 3 次重复。
1.2.4 低温处理后-1,3-葡聚糖酶活性的测定 为进一步探讨不同温度处理下三明野生蕉Mug?sp7 转录水平表达模式,测定不同温度处理下的β-1,3-葡聚糖酶活性。精确配制1 mg/mL的葡萄糖标准溶液,按照表3的顺序依次在编号1~6的试管中加入相应试剂,充分混匀后沸水浴5 min,定容至25 mL。测定所有试管溶液的吸光度(A),使用的波长为540 nm。制作葡萄糖标准曲线。将生长健壮且长势相近的三明野生蕉叶片分别经过8 ℃处理1、2、3、4、5 d后,参考蒋跃明[18]方法测定β-1,3-葡聚糖酶活性。每个处理 3 个生物学重复。
表3 测定酶活性其试剂加入顺序
Tab. 3 Enzyme activity assay reagent addition
试管编号Test tube number
1 2 3 4 5 6
含糖量/mg 0 0.4 0.8 1.2 1.6 2.0
葡萄糖/mL 0 0.4 0.8 1.2 1.6 2.0
蒸馏水/mL 2 1.6 1.2 0.8 0.4 0
DNS/mL 2 2 2 2 2 2
M:DL2000 Marker;泳道1和泳道2分别是
cDNA和gDNA扩增产物。
M: DL2000 marker. Lane 1 and lane 2 are amplified products of cDNA and gDNA, respectively.
圖1 PCR扩增产物电泳结果
Fig. 1 Electrophoresis of PCR amplification
2 结果与分析
2.1 三明野生蕉β-1,3-葡聚糖酶基因Mugsp7 cDNA与gDNA序列获得
以三明野生蕉的cDNA和gDNA为模板,经过PCR扩增产物结果见图1。预测目的条带约为1000 bp,第1条带接近1000 bp,第2条带接近1100 bp,与预测长度相符且条带明亮,因此,割下这2条带放入1.5 mL的离心管进行回收、纯化、TA克隆和菌液PCR鉴定。菌液PCR产物,采用1%凝胶电泳检测,挑选阳性克隆子送测。测序结果显示,这2条序列均带有完整的 ORF,最后获得了984 bp的 ORF cDNA 序列,1132 bp 的gDNA序列。
在 NCBI 上进行 BLAST 发现,目的条带的序列与其他物种的-1,3-葡聚糖酶基因序列具有较高的相似性,且在NCBI上进行功能结构域分析发现,所得的-1,3-葡聚糖酶基因序列具有糖基水解酶第17家族保守特征结构域[LIVM]. [LIVMFYWA]{3} [STAG]E[STA]GWP[STN]. [SAGQ]。将克隆得到的开放阅读框序列与模板基因(GSMUA_Ach?r?5?T??0?8??100_001)序列进行比对,相似性达到97.67%,说明克隆获得的序列为三明野生蕉的β-1,3-葡聚糖酶基因,命名为 Mugsp7,其cDNA、gDNA序列在NCBI上的登录号分别为 KU?36?3?8?0?8、KU363809。同时将 cDNA、gDNA 序列在 DNA?M?AN6.0 软件上比对发现,β-1,3-葡聚糖酶基因Mug?sp7具有一个148 bp的内含子。
2.2 三明野生蕉Mugsp7蛋白的生物信息学分析
2.2.1 蛋白质的基本理化性质分析 采用Pro?p?ram对Mugsp7蛋白基本理化性质进行分析,结果表明:Mugsp7基因共编码327个氨基酸,编码的蛋白分子量为 35154.8 Da,预测分子式为C1560H2433N443O463S11,理论PI值为6.53。该蛋白属于酸性、亲水、稳定性蛋白。该基因共编码 20 种氨基酸,其中丙氨酸(Ala)的含量最高,为13.5%,其次是缬氨酸(Val),为9.5%。预计N端氨基酸为蛋氨酸(Met),该蛋白的脂肪族系数为85.08。使用SignalP 4.0 Server 软件对Mugsp7蛋白信号肽进行预测,结果显示,Mugsp7蛋白不具有典型的信号肽。使用PSORT对Mugsp7蛋白进行亚细胞定位发现,Mugsp7蛋白位于叶绿体基质、线粒体基质空间、线粒体膜间隙、细胞质的可能性分别为0.520、0518、0.473、0.450,主要定位在叶绿体基质和线粒体基质上。
2.2.2 蛋白质的跨膜结构及保守结构域分析 使用TMpred对Mugsp7的蛋白质进行跨膜结构分析发现,Mugsp7属于跨膜蛋白,跨膜区域共有8
个,即内到外和外到内的跨膜区域各有4个,7~25位氨基酸最有可能形成从内到外的跨膜区域,161~188位氨基酸最有可能形成从外到内的跨膜区域。使用NCBI-Protein Tools对Mugsp7蛋白的保守结构域预测发现,Mugsp7蛋白属于糖基水解酶第17家族(Glycosyl hydrolases family),该蛋白质在第17~27 个氨基酸之间含有一大段与糖基水解酶第17家族一致的保守结构域即,[LIVM]. [LIVMFYWA]{3}[STAG]E[STA]GWP[STN]. [SA?G?Q]。因此,Mugsp7蛋白属于糖基水解酶第17家族,很有可能在糖基水解酶调节方面发挥着重要的作用。
2.2.3 Mugsp7蛋白质结构分析 使用Coils预测Mugsp7蛋白的卷曲螺旋结构发现,Mugsp7蛋白卷曲的几率小于20%。根据 Coils 判断方法,即若几率小于50%螺旋结构就不能形成,几率大于50%则螺旋结构有可能形成,故Mugsp7蛋白形成卷曲螺旋结构的可能性很小,因此,推测Mugsp7没有卷曲螺旋的结构。使用NPS预测Mugsp7蛋白的二级结构,结果显示,Mugsp7蛋白的结构主要由无规则卷曲(41.28%)、α螺旋(30.28%)和延伸链(28.44%)组成。由于富含无规则卷曲结构,能形成多种构象,在不同条件下可表达不同的功能。使用Swiss-model预测三明野生蕉Mugsp7 蛋白质的三维结构(图3),其主要的结构元件是无规则卷曲、α螺旋和延伸链,与二级结构预测的结果保持一致。使用NetPhos 2.0 对 Mugsp7 蛋白进行磷酸化位点预测,结果显示,Mugsp7 蛋白可能在丝氨酸(4个)、苏氨酸(2个)和酪氨酸(2个)这 3 种氨基酸上发生磷酸化修饰。
2.2.4 Mugsp7氨基酸序列同源性和分子系统进化分析 使用NCBI对三明野生蕉Mugsp7蛋白和其他物种β-1,3-葡聚糖酶的同源性进行比对,同时对系统进化进行分析。根据对比结果,选取有代表性的和同源性高的几个物种建立发育树,主要的分析结果为:三明野生蕉Mugsp7与水稻(Oryza sativa)、玉米(Zea)的相似性均为59%,与大叶藻(Zostera marina)的相似性为58%,与大麦(Hordeum vulgare)的相似性为54%,与葡萄(Vitis vinifera)、橡胶树(Hevea brasiliensis)的相似性为49%。采用MEGA6.0对具有代表性的单子叶和双子叶植物的蛋白质序列进行进化树分析,拟南芥独立分为一类(图4)。葡萄、橡胶树、田菁、油橄榄、玫瑰、百合和可可树分为一类,三明野生蕉Mugsp7与小果野蕉、大叶藻、玉米、大麦、水稻分为一类,且与小果野蕉位于同一分支,说明三明野生蕉Mugsp7与小果野蕉具有高度的亲缘关系。
2.3 低溫下三明野生蕉Mugsp7的荧光定量表达分析
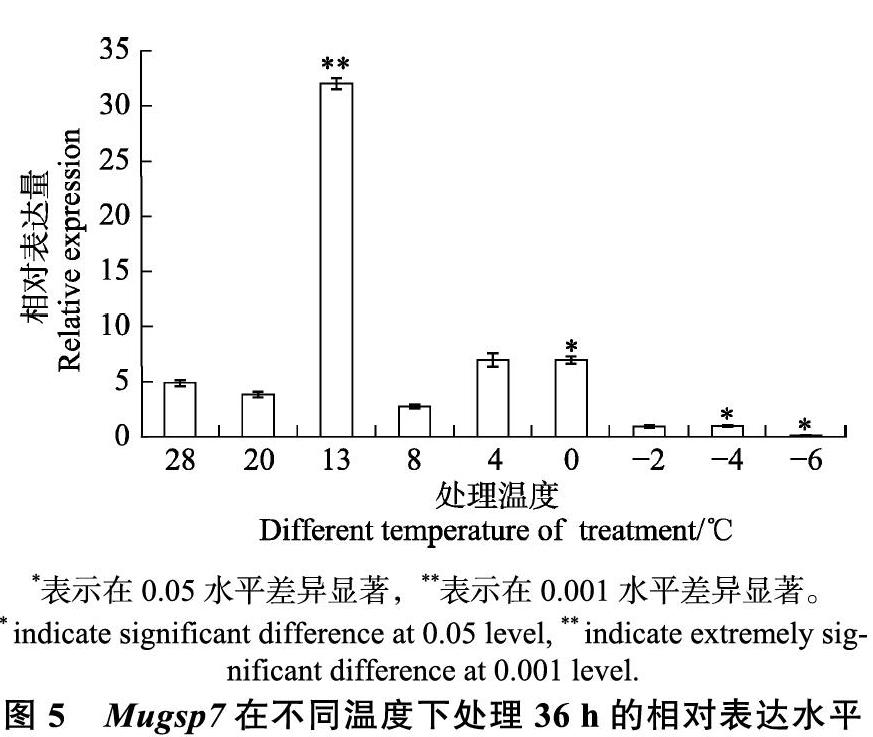
在不同温度(28、20、13、8、4、0、?2、?4、和?6 ℃) 处理36 h,以28 ℃处理为对照,Mugsp7的相对表达量呈现“升-降-升-降”趋势(图5)。当温度为13 ℃时,相对表达量达到最大值,约为对照组的6.5倍。当温度为8 ℃时,Mugsp7的相对表达量突然降低,为对照组的0.57倍。在更低温度下,表达量稍微上升后又下降。结果表明,除13 ℃处理外,Mugsp7在其他温度的表达水平均较低。由于13 ℃是生长临界温度,以上结果说
为进一步了解三明野生蕉β-1,3-葡聚糖酶基因Mugsp7在8 ℃低温表达量突然下降的原因,对三明野生蕉组培苗在8 ℃中进行0~36 h的不同时间处理。以28 ℃处理为对照,Mugsp7的相对表达量呈现“升-降-升”趋势(图6),表明Mugsp7可以快速响应8 ℃。而8 ℃下不同持续时间处理会使表达量发生变化,且低温不同持续时间处理的表达量均高于对照组,介于1.6和7倍之间。在8 ℃低温处理4 h时,Mugsp7的表达量达到最大值约为对照的7倍。处理8 h时,其表达量突然降低,约为对照的1.6倍,而后随着低温时间持续增加,Mugsp7的表达量变化不明显。因此,研究结果表明,Mugsp7在低温不同持续时间刚开始发生变化时即感受低温,同时开始启动抗寒应答。
2.4 低温处理后三明野生蕉β-1,3-葡聚糖酶活性变化
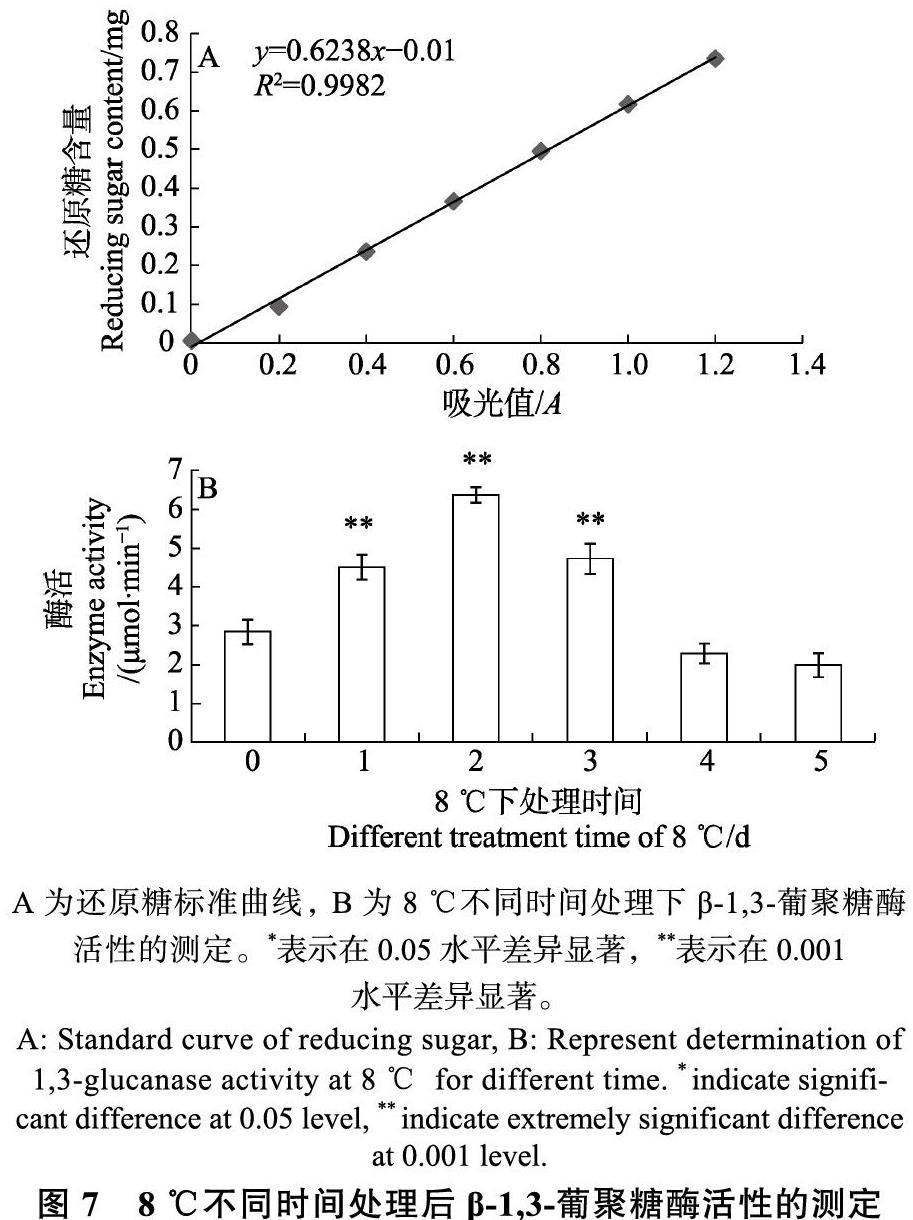
葡萄糖标准曲线如图7所示,根据标准曲线公式和相应计算得到三明野生蕉β-1,3-葡聚糖酶活性(图7)。结果显示,将三明野生蕉叶片置于低温下处理一定时间(8 ℃处理1、2、3、4和5 d),叶片体内的β-1,3-葡聚糖酶活性发生了显著性变化,总体上呈现“先升后降”的趋势,在正常植物体叶片中通常是低水平表达的[19]。在低温处理的短时间内即出现较大波动,活性在第2天达到最高值。当处理时间继续增加,在第3天时突然下降,之后缓慢降低。因此,三明野生蕉β-1,3-葡聚糖酶在短时间低温处理下对低温的响应强烈,随着处理时间的延长,对低温的响应减弱。
A为还原糖标准曲线,B为8 ℃不同时间处理下β-1,3-葡聚糖酶活性的测定。*表示在0.05水平差异显著,**表示在0.001
水平差异显著。
通过 SPSS 软件分析可知,8 ℃下处理1、2、3 d与对照组间的酶活性具有极显著差异,4、5 d与对照组的差异不明显。表明低温在一定时间内会影响β-1,3-葡聚糖酶的活性,并且在处理2 d达到极大值。Mugsp7在8 ℃下处理24~36 h期间基因表达显著上调,与酶活性呈现一致的表达模式,而在处理3 d开始下降。处理1 d与处理3、4与5 d处理的酶活性无明显差异,甚至低于对照组的活性。进而推测β-1,3-葡聚糖酶可以协助三明野生蕉耐受一定时间的低温,低温处理2 d时,通过提高 Mugsp7 的表达量,提高酶活性,达到一定程度后(3 d),体内抵抗低温能力遭到破坏。
3 讨论
3.1 Mugsp7基因结构可能与三明野生蕉抗寒功能相关
低温处理下三明野生蕉Mugsp7蛋白的二级结构主要由无规则卷曲(41.28%)、α 螺旋(30.28%)、延伸链(28.44%)构成。三明野生蕉β-1,3-葡聚糖酶 Mugsp7基因的表达情况赋予了植物一定的抗寒性,三明野生蕉的抗寒功能可能与这种结构特点有关。正常生长条件下,植物的细胞膜是流动的。当植物遭受低温胁迫时,为维持正常的生长发育,可通过减少细胞膜的流动性,增加其刚性,从而将减少低温造成的伤害。
王维香等[20]认为α螺旋可以与细胞膜结合,稳定膜功能,防止膜低温损伤,同时也可以抑制冰点的生长。一般认为,无规则卷曲区域可决定蛋白质的功能,在不同条件下可表达不同的功能[21]。同时对最早在鱼类中发现的抗冻蛋白基因研究发现,该基因在植物中表达可使植物降低胞外溶液冰点,从而使植物在抗寒性方面得到提高,并且该蛋白和其他一些抗冻蛋白的二级结构中也含有该种结构。其他已经克隆获得的β-1,3-葡聚糖酶成员中也含有这种结构。因此,猜测这种二级结构对于β-1,3-葡聚糖酶具有一定的抗寒性。通过进化树分析可知,不同物种的β-1,3-葡聚糖酶基因结构的具有较高同源性,说明β-1,3-葡聚糖酶保守区域在遗传过程中具有一定稳定性。
3.2 Mugsp7抗寒作用机制的探讨
β-1,3-葡聚糖酶基因是一类重要的抗逆境相关基因[22-23]。在本研究中,低温8 ℃不同时间处理后β-1,3-葡聚糖酶的活性呈现“先上升后下降”的趋势,说明β-1,3-葡聚糖酶能够响应低温胁迫。普遍认为13 ℃是香蕉的低温临界温度[24],在冷害温度下,温度越低则越快出现冷害[25]。本研究28~?6 ℃的实时荧光定量结果表明,整体呈现出“先升高后降低”的表达趋势,特别是在13 ℃达到了极大值,可能原因是三明野生蕉Mugsp7对温度敏感,提高表达量的同时累积了一定量的β-1,3-葡聚糖酶,足够抵抗8 ℃一定时间的低温胁迫,所以8 ℃条件下表达量急剧降低。这与张妙霞[4]推测三明野生蕉Mugsp基因的抗寒作用具有累积效应一致,并得出Mugsp1基因是抗冻蛋白基因。本研究 Mugsp7 能强烈响应低温,特别是临界生长点13 ℃,但在0 ℃后,表达量很低甚至接近 0,可能不同物种、不同成员功能上有差異。将Mugsp7 低温下的定量表达结果同陈芳兰等[3]的Mugsp1.2-5 基因在低温下的表达情况比较发现,β-1,3-葡聚糖酶基因不同成员都在8 ℃下1~4 h显著提高表达量,但是不同成员的表达模式不尽相同,不同的是在香蕉生长临界温度(13 ℃)下,Mugsp7基因达到表达高峰,这与陈芳兰等[3]的结果有所差异。Mugsp1.2、Mugsp2、Mugsp5在4 ℃时达到表达高峰,Mugsp1、Mugsp3、Mugsp4 在0 ℃表达量达到最高。推测在低温下,本研究克隆获得的三明野生蕉β-1, 3-葡聚糖酶基因Mug?sp7,协同和互补了陈芳兰等[3]及张妙霞[4]克隆获得的Mugsp、Mugsp1-5基因等β-1, 3-葡聚糖酶家族基因,帮助植物抵抗低温胁迫,家族基因间的协同表达作用提高了β-1, 3-葡聚糖酶抗寒效应。然而,β-1, 3-葡聚糖酶基因在感受到低温信号后具体是如何传递的、如何提高植物抗寒等问题可以在今后中进行深入的研究。
参考文献
王安邦, 金志强, 刘菊华, 等. 香蕉寒害研究现状及展望[J]. 生物技术通报, 2014(8): 28-33.
Heslop-Harrison J S, Schwarzacher T. Domestication, genomics and the future for banana[J]. Annals of botany, 2007, 100(5): 1073-1084.
陈芳兰, 林玉玲, 陈裕坤, 等. 三明野生蕉β-1,3葡聚糖酶基因克隆及其低温下SA处理后的表达分析[J]. 西北植物学报, 2015, 35(9): 1709-1721.
张妙霞. 野生香蕉(Musa spp., AB group)抗寒相关基因的克隆与表达分析[D]. 福州: 福建农林大学, 2010.
赖钟雄, 陈 源, 林玉玲, 等. 三明野生蕉基本生物学特性调查[J]. 亚热带农业研究, 2006(4): 241-244.
Gaudioso-Pedraza R, Benitez-Alfonso Y. A phylogenetic approach to study the origin and evolution of plasmodesmata-localized glycosyl hydrolases family 17[J]. Frontiers in Plant Science, 2014, 5: 212.
Abeles F B, Bosshart R P, Forrence L E, et al. Preparation and purification of glucanase and chitinase from bean leaves[J]. Plant Physiology, 1971, 47(1): 129-134.
Hon W C, Griffith M, Mlynarz A, et al. Antifreeze proteins in winter rye are similar to pathogenesis-related proteins[J]. Plant Physiology, 1995, 109(3): 879-889.
王廷璞, 马静静, 赵菲佚. -1,3-葡聚糖酶和几丁质酶在农作物病虫害防治中的研究进展[J]. 安徽农业科学, 2010, 38(26): 14417-14419.
杨树奎. -1,3-葡聚糖酶和几丁质酶在农作物病虫害防治中的研究进展的几点思考[J]. 中国农业信息, 2013(15): 98-98.
卞海云, 王友华, 陈兵林, 等. 低温条件下相关关键酶活性对棉纤维比强度形成的影响[J]. 中国农业科学, 2008 (4): 1235-1241.
Van Loon L C, Van Strien E A. The families of pathogenesis-related proteins, their activities, and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology, 1999, 55 (2): 85-97.
Zhu Q, Maher ? E A, Sameer Masoud R A, et al. Enhanced protection against fungal attack by constitutive co–expre?ssion of chitinase and glucanase genes in transgenic tobacco [J]. Bio/Technology, 1994, 12 (8): 807-812.
Hightower R, Baden C, Penzes E, et al. Expression of antifreeze proteins in transgenic plants[J]. Plant Molecular Biology, 1991, 17(5): 1013-1021.
Griffith M, Marentes E, Ala P, et al. The role of ice binding proteins in frost tolerance of winter rye[M]//Paul H L. Advances in plant cold hardiness. University of Michigan: CRC Press, 1993: 177-186.
趙双宜, 吴耀荣, 夏光敏. 介绍一种简单高效的植物总RNA提取方法[J]. 遗传, 2002, 24(3): 337-338.
淦国英, 漆艳香, 蒲金基, 等. 改良CTAB法提取高质量香蕉叶片总RNA[J]. 广东农业科学, 2009(7): 192-195.
蒋跃明. 香蕉采后炭疽病发生与几丁酶、β-1,3-葡聚糖酶和多巴胺的关系[J]. 植物生理学报, 1997, 23(2): 158-162.
高晓蓉, 安利佳, 范 琦, 等. 大豆-1,3-葡聚糖酶基因的研究初报[J]. 农业生物技术学报, 2000, 8 (3): 240-247.
王维香, 魏令波, 张 虎. 沙冬青热稳定抗冻蛋白的分离纯化及其部分性质研究[J]. 四川大学学报(自然科学版), 2007, 44(4): 912-917.
王转梅, 陈崇顺, 王 轶, 等. 烟草品种Xanthi NN碱性β-1,3-葡聚糖酶基因的克隆与生物信息学分析[J]. 江苏农业科学, 2009(1): 28-31.
Bove J, Kim C Y, Gibson C A, et al. Characterization of wound-responsive RNA-binding proteins and their splice variants in Arabidopsis[J]. Plant Molecular Biology, 2008, 67(1-2): 71-88.
Balasubramanian V, Vashisht D, Cletus J, et al. Plant β-1,3-glucanases: their biological functions and transgenic expression against phytopathogenic fungi[J]. Biotechnology Letters, 2012, 34 (11): 1983-1990.
Dixon R A, Achnine L, Kota P, et al. The phenylpropanoid pathway and plant defence—a genomics perspective[J]. Molecular Plant Pathology, 2002, 3(5): 371-390.
牟海飞, 吴代东, 邹 瑜, 等. 香蕉寒害及防寒栽培技术研究进展[J]. 南方农业学报, 2012, 43(7): 965-970.
