溶液燃烧法制备Fe2O3/C及其催化苯甲醇制苯甲醛
2020-03-23吕丹阳
孙 琪,吕丹阳
(辽宁师范大学 化学化工学院,辽宁 大连 116029)
苯甲醛又名安息香醛是一种重要的有机中间体,在香料、医药、燃料、农药等众多行业中表现出极高的应用价值[1].传统生产方法是二氯化苄水解合成,该方法存在副产物众多、分离困难、产品含氯、排放出腐蚀性气体造成环境污染等诸多问题,如今已很少使用.本着绿色合成苯甲醛的生产原则,人们研究出几种苯甲醛的合成方法,常见的有甲苯氧化法、芳香酯或酸还原法、苯甲醇氧化法等.甲苯氧化法得到的苯甲醛虽不含氯,但是产率偏低,而且苯甲醛是众多产物中的一种,分离起来非常困难[2].芳香酯/酸还原法则因原料昂贵,生产成本较高,工业生产中不具有市场竞争力.苯甲醇液相氧化法采用廉价无污染的氧化剂(H2O2或O2),将苯甲醇选择性氧化为苯甲醛.该方法满足制备工艺简单、原料易得、绿色环保、生产成本低等优点.在这一方面,催化剂的选择至关重要.
溶液燃烧法制备纳米材料已引起人们的重视[3-9].以硝酸铁为氧化剂,尿素为燃料,水热合成制得的碳球为载体,利用溶液燃烧反应制备出Fe2O3/C纳米复合材料.通过多种表征手段对催化剂结构和形貌等进行了研究.并用于以H2O2为氧化剂,液相选择性催化氧化苯甲醇制苯甲醛的反应中,对催化剂的活性进行了研究.
1 实验部分
1.1 碳球的制备
称取1.981 7 g葡萄糖,加20 mL去离子水溶解,制成0.5 mol/dm3的溶液.将溶液转入30 mL不锈钢聚四氟乙烯水热釜,180 ℃下水热8 h.冷却后将水热釜内产物分别用水和醇洗涤.80 ℃干燥过夜,得到碳微球.
1.2 溶液燃烧法制备Fe2O3/C催化剂
称取0.1 g碳微球溶解在5 mL去离子水中,超声30 min,使碳球形成均匀的溶液.后称取0.202 g Fe(NO3)3·9H2O作氧化剂,一定质量尿素做燃料,与碳球溶液混合,继续超声30 min.混合物置于预设温度的马弗炉内,发生氧化还原反应.所得样品洗涤后,80 ℃干燥过夜.标记为:Fe2O3/C-T,T为预设马弗炉温度.
1.3 催化剂的表征
X射线衍射(XRD)在D8 Advance型(Bruker)上测得,实验条件为 Cu Kα 射线源(λ=0.154 06 nm),扫描范围10°~80°,扫描速率为1°/min. X光电子能谱(XPS)在Escalab 250XI(Thermo Fisher)上测得,使用Avantage 软件进行分峰拟合. 热重(TG-DTA)在STA449 F3(Netzsch)上进行,空气气氛,升温速率5 ℃/min. 透射电镜图(TEM)在JEM-2100f(JEOL)上得到.
1.4 Fe2O3/C催化剂的活性评价
取0.02 g催化剂于50 mL两口反应瓶中,按顺序加入2 mL乙腈,0.2 mL苯甲醇,0.6 mL 30% 的H2O2溶液.反应瓶置于75 ℃恒温水浴内,磁力搅拌,冷凝回流6 h.反应后的催化剂进行离心操作,使得固液分离,经过干燥后可得到回收的固体催化剂.
反应液采用GC126气相色谱仪进行定量分析.FID检测器,HP-5型毛细管色谱柱,N2为载气.色谱柱程序升温参数为三阶:一阶80~100 ℃;二阶100~120 ℃(温度到达120 ℃时,保持1 min);三阶120~200 ℃.进样器温度为250 ℃,检测器温度为250 ℃,进样量0.1 μL.硝基苯为内标物,以内标法定量.
2 结果与讨论
2.1 催化剂性质
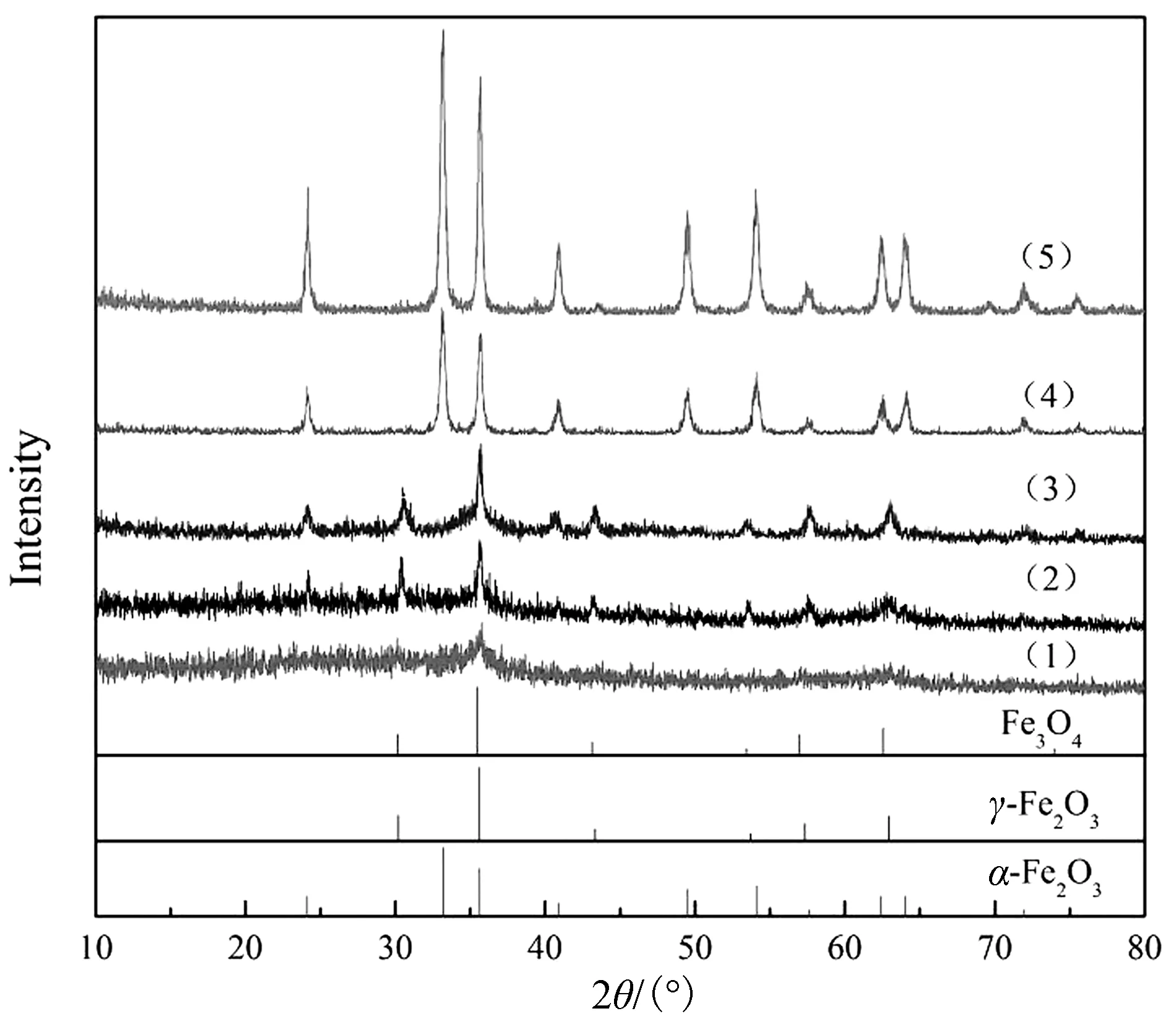
图1 不同引发溶液燃烧温度制备的Fe2O3/C样品XRD图Fig.1 XRD micrographs of Fe2O3/C samples prepared by different combustion temperatures(1) Fe2O3/C -250; (2) Fe2O3/C -300; (3) Fe2O3/C -400; (4) Fe2O3/C -450; (5) Fe2O3/C -500
2.1.1 XRD 分析 在不同预设温度的马弗炉中引燃前驱体溶液,在对应的温度下保持20 min,所得的Fe2O3/C样品的XRD如图1所示.250 ℃溶液燃烧合成的样品,在2θ=35.6°,62.9°出现了2个γ-Fe2O3的特征衍射峰,与粉末衍射标准卡(No. 39-1346)中γ-Fe2O3结构数据一致[10].300 ℃及400 ℃溶液燃烧合成的样品,在2θ=30.2°,35.6°,43.3°,53.7°,57.3°,62.9°出现了6个γ-Fe2O3的特征衍射峰;在2θ=24.1°,40.9°出现了2个α-Fe2O3的特征衍射峰,与粉末衍射标准卡(No. 33-0664)中α-Fe2O3结构数据一致[11].450 ℃和500 ℃溶液燃烧合成的样品,在2θ=24.1°,33.2°,35.6°,40.9°,49.9°,54.1°,57.6°,62.4°,64.0°,71.9°出现了10个α-Fe2O3的特征衍射峰(No. 33-0664).各样品衍射峰尖锐且对称,说明样品结晶比较完整.可见,引发溶液燃烧温度影响铁氧化物的晶型.
2.1.2 TG-DTA 分析 Fe2O3/C的前驱体(硝酸铁、尿素和碳球)TG-DTA曲线如图2所示.催化剂前驱体分解主要经历5个阶段,第一阶段从室温到143 ℃,质量损失4.3%,主要是吸附水的脱附所致.第二阶段从143 ℃到220 ℃,质量损失16.8%,这可能是碳球的脱水致密造成的.这2个阶段的水分蒸发导致温度在25~200 ℃之间出现1个很宽的吸收峰.第三阶段从220 ℃到350 ℃,318 ℃时达到这一过程的最大反应速率,主要是硝酸铁和尿素发生氧化还原反应.390~450 ℃,碳球在高温气氛中发生热分解.大于500 ℃放热峰可能是铁氧化物的晶型发生转化导致的放热.
2.1.3 XPS分析 由于Fe2O3与Fe3O4的XRD图谱非常的相似.通过XPS测试可以确定样品中铁的价态,如图3所示.710.9 eV和724.4 eV出现了明显的特征吸收峰,分别归属于Fe2p3/2和Fe2p1/2[12].且在719 eV处出现了1个Fe2p3/2卫星峰,732.7 eV处出现了一个Fe2p1/2卫星峰.与文献[12]报道的Fe3O4无卫星峰,Fe2O3有两处卫星峰相符,且出峰位置一致.从而证明该样品的Fe氧化物晶型为Fe2O3相.
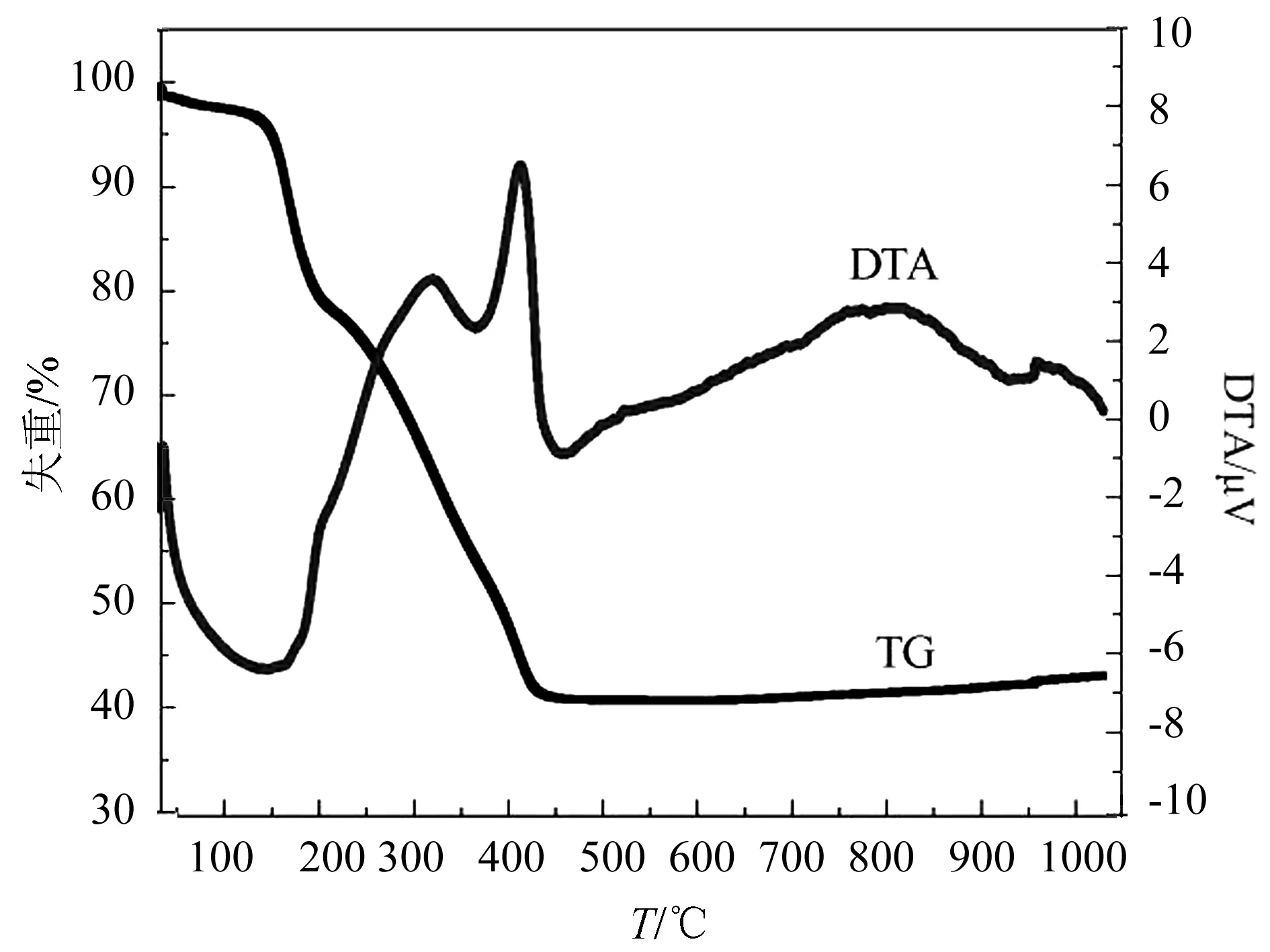
图2 Fe2O3/C样品前驱体的TG-DTA曲线Fig.2 TG-DTA curves of the precursor of Fe2O3/C sample
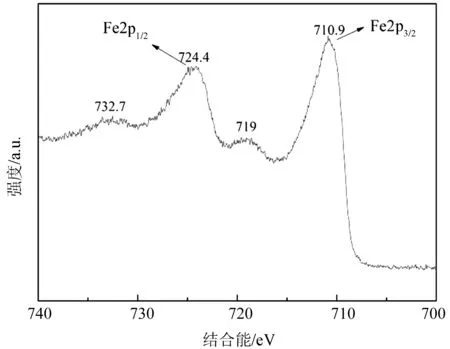
图3 Fe2O3/C-400样品的XPS 谱图Fig.3 XPS spectrum of Fe2p from Fe2O3/C-400
2.1.4 比表面积分析 表1给出了不同燃烧条件合成的Fe2O3/C催化剂的比表面积.表中Fe2O3/C-400-t中t为马弗炉燃烧反应保持的时间.碳球自身比表面积较小,燃烧合成的Fe2O3/C催化剂比表面积均有不同程度的增大.400 ℃合成的样品具有最高的比表面积,为149.9 m2/g.燃烧温度为500 ℃时,碳球完全分解,产物的比表面积下降至29.2 m2/g.此外,尿素的用量越多,样品的比表面积越小.催化活性测试表明,比表面积越大,活性越高.
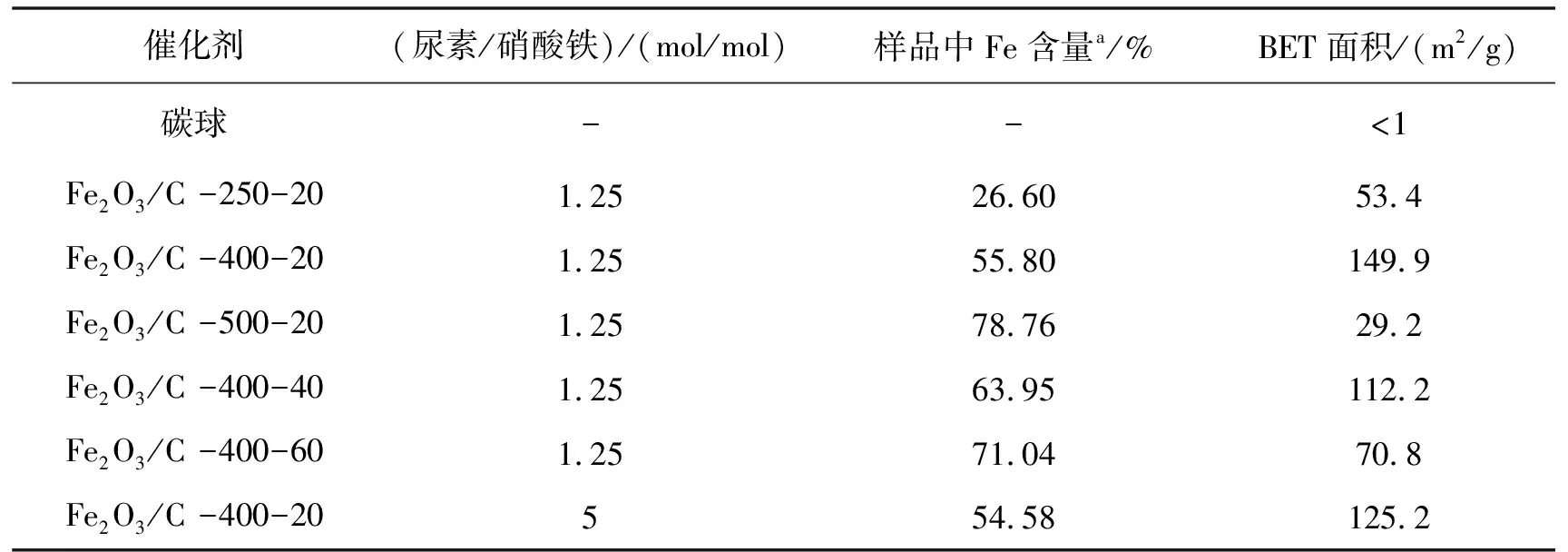
表1 不同燃烧条件的Fe2O3/C催化剂的比表面积
aICP测定
2.1.5 TEM分析 不同燃烧温度下获得的Fe2O3/C催化剂的透射电镜照片如图4所示.燃烧温度为250 ℃[图4(a)]和300 ℃[图4(b)]时,样品呈现粒径约200 nm球形结构.燃烧温度为400 ℃[图4(c)]时,样品仍呈粒径为200 nm左右的球形结构.但样品表面粗糙,比表面积增加.400 ℃燃烧时间为40 min[图4(d)]时,样品出现粒径约200 nm的空心泡状球形结构.燃烧时间为60 min[图4(e)]时,空心泡状球形的完整度较好,而且粒径增大(>200 nm).说明碳球被分解掉.随着燃烧时间的增加,碳球的作用由载体向模板转变.燃烧温度为500℃[图4(f)]时,碳球完全分解,致使催化剂的形貌杂乱.

图4 不同燃烧条件的Fe2O3/C催化剂TEM图Fig.4 TEM micrographs of Fe2O3/C catalysts with different combustion conditions(a)Fe2O3/C-250-20; (b) Fe2O3/C-300-20; (c) Fe2O3/C-400-20; (d) Fe2O3/C-400-40; (e)Fe2O3/C-400-60; (f) Fe2O3/C-500-20
2.2 催化氧化苯甲醇
2.2.1 引发溶液燃烧温度的影响 表2给出了不同引发燃烧温度下合成的Fe2O3/C催化剂对苯甲醇催化活性的影响.引发燃烧温度从250 ℃升高至500 ℃,苯甲醇的转化率先升后降,苯甲醛的选择性由69.1%升高至99.2%.这可能是由于引发燃烧温度影响铁氧化物的晶型.另外,低温下碳球以载体形式存在,与Fe2O3紧密结合,活性组分相对分散,可增大与反应物的接触面积.而高温下(450~500 ℃)碳球完全分解,α-Fe2O3聚集,导致苯甲醇催化活性降低.
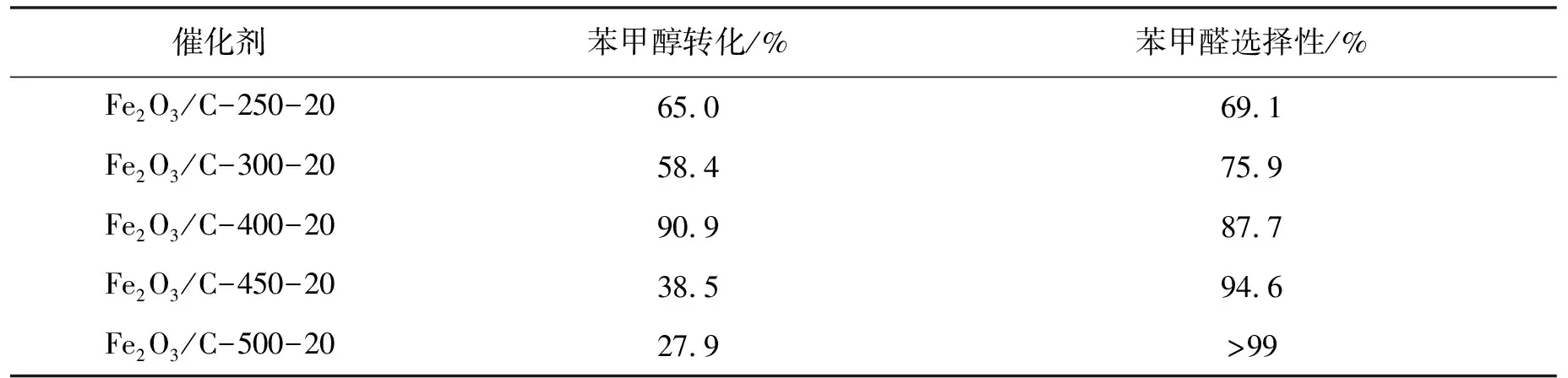
表2 引发溶液燃烧温度对催化剂活性的影响
Reaction conditions: 0.02 g catalyst; 1.92 mmol(0.2 mL) benzyl alcohol;5.88 mmol(0.6 mL)30% H2O2;2 mL acetonitrile; 75 ℃,6 h
2.2.2 燃烧时间的影响 表3给出了400 ℃时,维持该温度不同时间合成的Fe2O3/C催化剂对苯甲醇催化活性的影响.合成催化剂燃烧时间为30 min时,苯甲醛转化率64.6%,但是选择性最低.随着合成催化剂燃烧时间的增加,苯甲醛的收率由64.6%降至28.0%,苯甲醛的选择性由79.7%升至99.2%.综合来看,燃烧时间为20 min时,Fe2O3/C催化性能较佳.
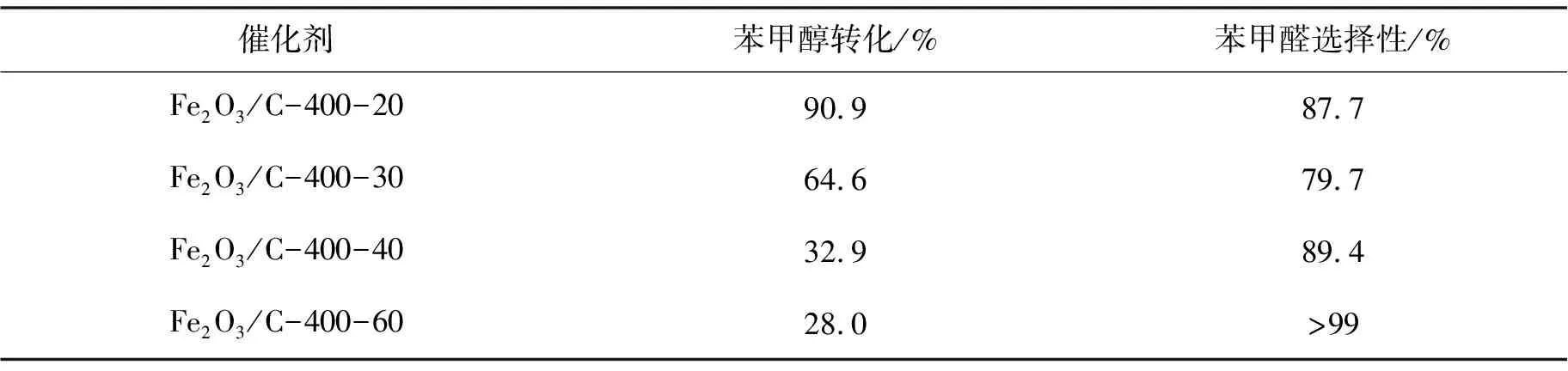
表3 燃烧时间对苯甲醇催化活性的影响
Reaction conditions: 0.02 g catalyst; 1.92 mmol(0.2 mL) benzyl alcohol;5.88 mmol(0.6 mL)30% H2O2;2 mL acetonitrile; 75 ℃,6 h
2.2.3 溶剂的影响 表4给出了不同溶剂对Fe2O3/C-400-20催化苯甲醇反应活性的影响.从乙腈到正庚烷,溶剂的极性减小,苯甲醇的溶解度降低.极性较大的乙腈为反应溶剂时,苯甲醇表现出很高的转化率和选择性.而在其他溶剂中活性与选择性都很低.可见,高极性乙腈是最佳反应溶剂.
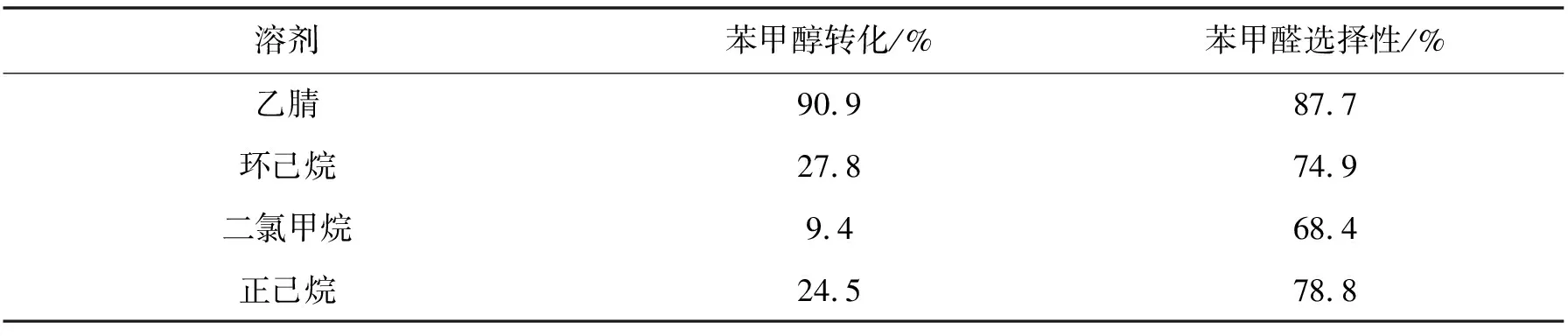
表4 不同溶剂对苯甲醇反应活性的影响
Reaction conditions: 0.02 g catalyst; 1.92 mmol(0.2 mL)benzyl alcohol;5.88 mmol(0.6 mL)30% H2O2;2 mL acetonitrile; 75 ℃, 6 h
2.2.4 催化剂的回收利用 以Fe2O3/C-400-20为例,考察了Fe2O3/C催化剂的稳定性.图5为该催化剂重复使用4次后的实验结果.第一次使用催化剂苯甲醇的转化率达到90.9%.催化剂回收4次后,苯甲醇的转化率还有84.2%,苯甲醛的选择性也基本保持不变.可见,经溶液燃烧合成的Fe2O3/C催化剂稳定性良好.
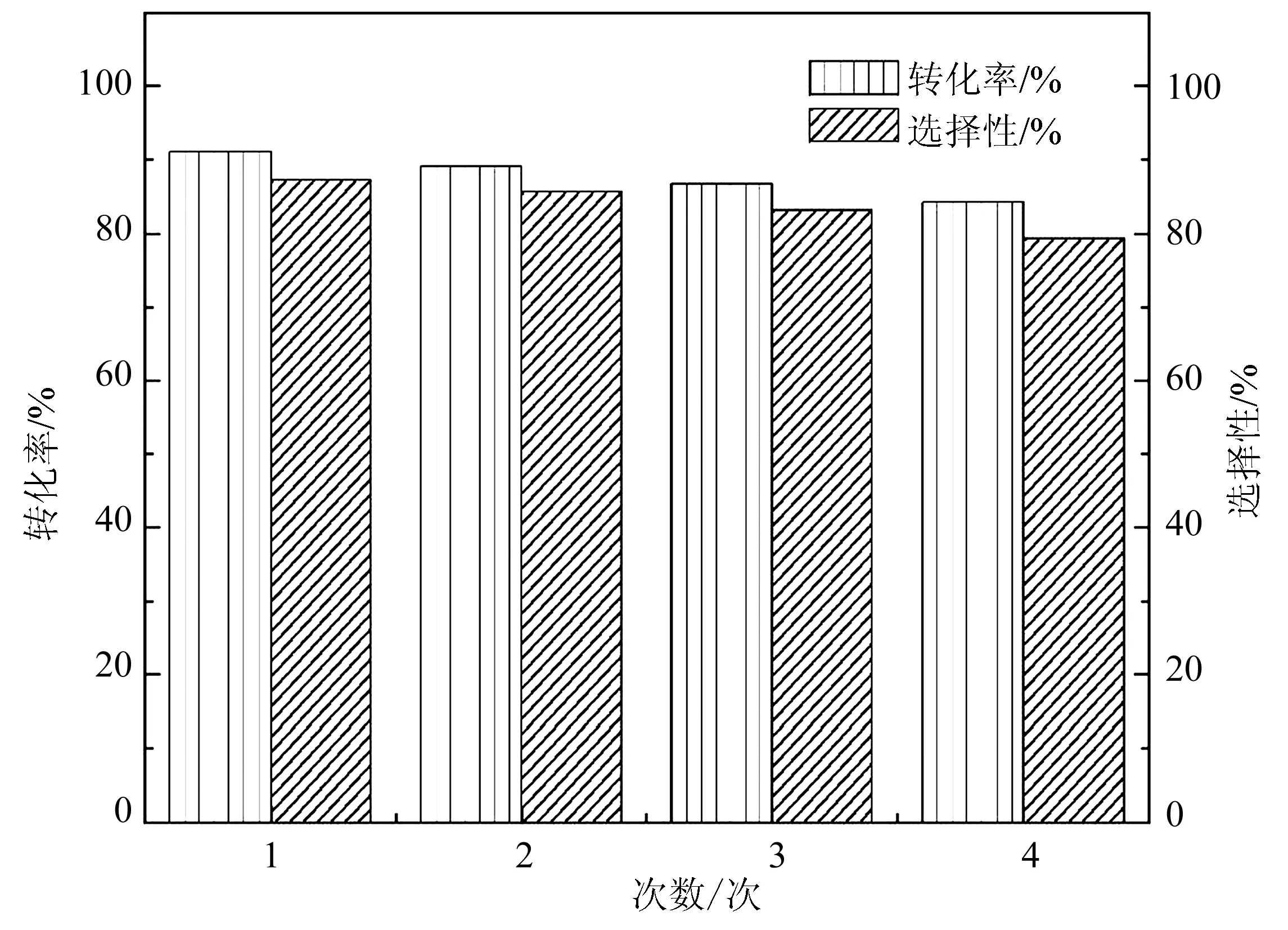
图5 催化剂重复使用对苯甲醇反应活性的影响Fig.5 Effect of catalyst use times on the reaction activity of benzyl alcohol Reaction conditions: 0.04 g catalyst; 1.92 mmol (0.2 mL) benzyl alcohol;5.88 mmol (0.6 mL)30% H2O2; 2 mL acetonitrile; 75 ℃, 6 h
3 结 论
以硝酸铁为氧化剂,尿素为燃料,碳球为载体,通过溶液燃烧法合成Fe2O3/C复合材料.葡萄糖经水热合成碳球后,以络合或静电相互作用的形式将金属阳离子牢固吸附到碳微球表面.经过高温溶液燃烧,铁的氧化物附着在碳球表面,形成球形结构.当增加燃烧时间,炭微球被更多的分解,便得到了空心的泡状球形结构.活性中心Fe3+在催化剂中以α-Fe2O3和γ-Fe2O3两种形式存在.Fe2O3/C催化剂在催化氧化苯甲醇制苯甲醛的反应中表现出较好的活性.其中,引发溶液燃烧温度400 ℃,燃烧时间20 min合成的催化剂最佳.
