硫酸亚铁铵制备材料的选择及反应时间的优化
2020-03-20张晔曾云斌李可新
张晔 曾云斌 李可新


摘要:硫酸亚铁铵的制备和质量检验,是大学实验中一个重要的无机综合实验.其中,制备硫酸亚铁这一步极为重要,对所得产品的产量和纯度有着直接的影响.因此,本文分别用铁屑和铁粉做原料,在反应时间不同的情况下,分析了产物的产量和质量.探索结果表明:铁屑是制备硫酸亚铁铵的最佳材料,最佳反应时间为50min.在此反应时间下制备的产物颜色为浅绿色,产率为87.52%,纯度为98.08%.
关键词:铁屑;铁粉;时间;硫酸亚铁;硫酸亚铁铵;纯度
中图分类号:O6-3 文献标识码:A 文章编号:1673-260X(2020)02-0048-03
1 前言
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O,在空气中比一般亚铁盐稳定,不容易被氧化,常用于定量化学分析[1]和废水处理的混凝剂,染料的媒染剂,农业杀虫剂等.
在硫酸亚铁铵的制备实验中涉及很多化学实验基本操作.在本科化学实验中是一个必不可少的无机综合实验.通常根据观察气泡来判断铁与酸反应进行的程度,依据产品的产率和纯度来判断制备是否成功.而制备中的准确称量,直接影响硫酸铵的加入量,进一步影响产品的纯度.为此本文分别选取了铁屑和铁粉作为制备硫酸亚铁铵的原材料,控制铁与硫酸反应的时间.最后利用蒸馏后滴定法和沉淀重量法测定产品中NH4+和SO42-的含量.通过对制备产物的产率、纯度、含量测定等,综合比较分析找出了反应的最佳时间和原材料.
加入过量BaCl2使样品中SO42-沉淀完全,加入适量盐酸以除去多余的碳酸钡沉淀,避免对实验产生干扰,至无气泡为止.将沉淀过滤,洗涤,烘干,称量.测定样品中SO42-含量.
3 实验药品及仪器
实验用到的试剂均为分析纯.除了一些简单常用的仪器外,还有北京普析通用仪器有限责任公司制造的722N可见分光光度计和TU-1810型紫外-可见分光光度计.
4 实验内容
4.1 硫酸亚铁的制备
向六个盛有洗净铁屑的烧杯中加入15mL3 mol/L硫酸溶液,盖上表面皿,放在恒温水浴锅上加热,温度控制在70-80℃[5].反应时间分别控制在20min、30min、40min、50min、60min和至无气泡为止.同样方法,做铁粉与硫酸的反应.反应过程中适当添加蒸馏水,以补充蒸发掉的水分,始终保持15mL溶液.趁热用短颈漏斗过滤[6].滤液滤入50mL蒸发皿中.
残渣用蒸馏水洗涤,用滤纸吸干后称量,计算溶液中FeSO4的物质的量.
4.2 (NH4)2Fe(SO4)2·6H2O的制备
根据FeSO4的量,按照反应方程式原理,准确计算所需固体(NH4)2SO4的量.
按计算值准确称取(NH4)SO4的固体,加入上述所制得的FeSO4溶液中,加热使硫酸铵全部溶解,并用3mol/L H2SO4溶液调节pH为1-2,继续蒸发浓缩至液面出现一层晶膜为止.静置,使之缓慢冷却,结晶.将布氏漏斗放在60 -70℃的烘箱中烘10-20min再减压抽滤.用少量无水乙醇洗去晶体表面所附着的水分,转移至表面皿上,晾干后称量.[7-9]
4.3 产品检验
4.3.1 (NH4)2Fe(SO4)2·6H2O含量的测定
准确称取1.0000g产品于250mL锥形瓶中,加50mL除氧的蒸馏水、15mL 3 mol/L H2SO4、2mL浓H3PO4,使试样溶解.加热至70-80℃,用KMnO4标准溶液滴定至终点.
根据KMnO4标准溶液的用量,按照反应方程式计算产品中(NH4)2Fe(SO4)2·6H2O的质量分数.
4.3.2 Fe3+的含量分析
(1)[Fe(SCN)6]3-最大吸收峰的確定
准确移取1.0000mL 0.01 mol/L Fe3+标准溶液于50mL容量瓶中,加4滴2mol/L HCl和2mL1mol/L KSCN溶液加水至50mL刻度,混匀,以空白液为参比液,在可见光区内(400-600nm),用TU-1810型紫外-可见分光光度计测其吸光度.
如图1所示,[Fe(SCN)6]3标准溶液最大吸收峰波长为480nm.
(2)Fe3+标准曲线的绘制[10]
准确移取一定体积的0.01mol/L Fe3+标准溶液,分别加入50mL容量瓶中,各加4滴2mol/LHCl和2mL1mol/L KSCN溶液,加水至刻度混匀.配制成一系列Fe3+标准溶液,以空白液为参比液,测其在最大吸收峰的吸光度.绘制标准曲线如图2.
曲线线性回归方程为:y=1.002x+0.0016.R2=0.9976,线性关系良好.
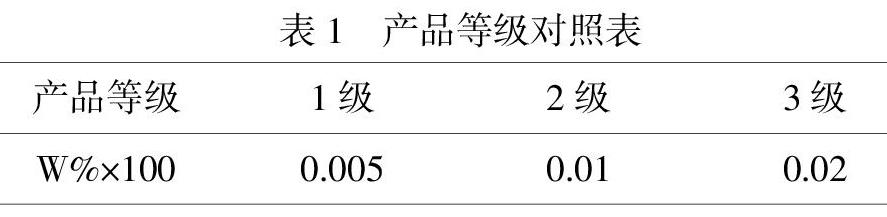
(3)准确称取2.0000g产品,置于小烧杯中,加少量除氧的蒸馏水使之溶解,再加入3mL 2 mol/L HCl溶液和1mL mol/L KSCN溶液,转移至50mL容量瓶中,最后用除氧的蒸馏水稀释到50.0mL,摇匀.用722N型分光光度计,在最大吸收峰波长480nm下测其吸光度,根据标准工作曲线公式计算Fe3+的体积,进而算出Fe3+质量分数W%,再用质量分数W%×100后与表对照以确定产品等级.
4.3.3 NH4+含量的分析
称取产物1.0000g于干燥的50mL蒸馏烧瓶中,然后取11mL 4mol/L NaOH于其中,用玻璃导管将产生的氨气导入盛有10mL 3mol/L HCl的250mL锥形瓶中,用酒精灯加热蒸馏烧瓶底部,直至无气泡产生为止.终止反应后,以酚酞为指示剂,用4.0000mol/L NaOH滴点多余的酸.
4.3.4 SO42-含量的测定
准确称取产物0.5000g于150mL燒杯中,用5mL蒸馏水充分将其溶解,向其中加入5mL 0.6 mol/L的BaCl2,使其充分沉淀后,再向其中加入过量盐酸,至无气泡为止,以除去多余的碳酸钡沉淀.将沉淀过滤,用蒸馏水洗涤沉淀.最后,烘干,称量.
改用铁粉为原料,重复4.1,4.2,4.3.2(3),4.3.3,4.3.4的操作.铁粉不用洗涤.
为了避免偶然性,我们每个实验都做了重复.成分的检测,以分析纯做了对照.
5 实验结果分析
5.1 硫酸亚铁铵产率
以铁粉做原料的,反应到45分钟,几乎没有气泡.以铁屑作原料的,反应到60分钟几乎没有气泡.从表2看出,铁粉和铁屑做原料的最高产率分别为92.76%和88.58%.
5.2 (NH4)2Fe(SO4)2·6H2O含量的测定
通过表3数据可看出,铁屑做原料所得产品纯度都比较高.反应50min时纯度最高,达到98.08%.
5.3 Fe3+的含量分析及产品等级
通过测定Fe3+的含量,又经过换算对比得到产品等级.所制得的产品中多为二级产品.只有一组铁屑反应50min制得的产品三价铁含量最低,为一级产品.
5.4 NH4+含量的分析
从表4数据看出,所得产物中的NH4+含量都高于分析纯试剂中的.但用铁屑做原料,相对来说,更接近分析纯试剂中的NH4+含量.各个时间段的NH4+含量相差不大,以50min中所得产物中的NH4+含量最接近分析纯试剂中的NH4+含量.这是因为对反应剩余物质称量有误差,导致加入过多(NH4)2Fe(SO4)2的缘故.铁粉粒径很小,易于在滤纸上沾附,容易出现称量偏差.
5.5 SO42-含量的分析
根据表5分析,铁屑作原料,反应20min、30min、40min的产物中,SO42-含量都接近分析纯试剂中的SO42-含量,50min的最接近分析纯的SO42-含量.但反应60min的产物中,SO42-高于分析纯试剂中的SO42-含量.用铁粉做原料的,SO42-均远远高于分析纯试剂中的SO42-含量,和NH4+分析的结果一致.
在以铁屑制备硫酸亚铁铵的实验中,将铁屑反应时间控制在50min时反应已无大量气泡,产品为浅绿色晶体.若反应时间超过50min,继续加长反应时间直至无气泡,虽然可以提高产量,但会导致加入过量的硫酸铵,使产品纯度降低.
以铁粉做原料的实验中,将铁粉反应时间控制为40min时,反应已无大量气泡.且硫酸亚铁铵产量仅次于反应时间为45min时的产量.通过NH4+含量的分析和SO42-含量的分析发现,以铁粉制备硫酸亚铁铵,无论制备硫酸亚铁反应时间控制在多少,都存在加入过量硫酸铵的问题.最终使硫酸亚铁铵纯度下降.
6 总结
实验结果分析表明,分别以铁屑和铁粉制备硫酸亚铁铵的实验中,在制备硫酸亚铁时,铁屑的最佳反应时间为50min,在此反应时间下制备的产物颜色为浅绿色、最高产率为87.52%、最优等级为1级、最高纯度为98.08%.产物中所含杂质硫酸铵较少.而铁粉的最佳反应时间为40min,在此反应时间下制备的产物颜色为浅绿色(略带点白色)、最高产率为91.85%、最优等级为2级、最高纯度为90.65%.但产物中所含的硫酸铵较多.综合二者比较,铁粉虽反应要快一些,产率要高一些.但伴随着的是纯度下降,等级降低,硫酸铵加入过量,产品色泽差.所以,综合考虑,本实验的最佳条件为以铁屑制备硫酸亚铁铵,铁屑最佳反应时间为50min.
参考文献:
〔1〕Pathak A, Dastidar M G, Sreekrishnan T R. Bioleaching of heavy metals from sewage sludge by indigenous iron-oxidizing microorganismsusing ammonium ferrous sulfate and ferrous sulfate as energy sources: acomparative study[J]. Journal of Hazardous Materials,2009,171(1):273-278.
〔2〕赵新华.无机化学实验[M].4版.北京:高等教育出版社,2014.
〔3〕北京大学化学系分析化学教学组.基础分析化学实验[M].2版.北京:北京大学出版社,1998.
〔4〕耿金灵.硫酸亚铁铵的纯度和组成的测定[J].实验技术与管理,2009,26(5):33-36.
〔5〕王永明.硫酸亚铁铵制备实验条件探讨[J].实验室科学,2014,17(3):11-15.
〔6〕姜述芹.硫酸亚铁铵制备实验的改进探索[J].实验室研究与探索,2005,24(7):19-20.
〔7〕翟丽萍.硫酸亚铁铵制备工业的研究[J].精细与专用化学品,2011,19(3):16-19.
〔8〕季然.硫酸亚铁铵制备实验条件的优化研究[J].广东化工,2017,44(6):78-79.
〔9〕曾淼.川党参中铁元素含量的测定[J].时代农机,2017,44(1):155-157.
〔10〕燕翔.制备硫酸亚铁铵单晶的实验研究[J].首都师范大学学报,2015,36(4):49-51.
