磁性复合载体固定生姜蛋白酶的酶学性质研究
2020-03-20罗璇陈常缘王秀原杜婧加刘婧雨吴蒙
罗璇,陈常缘,王秀原,杜婧加,刘婧雨,吴蒙
(武汉设计工程学院 食品与生物科技学院,武汉 430205)
酶作为一种高效、安全的生物催化剂,已被广泛地运用在食品原料开发、品质改良、工艺改造等领域[1]。其中蛋白酶是食品加工生产中应用最广泛的酶种之一,被广泛用于奶制品、豆制品等食品的精细加工[2]。生姜蛋白酶作为新型的植物蛋白酶,不仅具有药用保健价值,还可用作食品添加剂,其应用前景广泛。然而,在实际生产应用中,游离的生姜蛋白酶稳定性较差,易失活,但可通过对其进行固定化,以显著提高酶稳定性[3]。
目前,国内外对生姜蛋白酶的提取、纯化及固定化已有了较多报道,但利用新型载体磁性复合物固定生姜蛋白酶及其酶学性质的研究却未见报道。
磁性Fe3O4纳米粒子可以和各种天然生物大分子、合成高分子及无机物反应生成磁性复合微球,并借助外部磁场将其应用在流床式酶反应器中,使其表面积增大,提高固定化酶的催化效率[4,5]。但由于载体会影响酶蛋白的活性,从而会限制酶的活性中心,因而酶学性质将受到不同程度的影响[6]。
为了解决这一问题,本文通过单因素实验法来确定固定化生姜蛋白酶的最佳条件,并对磁性凝胶微球固定生姜蛋白酶的酶学性质进行了研究;探讨酶固定化的最适条件,以期在提高酶的催化效果的同时实现酶的重复使用,将酶的利用价值最大化。
1 材料与方法
1.1 材料与器材
鲜生姜:市售;磷酸氢二钠、磷酸二氢钠、柠檬酸钠、氨水、海藻酸钠、明胶、三氯化铁、硫酸亚铁、三氯乙酸、碳酸钠、干酪素、50%戊二醛、氯化钙:均为分析纯;福林酚试剂:生物纯。
TG16-WS离心机 长沙湘智离心机仪器公司;FA2014B电子天平 上海越平科技仪器有限公司;UV2000紫外可见分光光度计 尤尼柯(上海)仪器有限公司;HH-S2电热恒温水浴锅、SHZ-88恒温振荡器 金坛市医疗仪器厂。
1.2 方法
1.2.1 生姜蛋白酶液的制备
取外形完好、无腐烂和机械损伤的新鲜生姜50 g洗净, 切成小块后,加入2倍体积的磷酸氢二钠-磷酸二氢钠缓冲液(0.05 mol/L,pH 6)研磨30 min, 过滤, 将滤液收集至250 mL的三角瓶中,并置于4 ℃冰箱中,2 h后以4000 r/min离心10 min,取上清液,即得生姜蛋白酶液,测其初始酶活。
1.2.2 Fe3O4磁核的制备
将0.25 mol/L的硫酸亚铁溶液100 mL、0.5 mol/L氯化铁溶液200 mL以及0.1 mol/L柠檬酸钠溶液40 mL混合,于75 ℃恒温搅拌10 min,滴加10%氨水调节pH至10,并等待其继续反应40 min后,离心10 min,弃上清液,滤渣用蒸馏水重复洗涤至中性,放入80 ℃烘箱中干燥,保存备用。
1.2.3 磁性微球的制备方法
将一定量的Fe3O4磁核、3.5%海藻酸钠及3.0%明胶以一定体积比例混合,室温下恒温振荡器混合均匀;用注射器吸取上述混合液,从一定高度滴入浓度为2%的CaCl2溶液中,以形成凝胶微球;更换CaCl2溶液,于4 ℃下静置硬化2 h后,再滤出凝胶微球,用质量分数为0.9%的NaCl溶液洗涤,沥干,于 50 ℃干燥。
1.2.4 固定化生姜蛋白酶
将磁性凝胶微球与戊二醛交联2.5 h后,用蒸馏水洗涤,并于50 ℃干燥,以获得磁性凝胶微球复合载体。将其与酶液混合,室温下恒温振荡器混合均匀,用蒸馏水洗涤,获得磁性复合载体固定化生姜蛋白酶,并测其酶活。
1.2.5 酪氨酸标准曲线的制作方法[7,8]
取上述溶液各1.00 mL,各加0.4 mol/L的碳酸钠溶液5.0 mL, 福林试剂1.00 mL, 在40 ℃左右(±0.2 ℃)水浴中使其显色20 min, 将分光光度计波长设置为680 nm, 分别测定其吸光度, 并以OD值为纵坐标,酪氨酸标准溶液的浓度为横坐标, 绘制标准曲线。
1.2.6 单因素实验

表2 单因素实验因素水平Table 2 Factors and levels of single factor experiment
由表2可知单因素实验条件,测定其对应的酶活力,并换算成相对酶活力。
1.2.7 方差分析
基于上述单因素实验所测得的数据,通过SPSS 18.0处理,确定影响固定化酶活力的各因素的大小关系并进行方差分析。
1.2.8 酶学性质的研究
1.2.8.1 酶的最适温度及温度稳定性测定
检测固定化生姜蛋白酶和游离生姜蛋白酶在不同温度(20~80 ℃)下的酶活力,确定酶的最适温度。然后将两种酶分别在不同温度下处理1 h,在最适温度下检测各自酶活力,并计算热处理后的剩余酶活力(%),分析两种酶的温度稳定性。
1.2.8.2 酶的最适pH及酸碱稳定性测定[9]
测定固定化生姜蛋白酶和游离生姜蛋白酶在不同pH (3.0~8.0)下的酶活力,确定最适pH。再将两种酶分别置于不同pH的0.1 mol/L 柠檬酸缓冲液中,4 ℃下处理2 h,在最适pH下检测各自酶活力,计算酸碱处理后剩余的酶活力(%),分析两种酶的酸碱稳定性。
1.2.8.3 酶的动力学参数测定
测定酶的米氏常数(Km):分别测定底物生姜蛋白浓度范围在1.0~5.0 mg/mL时,固定化酶和游离酶的酶活力,利用Lineweaver-Burk双倒数作图法作图可得游离生姜蛋白酶的米氏常数和固定化生姜蛋白酶的表观米氏常数。
1.2.8.4 固定化酶操作稳定性的测定
测定上述制备的1 g固定化生姜蛋白酶的酶活力,固定化酶每使用一次,用蒸馏水清洗3次,再次进行测定,并计算出相对酶活力(%);连续测定6次,根据测定的酶活力分析固定化酶的操作稳定性。
1.2.8.5 固定化酶储存稳定性的测定
固定化酶在25 ℃下每隔2 d测其剩余酶活力(%),共测定5次。
1.2.8.6 酶活力和相对酶活力的测定[10]
酶活力测定方法:分别取酶液和酪蛋白底物1 mL于水浴预热 2 min,混合均匀后继续恒温反应10 min,加入 0.4 mol/L 三氯乙酸 2 mL,沉淀残余蛋白。离心,取 1 mL 上清液,加入 0.4 mol/L 碳酸钠溶液和1 mL稀释后的福林酚试剂,混合均匀,在 40 ℃水浴显色 10 min,用紫外可见分光光度计测试其在 680 nm 下的吸光度。
生姜蛋白酶活力(U)=A×K×N×4/10。
式中:A为样品的平均吸光度值;K为100除以酪氨酸标准曲线上100 μg/mL对应680 nm处的吸光度值;N为酶液稀释倍数;4为反应液总体积;10为10 min,酶液分解酪蛋白反应时间。
固定化酶相对酶活力(%)=每次使用后固定化酶活力/最高固定化酶活力×100。
2 结果与分析
2.1 酪氨酸标准曲线
由图1可知,酪氨酸标准曲线的R2=0.9983,说明线性关系良好。

图1 酪氨酸标准曲线Fig.1 Standard curve of tyrosine
2.2 单因素实验结果与方差分析
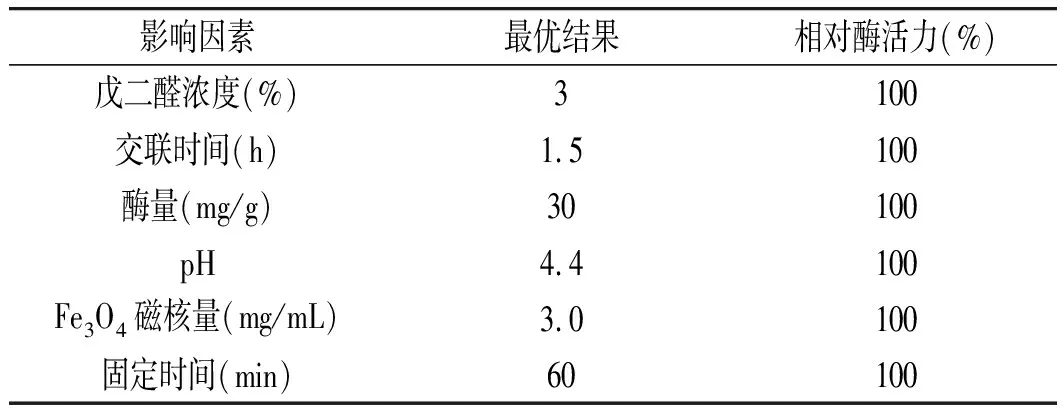
表3 单因素实验结果Table 3 Results of single factor experiments
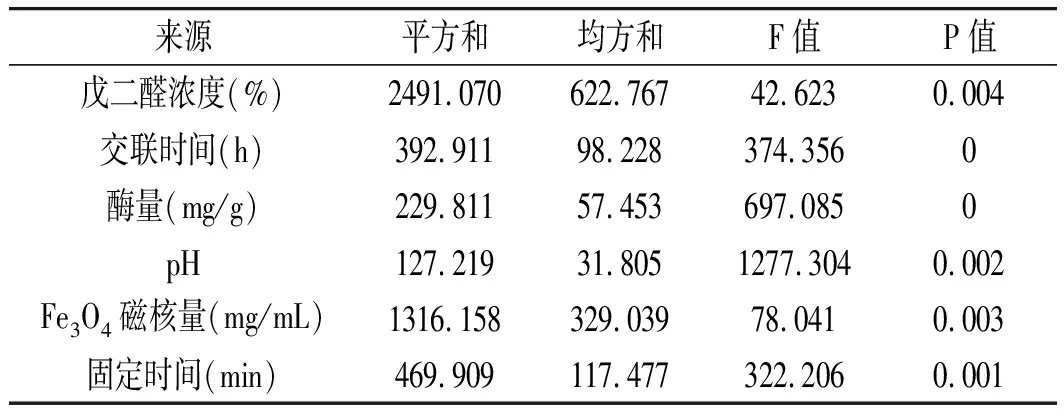
表4 单因素实验方差分析Table 4 Analysis of variance of single factor experiments
单因素的实验数据借助SPSS 18.0来处理,通过F检验,查表可知当F≥F表时表明两组数据存在显著差异;P值即概率,反映某一事件发生的可能性大小,P<0.001为有极其显著的统计学差异。所以,确定影响固定化生姜蛋白酶酶活力各因素的大小关系为:交联时间>酶量>固定时间>pH>Fe3O4磁核量>戊二醛浓度。其中交联时间、酶量、固定时间3个因素的P值分别为0,0,0.001,是影响固定化生姜蛋白酶的主要因素,戊二醛的浓度、Fe3O4磁核量、pH影响的显著性相对较弱。
2.3 酶学性质的研究
2.3.1 酶的最适温度测定
温度升高会使维持酶蛋白空间构象的次级键发生断裂从而导致酶变性失活,而固定化的酶由于酶分子与载体间多处连接可防止由于温度过高引起的酶分子伸展变形作用。由图2可知,固定化生姜蛋白酶的最适温度(60 ℃)大于游离酶的最适温度(50 ℃),说明固定化酶的温度稳定性有一定程度的提高。
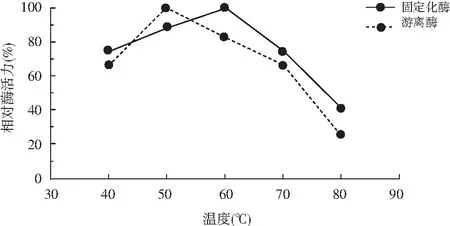
图2 酶的最适温度测定Fig.2 Determination of optimum temperature of enzymes
2.3.2 酶的最适pH测定

图3 酶的最适pH测定Fig.3 Determination of optimum pH value of enzymes
由图3可知,固定化生姜蛋白酶最适pH均为5.0,固定化生姜蛋白酶在pH 3.0~6.0范围内相对稳定,而游离酶的最适pH为6.0,最适范围在pH 5.0~7.0;说明固定化酶比游离酶更能在酸性条件下保持活性。
2.3.3 酶的动力学参数测定
在不同的生姜蛋白底物浓度下分别测定固定化生姜蛋白酶和游离酶的酶活力,采用Lineweaver-Burk双倒数作图法[11],以滴定度(及消耗的NaOH 体积)对时间作图,得一直线,其斜率即为初速度V1.0(相当于1.0 mg/mL的蛋白酶浓度),然后分别取2.0,3.0,4.0,5.0 mg/mL的底物重复上述操作,分别测出V2.0、V3.0、V4.0、V5.0,以反应速度倒数为x,底物浓度为y作图,得固定化生姜蛋白酶的线性方程为:y=0.6897x+0.1004,可得固定化酶表观米氏常数Km=6.869 mg/mL;游离酶的线性方程为y=0.3805x+0.2743,求得游离酶的米氏常数Km=1.387 mg/mL。说明经磁性复合载体固定的生姜蛋白酶对底物的亲和力有所下降,但并不显著。酶与底物的亲和力有下降得是正常现象,但下降得太多会影响到达最大反应速率的时间。
2.3.4 固定化生姜蛋白酶操作稳定性的测定
对固定化酶进行重复使用,重复使用4次,相对酶活力为56.71%;重复使用5次,酶活力还剩余44.83%,而且磁性球形载体还保持较好弹性,破碎现象少;游离酶在重复使用3次后,酶活力只剩下了50.24%;重复使用5次后只剩下20.18%,相对酶活力极低。

图4 酶的动力学参数的测定Fig.4 Determination of kinetic parameters of enzymes

图5 生姜蛋白酶操作稳定性的测定Fig.5 Determination of operational stability of ginger protease
由图5可知,以海藻酸钠-明胶协同的磁性复合载体固定化的生姜蛋白酶不仅酶活力回收率高,且操作稳定性更优于游离酶。
2.3.5 固定化生姜蛋白酶储存稳定性的测定
固定化酶在25 ℃条件下每隔2 d测其相对酶活力(%),共测5次。固定化酶在25 ℃条件下储存2 d,相对酶活力可达88.47%;但25 ℃下储存10 d后,固定化酶活力只剩50.66%,而游离酶在25 ℃条件下储存2 d,相对酶活力可达86.34%,但25 ℃下储存10 d后,游离酶活力只剩33.57%。
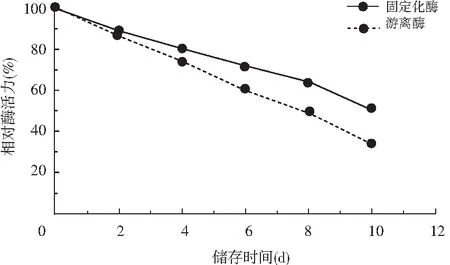
图6 固定化生姜蛋白酶储存稳定性的测定Fig.6 Determination of storage stability of immobilized ginger protease
由图6可知,固定化酶及游离酶的活力随着储存时间的延长会逐渐降低,但磁性复合载体固定化的生姜蛋白酶储存稳定性相比于游离酶的储存稳定性较高。
3 结论
实验采用海藻酸钠与明胶为载体,对磁性Fe3O4进行包埋,形成了磁性复合载体凝胶微球。当浓度为3.0%,戊二醛中交联1.5 h,1 g磁球载体中加入30 mg/g酶量时可制得弹性好且不易碎的磁性微球载体;磁性海藻酸钠-明胶协同固定化生姜蛋白酶的最适pH为5.0,最适温度为60 ℃,在pH 3.0~6.0、40~70 ℃温度范围内固定化酶相对稳定,表观米氏常数Km=6.869 mg/mL,重复使用4次后,相对酶活力为56.71%,重复使用5次后,酶活力还剩余44.83%,此时磁性球形载体还保持较好弹性;经磁性固定化后的酶在25 ℃条件下储存2 d,相对酶活力为88.47%;储存10 d后,酶活力仍达50.66%。
而游离酶的最适pH为6.0,最适温度为50 ℃,在pH 5.0~7.0、50~60 ℃温度范围内酶相对稳定;表观米氏常数Km=1.387 mg/mL;游离酶在重复使用3次后,酶活力只剩下了50.24%,重复使用5次后只剩下20.18%;在25 ℃条件下储存2 d,相对酶活力为86.34%,但在25 ℃下储存10 d后,游离酶活力只剩33.57%。由此可知,在同等条件下,磁性复合载体固定生姜蛋白酶所表现出来的酶学性质要远远优于游离酶。
