丹葛酚酮胶囊HPLC指纹图谱及9种有效成分的含量测定
2020-03-17刘小艳黄志芳罗春梅刘玉红刘云华汤依娜易进海
刘小艳,黄志芳,罗春梅,刘玉红,刘云华,陈 燕,汤依娜,易进海*
1西南医科大学药学院,泸州 646000;2四川省中医药科学院 中药材品质及创新中药研究四川省重点实验室,成都 610041
丹葛酚酮胶囊为重大新药创制项目研制的组分中药新药,有效组分为丹参总酚酸、总丹参酮和葛根总黄酮,具有和血滋阴,通络止痛之功效,用于糖尿病周围神经病变属阴虚血瘀证,已获得国家药品监督管理局临床批件(2018L02595)。本品中丹参总酚酸主要成分有迷迭香酸、紫草酸、丹酚酸B等,具有抑制血小板聚集、扩张冠状动脉及抗血栓形成等作用[1-4];总丹参酮主要含丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮、二氢丹参酮Ⅰ等,具有抗氧化、消炎抑菌、心脏保护、抗动脉粥样硬化等作用[1,2,4,5];葛根总黄酮主要成分有3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷等,具有降低血管阻力,改善心脑血液循环、降低心机耗氧量等作用[6-8]。
中药指纹图谱能很好地表征中药复方的整体质量概貌,且已广泛应用于各种中药复方制剂的质量控制[9-12]。为了更全面地建立丹葛酚酮胶囊的质量控制方法,利用指纹图谱整体性和模糊性的特点,结合多指标有效成分的定量分析进行产品一致性评价,本文建立了丹葛酚酮胶囊的HPLC指纹图谱,并同时测定制剂中葛根素、3′-羟基葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA9种主要有效成分的含量,对控制产品批次间的差异,保证其质量可控、稳定、安全有效具有重要意义。本文所建立的方法操作简便,特征性强,能够较全面地表征主要活性成分的含量差异,以期为该新药的质量控制提供科学依据。
1 仪器与试药
1.1 仪器
Agilent 1260型高效液相色谱仪(美国Agilent科技公司);SECURA225D-1CN电子分析天平(北京赛多利斯科学仪器有限公司);KQ-300型超声波清洗仪(昆山市超声仪器有限公司);Milli-Q Integral 3型超纯水机(美国Millipore公司)。
1.2 试药
3′-羟基葛根素对照品(批号:DST180912-075)、葛根素-6′′-O-木糖苷对照品(批号:DST190110-054)、3′-甲氧基葛根素对照品(批号:DST190115-122)、葛根素芹菜糖苷对照品(批号:DST190116-055)、刺芒柄花苷对照品(批号:DST190114-044)、隐丹参酮对照品(批号:MUST-18041115)、丹参酮Ⅰ对照品(批号:MUST-18032207)、二氢丹参酮Ⅰ对照品(批号:MUST-18032705)、紫草酸对照品(批号:MUST-14052702)均购自成都曼思特生物科技有限公司,纯度均≥98%;葛根素对照品(批号:110752-20161,纯度:95.4%)、大豆苷对照品(批号:111738-201603,纯度:93.3%)、染料木苷对照品(批号:111709-201702,纯度:99.9%)、丹参酮ⅡA对照品(批号:110766-201520,纯度:98.9%)、丹酚酸B对照品(批号:111562-201716,纯度:94.1%)、迷迭香酸对照品(批号:111871-201706,纯度:90.5%),均购自中国食品药品检定研究院;亚甲基丹参醌对照品(批号:180912A,纯度:98%),购自南京道斯夫生物科技有限公司。乙腈(色谱纯,美国Fisher公司);甲醇(分析纯,成都市科龙化工试剂厂);甲酸(色谱纯,天津市科密欧化学试剂有限公司);其他试剂均为分析纯;水(超纯水,超纯水机制得)。10批丹葛酚酮胶囊由四川省中医药科学院制备(每粒装0.39 g,编号S1~S10)。
2 方法与结果
2.1 色谱条件
采用Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm);流动相0.05%甲酸(A)-乙腈(B);梯度洗脱(0~3 min,3% B;3~5 min,3% B→11% B;5~25 min,11% B;25~30 min,11% B→20% B;30~38 min,20% B;38~50 min,20% B→32% B;50~60 min,32% B→52% B;60~80 min,52% B→68% B;80~90 min,68% B→70% B);流速1 mL/min;检测波长280 nm;柱温30 ℃;进样量10 μL。
2.2 对照品溶液的制备
精密称取各对照品适量,加入70%甲醇溶解并定容至刻度,制成每1 mL分别含3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA1.214、2.333、0.685、0.641、1.564、2.350、0.641、0.107、0.581 mg的储备液;分别精密量取以上对照品储备液适量,置于5 mL量瓶中,70%甲醇定容,制得每1 ml分别含3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA73.6、440.1、97.9、130.8、117.3、499.5、13.0、6.5、23.5 μg的混合对照品溶液。
2.3 供试品溶液的制备
取丹葛酚酮胶囊内容物约40 mg,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称定重量,超声处理30 min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。
2.4 阴性对照溶液的制备
按照丹葛酚酮胶囊处方和制法,参照“2.3”供试品溶液的制备方法,分别制备缺丹参、葛根的阴性对照溶液。
2.5 HPLC指纹图谱方法学考察
2.5.1 精密度试验
取同一供试品(S5)溶液,依照“2.1”项下的色谱条件,连续进样6次,以丹酚酸B为参照峰,测得各共有峰相对保留时间RSD<0.5%,相对峰面积RSD<2%(n=6),表明仪器精密度好。
2.5.2 稳定性试验
取同一供试品(S5)溶液,依照“2.1”项下的色谱条件,分别于制备后的0、2、4、8、12、24 h进行测定,以丹酚酸B为参照峰,测得各共有峰相对保留时间RSD<0.5%,相对峰面积RSD<2%(n=6),表明供试品溶液于24 h内测定结果稳定。
2.5.3 重复性试验
取同一丹葛酚酮胶囊(S5)内容物约40 mg,精密称定,按“2.3”项下方法平行制备6份供试品溶液,依照“2.1”项下的色谱条件依次测定,丹酚酸B为参照峰,测得各共有峰相对保留时间RSD<0.5%,相对峰面积RSD<2%(n=6),表明该方法重复性好。
2.6 指纹图谱建立、相似度分析及共有峰确认
2.6.1 相似度评价
依照“2.3”项下方法分别制备10批丹葛酚酮胶囊供试品溶液(编号S1~S10),按照“2.1”项下的色谱条件依次测定,记录100分钟的HPLC图。将得到的10批色谱图导入“中药色谱指纹图谱相似度评价系统(2012版)”软件,设定S1为参照图谱,采用平均数法生成对照指纹图谱,见图1和图2。计算S1~S10批样品与对照图谱的相似度(见表1)。10批丹葛酚酮胶囊指纹图谱与对照图谱之间相似度均大于0.99,表明各批次丹葛酚酮胶囊样品之间的质量相对稳定。
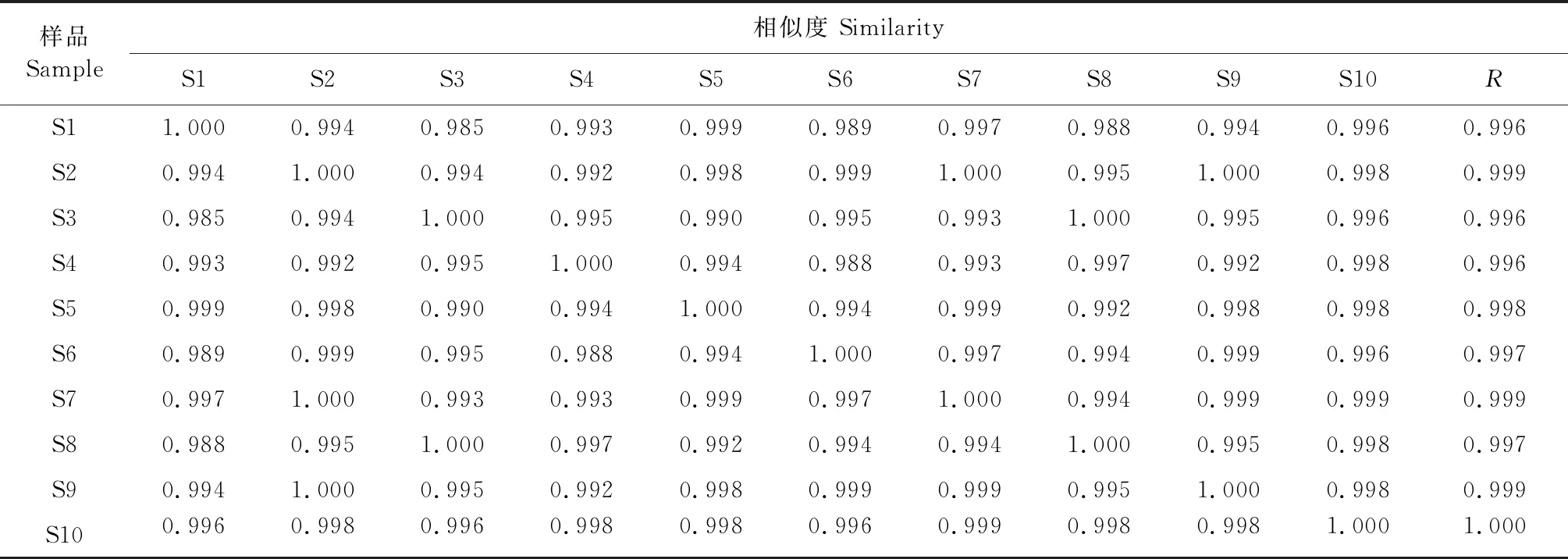
表1 10批样品相似度评价结果
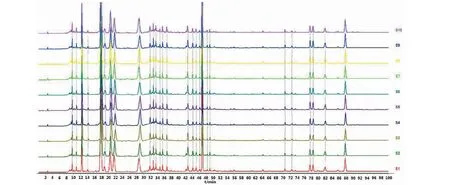
图1 10批丹葛酚酮胶囊HPLC指纹图谱Fig.1 HPLC fingerprints of ten batches of Dangefentong Capsules
2.6.2 共有峰指认与归属
通过建立丹葛酚酮胶囊指纹图谱的共有模式,从10批样品图谱的共有指纹区标定了28个共有峰,经过与对照品比对并结合DAD光谱,确认出其中16个色谱峰,分别为3号峰3′-羟基葛根素、5号峰葛根素、6号峰葛根素-6′′-O-木糖苷、7号峰3′-甲氧基葛根素、8号峰葛根素芹菜糖苷、9号峰大豆苷、13号峰染料木苷、16号峰迷迭香酸、17号峰紫草酸、19号峰刺芒柄花苷、20号峰丹酚酸B、23号峰二氢丹参酮Ⅰ、25号峰隐丹参酮、26号峰丹参酮Ⅰ、27号峰亚甲基丹参醌、28号峰丹参酮ⅡA。再结合阴性对照图谱、丹葛酚酮胶囊指纹图谱,28个共有峰都可以找到明确归属,其中1~15、18、19、21号峰为葛根黄酮成分,16、17、20、22号峰为丹参酚酸成分,23~28号峰为丹参酮成分(见图3)。

图2 对照指纹图谱Fig.2 Reference fingerprint
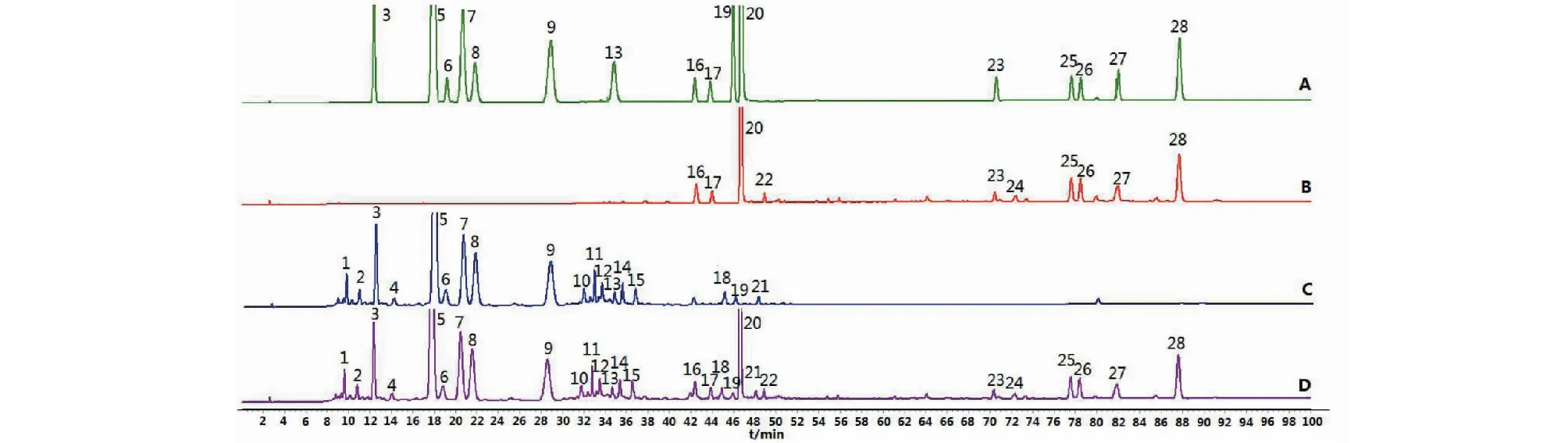
图3 对照品、阴性对照及供试品指纹图谱Fig.3 HPLC fingerprints of reference substance,negative controls and test sample注:3.3′-羟基葛根素;5.葛根素;6.葛根素-6′′-O-木糖苷;7.3′-甲氧基葛根素;8.葛根素芹菜糖苷;9.大豆苷;13.染料木苷;16.迷迭香酸;17.紫草酸;19.刺芒柄花苷;20.丹酚酸B;23.二氢丹参酮Ⅰ;25.隐丹参酮;26.丹参酮Ⅰ;27.亚甲基丹参醌;28.丹参酮ⅡA;A.对照品;B.缺葛根阴性对照;C.缺丹参阴性对照;D.供试品。Note: 3.3′-hydroxy puerarin;5.Puerarin;6.Puerarin-6′′-O-xyloside;7.3′-methoxy puerarin;8.Puerarin celery glycoside;9.Daidzin;13.Dye Lignin;16.Rosmarinic acid;17.Lithosperic acid;19.Thorn stalk;20.Salvianolic acid B;23.dihydrotanshinone I;25.Cryptotanshinone;26.Tanshinone I;27.Kedan Ginseng;28.Tanshinone IIA;A.reference substance;B.lack of Radix Puerariae Lobatae negative control;C.lack of Radix et Rhizoma Salviae Miltiorrhizae negative control;D.test sample
2.7 含量测定
2.7.1 阴性干扰试验
精密吸取丹葛酚酮胶囊(S5)供试品溶液、缺葛根阴性对照溶液、缺丹参阴性对照溶液,按照“2.1”项下色谱条件进行测定。结果显示,缺丹参和缺葛根阴性样品在对照品相应保留时间处无明显色谱峰,表明阴性样品对测定无干扰,该方法专属性良好,如图3所示。
2.7.2 线性关系考察
分别精密吸取混合对照品溶液适量,以70%甲醇逐级稀释成6个系列浓度的混合对照品溶液。按照“2.1”项下色谱条件进行测定。以峰面积为纵坐标(Y),进样浓度(mg/mL)为横坐标(X),进行线性回归,结果表明各化合物在相应范围内线性关系良好(见表2)。
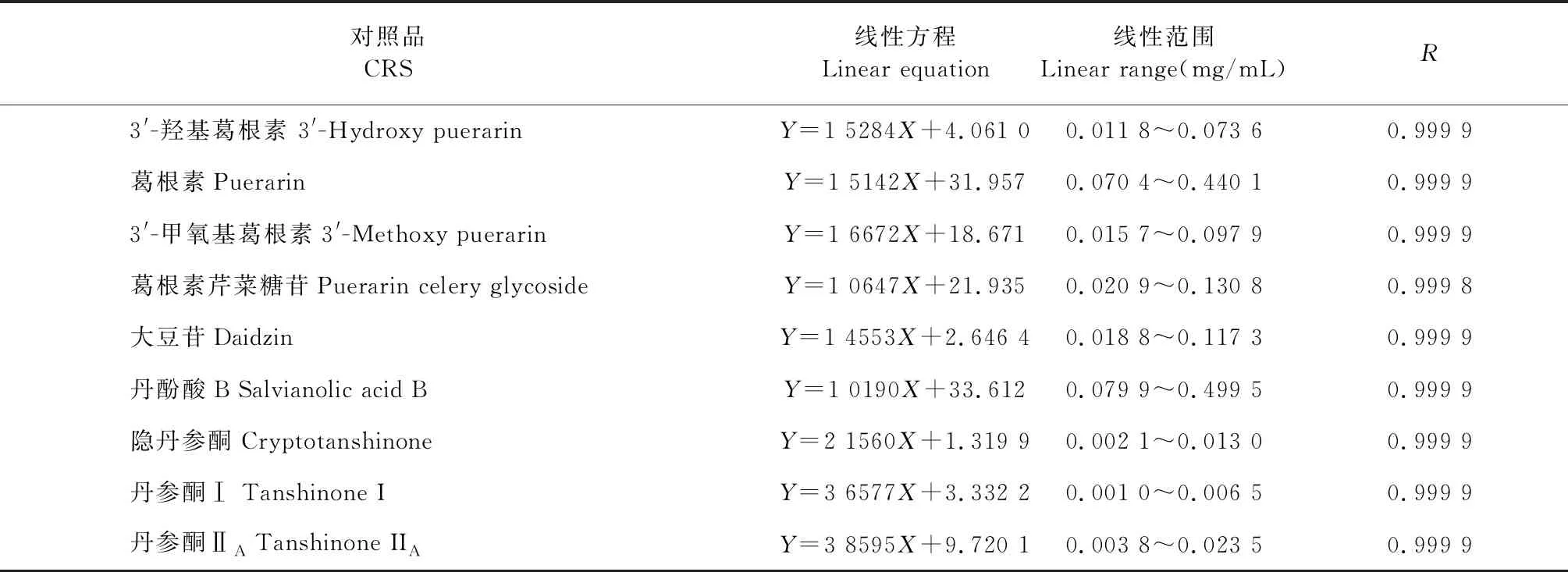
表2 各成分线性关系
2.7.3 精密度试验
取同一丹葛酚酮胶囊(S5)供试品溶液,按照“2.1”项下色谱条件连续进样6次,记录峰面积。结果显示3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的RSD分别为0.53%、0.27%、0.82%、0.62%、0.45%、0.21%、0.20%、0.56%、0.16%(n=6)。表明仪器精密度好。
2.7.4 稳定性试验
取同一丹葛酚酮胶囊(S5)供试品溶液,按照“2.1”项下色谱条件,分别于制备后0、2、4、8、12、24 h进行分析测定。结果显示,3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的RSD分别为0.64%、0.49%、0.97%、0.71%、0.89%、0.32%、0.44%、0.75%、1.11%(n=6)。表明供试品溶液在24 h内稳定性良好。
2.7.5 重复性试验
取同一丹葛酚酮胶囊(S5)样品,按照“2.3”项下方法平行制备6份供试品溶液,照“2.1”项下色谱条件分析测定。结果显示,3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的平均含量分别为25.65、167.78、38.20、49.48、39.04、170.93、6.68、3.68、9.69 mg/g,RSD分别为0.50%、0.56%、0.55%、0.84%、0.88%、0.53%、0.44%、0.63%、0.57%(n=6)。表明重复性良好。
2.7.6 加样回收率试验
取已知含量的丹葛酚酮胶囊(S5)样品,每份约20 mg,精密称定,置具塞锥形瓶中,共6份,分别精密加入对照品适量,按“2.3”项下方法制备成供试品溶液,照“2.1”项下色谱条件分析测定,计算各成分的回收率及RSD值。3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的平均加样回收率分别为97.28%、102.72%、100.44%、103.75%、98.46%、99.07%、101.60%、101.14%、101.00%,其RSD值分别为1.54%、1.22%、0.57%、1.40%、1.26%、1.43%、2.38%、1.30%、1.33%(n=6),表明样品的回收率良好(见表3)。
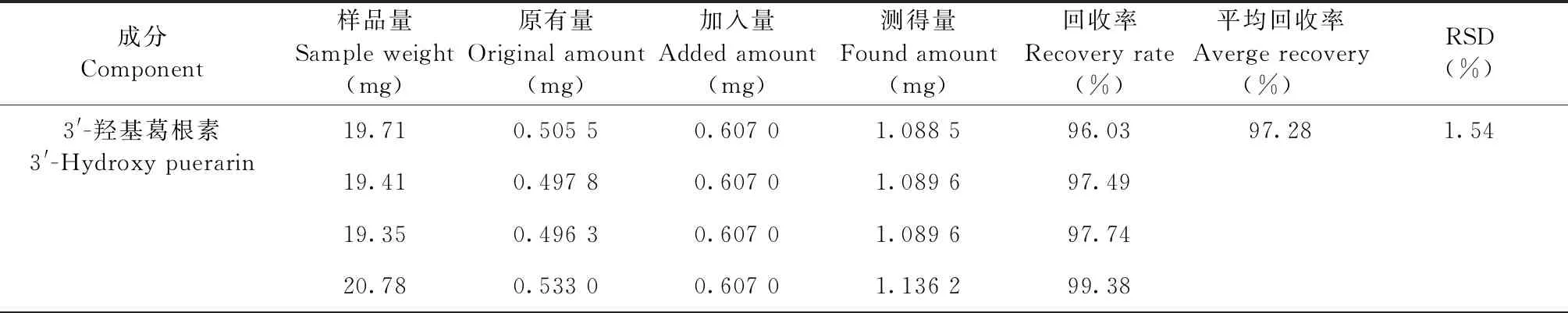
表3 加样回收率试验结果(n=6)
续表3(Continued Tab.3)
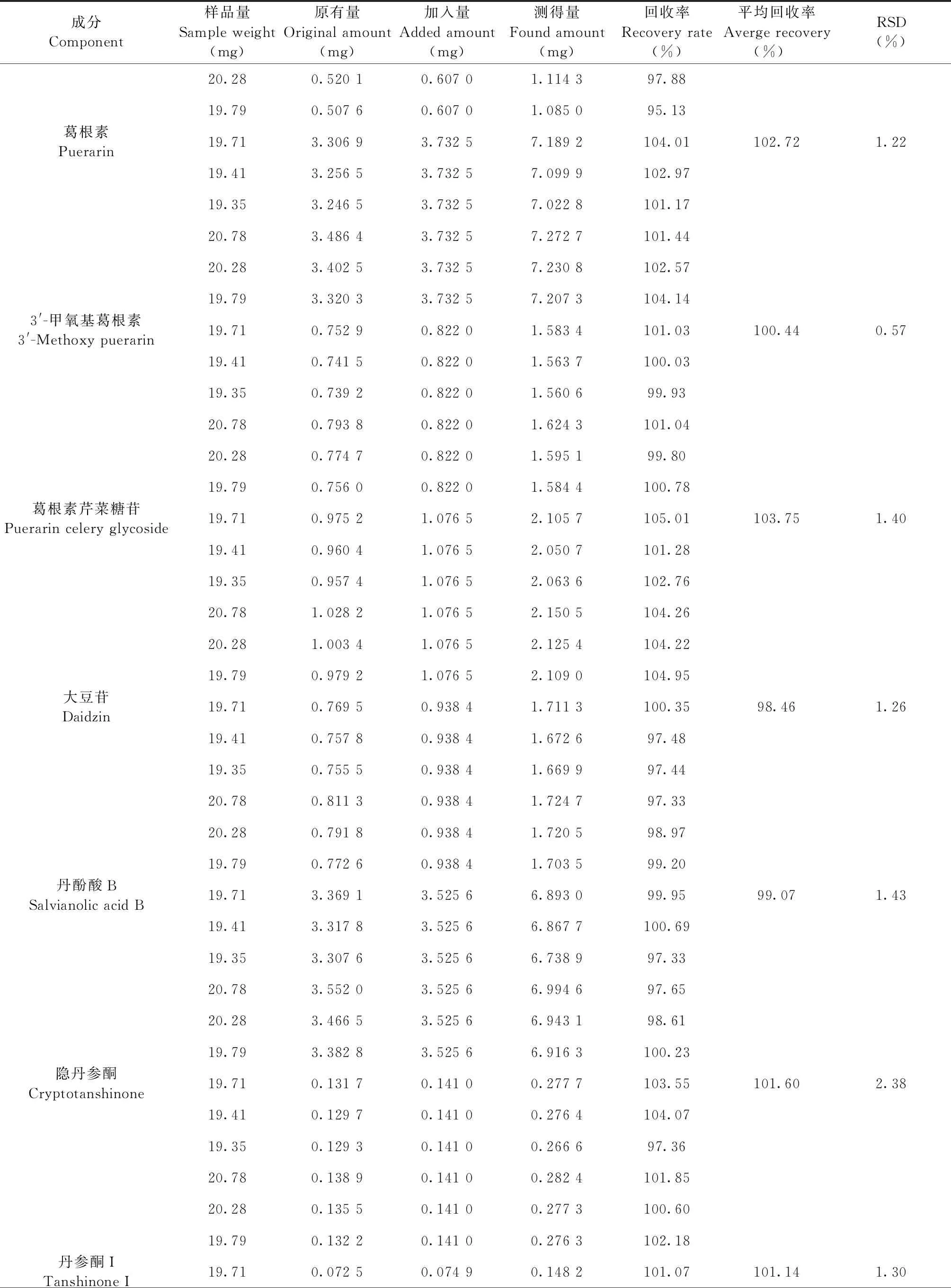
成分Component样品量Sample weight(mg)原有量Original amount(mg)加入量Added amount(mg)测得量Found amount(mg)回收率Recovery rate(%)平均回收率Averge recovery(%) RSD(%)20.280.520 10.607 01.114 397.8819.790.507 60.607 01.085 095.13葛根素Puerarin19.713.306 93.732 57.189 2104.01102.721.2219.413.256 53.732 57.099 9102.9719.353.246 53.732 57.022 8101.1720.783.486 43.732 57.272 7101.4420.283.402 53.732 57.230 8102.5719.793.320 33.732 57.207 3104.143'-甲氧基葛根素3'-Methoxy puerarin 19.710.752 90.822 01.583 4101.03100.440.5719.410.741 50.822 01.563 7100.0319.350.739 20.822 01.560 699.9320.780.793 80.822 01.624 3101.0420.280.774 70.822 01.595 199.8019.790.756 00.822 01.584 4100.78葛根素芹菜糖苷Puerarin celery glycoside19.710.975 21.076 52.105 7105.01103.751.4019.410.960 41.076 52.050 7101.2819.350.957 41.076 52.063 6102.7620.781.028 21.076 52.150 5104.2620.281.003 41.076 52.125 4104.2219.790.979 21.076 52.109 0104.95大豆苷Daidzin19.710.769 50.938 41.711 3100.3598.461.2619.410.757 80.938 41.672 697.4819.350.755 50.938 41.669 997.4420.780.811 30.938 41.724 797.3320.280.791 80.938 41.720 598.9719.790.772 60.938 41.703 599.20丹酚酸BSalvianolic acid B19.713.369 13.525 66.893 099.9599.071.4319.413.317 83.525 66.867 7100.6919.353.307 63.525 66.738 997.3320.783.552 03.525 66.994 697.6520.283.466 53.525 66.943 198.6119.793.382 83.525 66.916 3100.23隐丹参酮Cryptotanshinone19.710.131 70.141 00.277 7103.55101.602.3819.410.129 70.141 00.276 4104.0719.350.129 30.141 00.266 697.3620.780.138 90.141 00.282 4101.8520.280.135 50.141 00.277 3100.6019.790.132 20.141 00.276 3102.18丹参酮ITanshinone I19.710.072 50.074 90.148 2101.07101.141.30
续表3(Continued Tab.3)
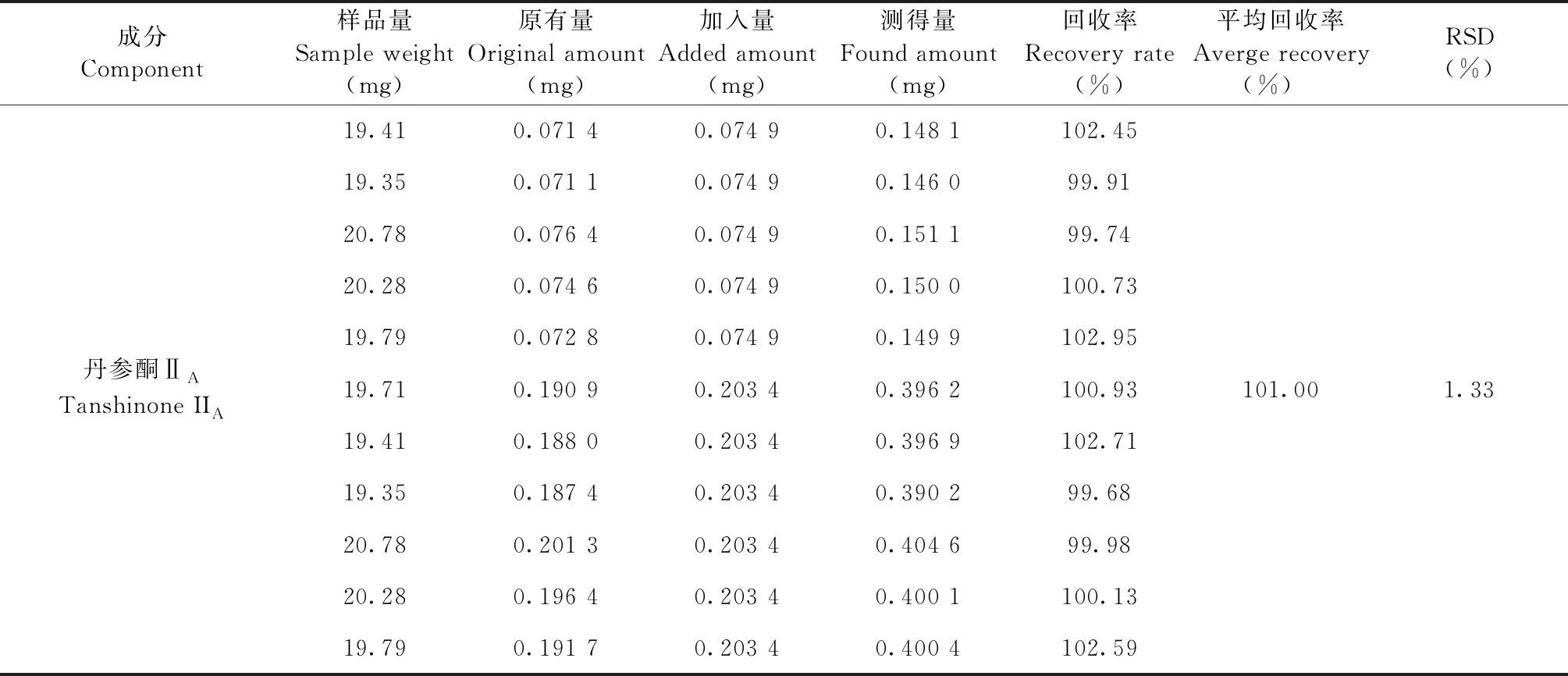
成分Component样品量Sample weight(mg)原有量Original amount(mg)加入量Added amount(mg)测得量Found amount(mg)回收率Recovery rate(%)平均回收率Averge recovery(%) RSD(%)19.410.071 40.074 90.148 1102.4519.350.071 10.074 90.146 099.9120.780.076 40.074 90.151 199.7420.280.074 60.074 90.150 0100.7319.790.072 80.074 90.149 9102.95丹参酮ⅡATanshinone IIA19.710.190 90.203 40.396 2100.93101.001.3319.410.188 00.203 40.396 9102.7119.350.187 40.203 40.390 299.6820.780.201 30.203 40.404 699.9820.280.196 40.203 40.400 1100.1319.790.191 70.203 40.400 4102.59
2.8 样品含量测定
取10批丹葛酚酮胶囊样品(S1~S10),按“2.3”项下方法制备供试品溶液,照“2.1”项下色谱条件分析测定,计算样品中3′-羟基葛根素、葛根素、3′-甲氧基葛根素、葛根素芹菜糖苷、大豆苷、丹酚酸B、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡA的含量。结果见表4。
3 讨论
3.1 流动相选择
本实验比较了甲醇-0.4%乙酸、乙腈-0.4%乙酸、乙腈-0.1%甲酸、乙腈-0.05%甲酸等流动相系统,结果显示,乙腈-0.05%甲酸系统的分离效果最好,各色谱峰峰形较好,基本达到基线分离。
3.2 检测波长选择
为了使各特征峰均具有较好的响应,比较了不同检测波长(250、270、275、280 nm)下各色谱峰的峰形和分离度,结果显示,280 nm处各指标性成分峰形较好,响应值较高,分离度理想。
3.3 提取条件选择
比较了不同提取溶剂(80%甲醇、70%甲醇、50%甲醇、甲醇、30%乙醇)对提取效果的影响,结果表明,70%甲醇的提取效果优于其他提取溶剂,此时丹葛酚酮胶囊中各待测成分含量最高。
3.4 丹葛酚酮胶囊的质量评价
指纹图谱能够全面地反映丹葛酚酮胶囊中多种成分的有无及成分间比例的相似程度[13],相对于指纹图谱反映的“宏观”特征,对有效成分的含量控制即属于“细化”指标,反映了发挥药效作用的化学成分的直观含量[14]。10批样品的指纹图谱相似度均大于0.99,表明本品固定了药材基源和产地,原料质量和成品生产工艺稳定,因此,样品间质量有较好的一致性;含量测定结果显示,成品中有效成分的种类相对稳定,但其含量受不同批次间药材及成品收率差异的影响,从而存在一定的差异,这也提示了“指纹图谱联合多成分含量测定”对其质量控制的必要性和全面性[14]。本实验建立的指纹图谱标定了28个共有峰,可对样品中的丹参和葛根进行整体特征识别,定量方法可对9种主要有效成分含量进行分析,能分别从定性与定量两个方面对丹葛酚酮胶囊的质量进行控制。
