肉牛肝脏miR-31对运输应激的响应及生物学功能预测
2020-03-12袁建彬王訢丞徐佩戎胡惠洁杨焕民郭景茹黑龙江八一农垦大学动物科技学院黑龙江大庆163319
袁建彬,王訢丞,徐佩戎,胡惠洁,杨焕民,郭景茹 (黑龙江八一农垦大学 动物科技学院,黑龙江 大庆163319)
运输是一种复杂的应激源,其中动物暴露于一系列负面刺激,如振动,新的环境,温度和湿度的变化,噪音等其他不良因素,都可能导致福利问题以及经济损失。肉牛的运输是现代多站点养殖业必不可少的必然过程。运输对肉牛来说是一种强烈的应激过程,可能诱发多种疾病甚至死亡,从而造成巨大的经济损失。然而,肉牛运输应激发生的分子机制尚不清楚。在应激发生过程中,生物系统会激活不同的机制以维持其相应的各种应激功能。研究表明,应激条件可以使miRNAs表达发生变化,进而影响生物学功能。miRNAs是一类长度为20~24个核苷酸的小型非编码RNA,可以在转录后水平调节靶基因表达,并在各种生物过程中发挥关键的调节作用,例如发育,细胞分化,细胞凋亡,肿瘤发生以及各种生物中的免疫和应激反应。了解运输动物中的miRNAs表达模式可能有助于阐明运输应激反应的调节机制,这将有助于设计增强运输应激抵抗力的策略。miR-31在众多癌症的发生发展过程中起到了关键性的作用。研究发现,miR-31可以作为一个重要的促癌基因[1],同时,有研究表明,miR-31的过表达可以促进细胞增殖并增强癌细胞的迁移和侵袭能力[2],在癌症的发生和发展中起着致癌作用[3]。探究运输应激与miR-31 可能的潜在关系,是本试验的目的所在。
1 材料与方法
1.1 主要试剂及仪器CFX96型荧光定量PCR 仪(美国Bio-rad公司);反转录试剂盒RR047A(日本Takara公司);核酸蛋白测定仪(美国Thermo 公司);混合型球磨仪MM400(德国Retsch公司);Trizol试剂(美国Invitrogen公司)。
1.2 实验动物及分组本试验以体况良好的杂交肉牛为试验对象,以速度80 km/h公路运输。随机将10头试验牛平均分为运输0 h组和运输6 h组,每组5头。运输过程中禁食、禁水,采集肝脏组织,储存于-80℃条件,用于后续试验。
1.3 引物设计及合成依照miR-31的序列设计引物,序列见表1,委托生工生物工程(上海)股份有限公司合成引物。试验将U6作为内参。

表1 miRNA 的引物序列
1.4 肝脏组织总RNA提取和cDNA合成取0.1 g肝脏组织样品,使用球磨仪加入适量液氮研磨破碎,利用Trizol一步法提取肝脏组织中总RNA;将测定浓度后的RNA 进行反转录,反转录的具体操作步骤依照Ta KaRa RR047A 反转录试剂盒说明进行。
1.5 肝脏组织中miR-31表达的检测使用CFX96型荧光定量PCR 仪(Bio-rad)对肉牛肝脏组织中miR-31表达进行检测,按照Ta KaRa荧光定量PCR试剂盒步骤进行操作。25μL体系依次加入如下试剂,见表2。循环参数设置如下:首先95℃条件预变性30 s;95℃条件变性5 s,接下来60℃条件退火延伸30 s,按照上述条件进行40个循环。建立融解曲线,在合适的区间进行溶解试验。
1.6 统计学分析采用2-ΔΔCt法对所得qRT-PCR结果进行统计学分析。使用独立t检验对数据进行显著性分析,P<0.01差异极显著,P<0.05差异显著。

表2 荧光定量PCR 反应体系
1.7 对miR-3 进行生物信息学分析应用Targetscan、miRWalk、miRDB 和miRTarBase 4 款软件对miR-31的靶基因进行预测分析,再对miR-31参与的生物学进程进行Geneontology(http://geneontology.org/)分析,从而筛选出与运输应激相关性强的靶基因。
1.8 miR-31候选靶基因功能富集分析利用Gene ontology进行靶基因的功能研究,以牛(bos taurus)基因组作为背景基因,对miR-31 靶基因生物学过程进行富集分析。
2 结果
2.1 肝脏组织中miR-31 表达量的变化使用qRT-PCR 方法检测肉牛肝脏中miR-31 的相对表达量,结果显示,与运输0 h组相比,运输6 h组肝脏组织中miR-31相对表达量极显著上升(P<0.01)。
2.2 Go 富集分析结果应用Targetscan、miRWalk、miRDB 和miRTar Base 4 款 软 件 对miR-31靶基因进行预测,结果如图2所示,Targetscan中预测到427种靶基因;miRWalk中预测到1 261种靶基因;miRDB 中预测到122种靶基因;miRTarBase中预测到307种靶基因。
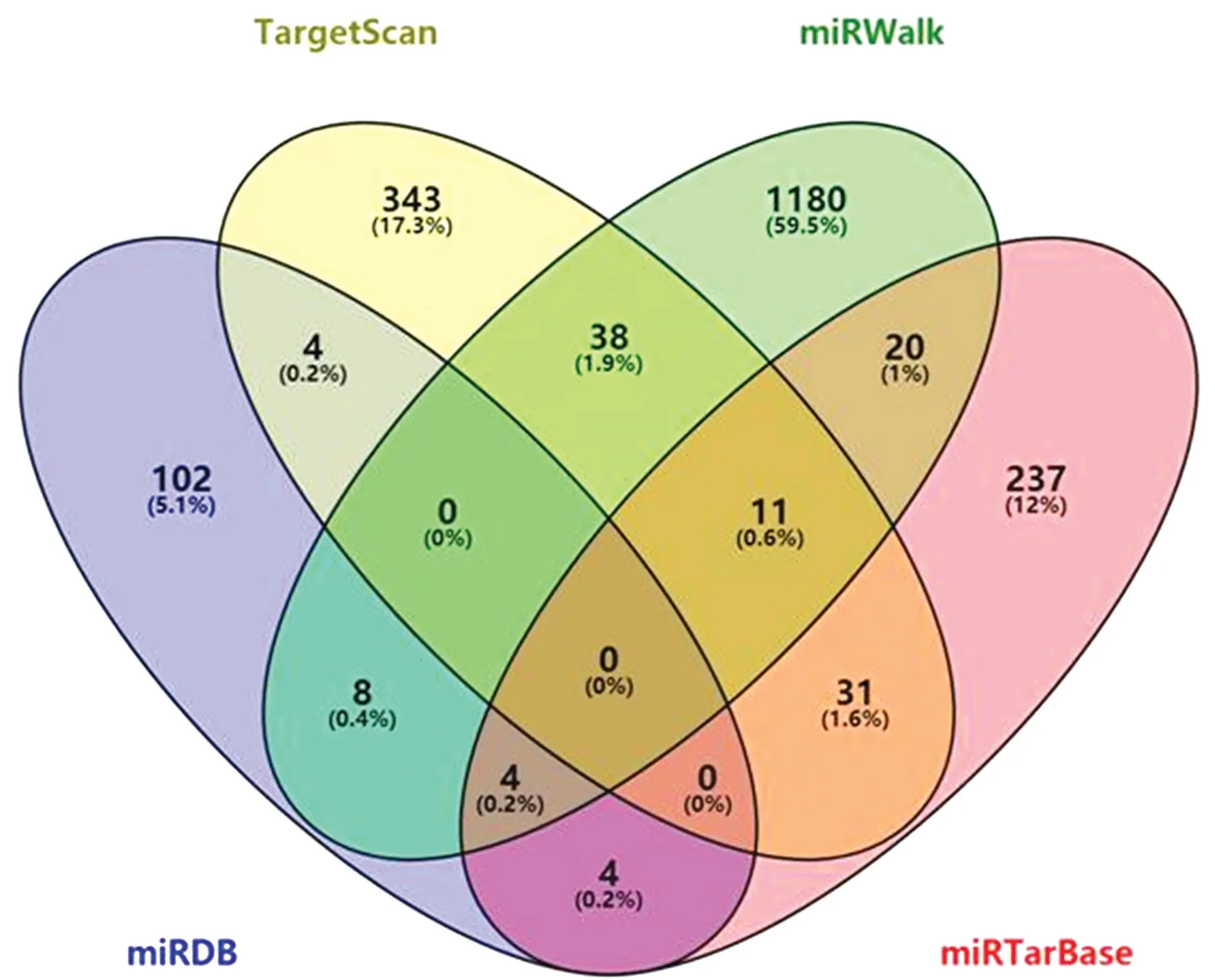
图2 miR-31靶基因预测统计图
2.3 生物信息学分析结果通过GO 分析(http://amigo.geneontology.org/amigo/search/annotation)绘制出miR-31靶基因参与的生物进程。结果显示,miR-31参与多种生物过程,其中细胞过程,生物调节,代谢过程,多细胞生物过程,对刺激的反应等富集靶基因较多。
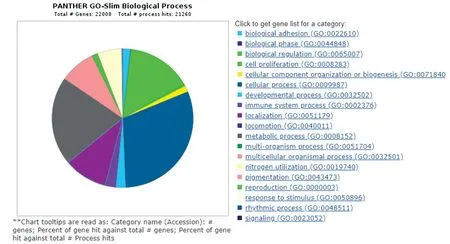
图3 miR-31参与的生物学进程
3 讨论
运输作为肉牛从养殖到深加工过程中一项关键环节已成为影响肉牛品质的常见应激源,对动物内环境有着巨大影响。运输应激会改变某些细胞因子、热休克蛋白和急性期蛋白的表达水平[4-5]。运输过程中特定指标的变化证明其可用于运输过程中动物福利的评估[6],这些指标被认为是应激诊断的参考标记。然而,迄今为止,尚未确定能够全面准确地评估应激发生的单一指标。研究已经证实了生物体中miRNAs的变化以响应不同的应激。miRNA 因其具有高度的保守性、时序性和组织特异性,众多研究人员将miRNAs作为多种疾病候选诊断标志物。动物中miRNAs的表达因环境应激而变化,包括热应激和冷应激等[7-9]。有研究表明,火鸡运输应激期间miR-22、miR-155和miR-365 3种miRNAs表达上调,表明循环miRNAs的表达水平可能具有区分应激和无应激动物的诊断价值。肝脏是身体的重要代谢器官,在受到外界不良刺激时,机体会迅速调动肝脏的活动性,抵御应激。检测动物肝脏中miRNAs的表达变化,可以为动物应激评估带来新的方式与手段。
miRNAs通过其微调基因表达的能力,成为抗应激反应过程中强大的适应性反应的关键参与者。已有大量研究在小鼠、牛、其他哺乳动物体内探讨了miRNAs在环境应激反应中的作用[10]。然而,在运输应激条件下,对于肉牛肝脏miRNAs的研究内容仍很浅显。本试验以运输应激的肉牛为研究对象,分析发生运输应激反应后肉牛肝脏中miR-31的变化,为深入探讨肉牛运输应激的分子基础和运输应激相关miRNAs的变化提供线索。GO 富集功能分析表明,运输应激相关的miRNAs参与了许多生物过程,其中细胞过程,生物调节,代谢过程,多细胞生物过程,对刺激的反应等富集靶基因较多,推测miR-31通过参与上述生物过程参与应激反应。有研究人员发现,应激时能量代谢的加快与肝脏密切相关,所以选取肝脏组织作为样品,探究运输应激与肝脏miRNAs间的关系。研究miR-31在运输肉牛肝脏中的表达模式,这将有利于动物运输和航空航天研究,并可将miR-31 作为潜在的运输应激诊断生物标志物。
miRNAs通常以负调控的方式作用于靶基因。RAB27A、PPP2R2A 和ARID1A 可 能 是 与 应 激 联系密切的miR-31 的靶基因。研究发现miR-31 可以调控细胞凋亡。Rab27A 能够促进细胞的增殖和侵袭,并抑制细胞凋亡。PPP2R2A 是一种蛋白磷酸酶,其与细胞生长、凋亡和分化密切相关,同时其活性异常会导致肿瘤发生。目前已证明PPP2R2A 可抑制MAPK/ERK 信号途径中的MAK、MAPK 和ERK 去磷酸化,促使MAPK ERK 信号通路失活[11]。另有研究表明PPP2R2A 能直接调节肿瘤细胞中凋亡抑制因子BCL-2和凋亡促进因子Bad的活性达到抑制肿瘤细胞的目的[12]。ARID1A 是染色质重塑复合物SWI/SNF 中的一种非催化亚基,具有非序列特异性DNA 结合活性,参与DNA 的复制、转录、修复和重组等,其异常表达影响着胚胎发育、组织生长、细胞增殖、分化和凋亡,并参与DNA合成及DNA 损伤后修复,同样作为一种抑癌基因。有研究表明,氧化应激可降低ARID1A 的表达[13]。我们发现ARID1A 表达的敲低导致细胞内ROS水平增加[14]。同样,有研究表明,ROS 通过调节其启动子的甲基化降低ARID1A 基因的表达水平[15]。
本试验中对运输应激肉牛肝脏miR-31的相对表达量进行检测,发现miR-31 显著上升。在运输应激条件下,miR-31可能通过作用于生物调节,代谢过程,多细胞生物进程,对刺激的反应等生物学进程来抵抗应激,并且对细胞增殖和凋亡可能有重要影响。了解运输动物miRNA 的表达模式可能有助于阐明运输应激反应的调节机制,这将有助于设计增加运输压力抵抗力的策略。本试验对探究运输应激与miR-31的关系具有重要意义,为miR-31在肉牛肝脏组织中调控应激反应的研究提供参考。
