牛病毒性腹泻病毒感染MDBK 细胞和家兔前后炎症因子的表达变化
2020-03-12任志军常丽云陈颖彬王紫燕秦建华赵月兰河北农业大学动物医学学院
任志军,康 茜,常丽云,陈颖彬,王紫燕,夏 颖,秦建华,赵月兰 (河北农业大学 动物医学学院,
河北保定071001)
牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)引起的一种极为复杂、呈多种临床类型的疾病。临床上以发热、黏膜糜烂、溃疡、白细胞减少、腹泻、急性死亡、孕畜流产、免疫耐受、持续性感染和免疫抑制为主要特征[1-2]。BVDV 不仅感染牛,也能感染绵羊、山羊、猪、鹿和其他反刍动物,此外还可以人工感染家兔[3-4]。病毒感染可以激活宿主细胞中的许多信号传导途径,从而引起宿主细胞内细胞因子的表达变化[5-6]。COX-2即环氧合酶2,是一完整的膜结合蛋白,在正常生理条件下,COX-2 处于不表达或低表达状态,而在病理条件下COX-2 能够迅速表达上调,且COX-2被激活后,能够催化花生四烯酸产生多种前列腺素,参与机体多种生理及病理过程[7]。IL-8 是一种强有力的活化因子和中性粒细胞趋化因子,当机体出现炎症反应时,IL-8 表达增加,通过血管内皮层渗透到组织间隙和炎症区域[8]。MIP-3α,即巨噬细胞炎性蛋白3α,2000年以后开始称为CC亚族趋化因子配体20,即CCL20,为CC 亚族的趋化细胞因子,主要表达于巨噬细胞、淋巴粒细胞和树突状细胞。MIP-3α可以诱导白细胞到炎症反应部位,并通过淋巴回路对白细胞的数量进行调节。有研究结果显示,该种因子与多种恶性肿瘤的发生发展,血管生成和局部的炎性细胞浸润有关,并且与癌细胞的转移与播散也有较为密切的联系[9]。生长调节致癌基因α(growth-regulated oncogene alpha,GRO-α)蛋白,是由107个氨基酸组成的细胞因子,其受体主要是与IL-8 共用的CXCR2[10]。为了解BVDV 感 染Madin-Darby 牛 肾 细 胞(Madin-Darby bovine kidney cells,MDBK)和家兔后的炎症因子变化,本试验从MDBK 细胞和家兔小肠、脾脏中分别扩增出炎症反应关键酶COX-2 和炎症因子IL-8、MIP-3α、GRO-α的基因片段,建立实时荧光相对定量RT-PCR 方法用于检测这4种炎症因子在细胞和组织中感染病毒前后的表达变化,以便在RNA转录水平上揭示BVDV 感染后的炎症因子变化,为研究BVDV 感染宿主细胞的分子机制奠定基础。
1 材料与方法
1.1 毒株、试验动物、试剂及仪器MDBK 细胞,由本实验室保存;BVDV NADL 毒株,购自中国兽药监察所。试验家兔,选择1 月龄雄兔,购自保定兔场。胎牛血清,购自杭州四季青公司;DMEM、胰蛋白酶,购自索莱宝科技有限公司;总RNA 提取试剂、反转录试剂盒、DL2000 DNA Marker、p MD19-T载体等,购自Ta KaRa公司;SYBR GreenⅠ实时定量PCR 试剂盒,购自北京全式金生物有限公司。二氧化碳培养箱(DHP9032),哈尔滨东联电子技术开发有限公司产品;生物安全柜(ZHIJ-1112C),郑州南北仪器设备有限公司;实时荧光定量PCR 仪,Roche公司LightCycler®96。
1.2 引物设计及合成根据GenBank中的炎症因子GAPDH、COX-2、IL-8、MIP-3α 和GRO-α 登录序列,运用Primer 5.0软件设计合成引物,由上海生工生物工程技术服务有限公司合成。引物的序列如表1。
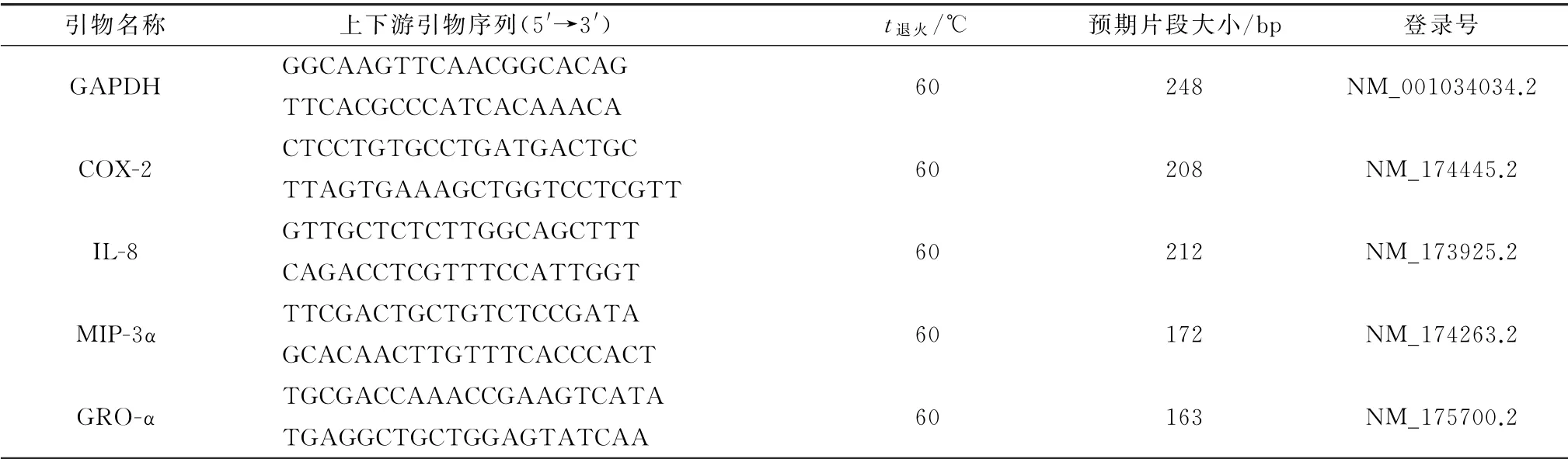
表1 PCR 引物序列与退火温度
1.3 BVDV的增殖取已冻存的MDBK 细胞进行复苏,待其培养稳定后,取1瓶长势为单层的细胞,将病毒原液稀释10倍接种于细胞上,37℃吸附1 h后,弃上清液,加入含2%胎牛血清维持液,继续培养观察;2 d后将细胞反复冻融3次,收集病毒悬液,并测定其TCID50。
1.4 BVDV感染MDBK 细胞模型的建立将长势良好的细胞,PBS清洗3遍,胰酶消化后,接种于6孔板,一组接种1 m L病毒悬液(100TCID50)作为试验组,另一组吸取1 m L 无血清DMEM 作为对照组。置于5%CO2的细胞培养箱中37℃吸附2 h后弃去吸附液,换上细胞维持液(即含有2%胎牛血清的DMEM),37℃培养8 h。
1.5 BVDV 感染家兔模型的建立用无血清DMEM (含双抗)将纯化病毒稀释至105.5TCID50/m L。将10只家兔随机分为2组,一组为对照组,每只耳静脉注射2 m L 含双抗的无血清DMEM;另一组为试验组,每只家兔耳静脉注射2 m L 病毒悬液。攻毒7 d后,将全部家兔处死,分别取各组的小肠组织和脾脏。
1.6 细胞总RNA的提取
1.6.1 BVDV 感染MDBK 细胞RNA 的提取 收获BVDV 感染前后的MDBK 细胞,提取MDBK 细胞总RNA,具体操作步骤按总RNA 提取试剂盒说明书进行。
1.6.2 家兔脾细胞和小肠细胞的分离和RNA 的提取 将取下的小肠组织去除系膜之后,先用PBS 溶液冲洗数次,除去肠内容物;纵向剖开肠道,用PBS洗数次;然后将肠段剪碎约1 mm3,转入50 m L 尖底离心管中,3 000 r/min离心5 min;去上清,沉淀即小肠细胞。分别分离各组的小肠细胞,提取总RNA,具体操作步骤按总RNA 提取试剂盒说明书进行。
将脾脏组织用PBS清洗后,剪切成1 mm3的小块;加入0.25% 胰酶液,37℃条件下消化30 min;在300目筛上轻轻研磨组织,得到滤液,2 000 r/min离心10 min;弃上清液,加入红细胞裂解液0.5 m L,常温裂解5 min,离心5 min;PBS 2 m L 重悬,离心5 min;弃上清液,加入PBS 5 m L,再离心1次,弃上清,沉淀即为脾细胞。分别分离各组的脾细胞,提取总RNA,具体操作步骤按总RNA 提取试剂盒说明书进行。
1.7.1 cDNA 的合成 按照1 g×DNA Eraser Buffer 1.0 m L、gDNA Eraser 1.0μL、RNA Free Water 3μL、RNA 5.0μL 于冰上配成反应体系,42℃水浴锅中反应2 min,即为去除基因组后的RNA;最后放于冰上备用。并按如下反转录体系进行反转录:去除基因组DNA 反应液10μL、Primer-Script RT Enzyme Mix 1.0μL、RT Primer Mix 1.0μL、5×PrimerScript Buffer 4.0μL、RNA Free Water 4.0μL,加入液体后轻轻摇晃后放置于PCR仪中进行作用:42℃15 min,85℃5 min。最后将反转录产物cDNA 放于-20℃留存。
1.7.2 相关炎症因子基因的扩增克隆和鉴定 PCR反应程序:95℃预变性5 min;95℃20 s,60℃20 s,72℃20 s,35 个循环;72℃延伸5 min,4℃终止反应。经1.5% 琼脂凝胶电泳回收目的片段,与p MD19-T 载体16℃过夜连接,转化DH5α感受态细胞,通过Amp板37℃过夜培养,挑取单菌落培养后提取质粒,PCR 鉴定为阳性后送博迈德基因技术有限公司测序。
1.7.3 实时荧光相对定量PCR 检测相关炎症因子方法的建立 分别以目的基因和内参基因的重组质粒为模板以10 倍梯度稀释后进行实时荧光定量PCR,实时荧光定量PCR 反应程序:95℃20 s,60℃20 s,72℃20 s,退火延伸时收集荧光信号。获得扩增各基因的标准曲线,扩增效率E 值,通过溶解曲线分析扩增的特异性。45个循环后进行溶解曲线分析,每个样品设3个重复。
1.7.4 相关炎症因子m RNA 表达量的检测 取反转录后cDNA,以GAPDH 基因为内参,按上述所建立的相对定量PCR 方法检测各个样品中COX-2和IL-8、MIP-3α、GRO-α的相对转录水平。采用比较Ct法(ΔΔCt)法分析相对定量结果。首先计算各个样品中目的基因与内参基因Ct差值,然后设各试验条件中对照组COX-2的表达量为1,通过Ct值计算公式:ΔΔCt=(Ct目的基因-Ct内参基因)试验组-(Ct目的基因-Ct内参基因)对照组,计算相对差异倍数,即QR=2-ΔΔCt,并进行统计学分析。∗表示差异显著(P<0.05),∗∗表示差异极显著(P<0.01)。
2 结果
2.1 目的基因PCR 扩增与鉴定结果提取的总RNA 经过反转录和PCR 扩增,结果见图1。得到与预期大小相符的单一扩增条带,GAPDH 为248 bp,COX-2 为208 bp,IL-8 为212 bp,MIP-3α为172 bp,GRO-α为163 bp。将目的基因回收纯化后,连接到p MD19-T 载体中。经测序GAPDH 大小为248 bp,COX-2 为208 bp,IL-8 为212 bp,MIP-3α为172 bp,GRO-α为163 bp,与预期结果一致。通过BLAST 发现测序所得序列与GenBank中登录序列相比同源性均在97%以上,证明扩增和回收的片段是目的基因片段(图2)。

图1 目的基因扩增的结果 M.DL2000 DNA Marker;1~5.分别为MIP-3α、COX-2、GRO-α、IL-8 和GAPDH 的 目标片段
2.2 实时荧光PCR产物的特异性分析经仪器分析软件得到PCR 产物的溶解曲线见图3,炎症反应关键酶COX-2和炎症因子IL-8、MIP-3α、GRO-α和内参基因GAPDH 的溶解温度分别是84~91℃,均成单峰,无引物二聚体或其他杂峰,表明特异性良好。
2.3 目的基因与内参基因的扩增效率通过仪器分析软件获得目的基因及内参基因的标准扩增曲线,见图4,扩增效率E 值分别为EGAPDH=2.03,EMIP-3α=2.05,ECOX-2=2.07,EGRO-α=2.07,EIL-8=2.05,对应的扩增相关系数R2分别为1.00,1.00,0.99,1.00,0.99,表明Ct值与模板浓度的线性关系较好。
2.4 BVDV 感染MDBK 前后COX-2、IL-8、MIP-3α、GRO-α 表达谱BVDV 感染MDBK 细胞8 h前后各炎症因子的表达量见图5,在BVDV 感染MDBK 细胞8 h后,COX-2、IL-8、GRO-α基因表达量均显著高于对照组(P<0.01),而MIP-3α 在BVDV 感染MDBK 细胞前后没有显著差异;表明BVDV 感染正常MDBK 细胞会促进COX-2、IL-8、GRO-α基因的表达。

图2 测序序列BLAST 比对结果 A.内参基因GAPDH;B.MIP-3α基因;C.COX-2基因;D.GRO-α基因;E.IL-8基因
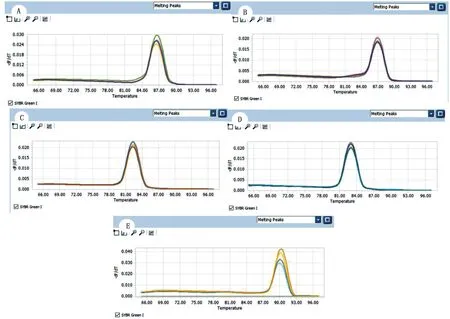
图3 4种炎症因子与内参基因相对定量PCR 扩增的溶解曲线 A.内参基因GAPDH;B.MIP-3α基因;C.COX-2 基因;D.GRO-α基因;E.IL-8基因
2.5 BVDV感染家兔前后脾细胞和小肠细胞COX-2、IL-8、MIP-3α、GRO-α表达谱家兔小肠和脾细胞感染前后各炎症因子的表达量见图6,7。在BVDV 感染家兔7 d后,家兔小肠细胞中MIP-3α表达量与健康家兔无明显差异,而脾脏中MIP-3α的表达量相比健康家兔明显上升,为2.84 倍(P<0.01)。在BVDV 感 染 家 兔7 d 后,COX-2、IL-8、GRO-α基因表达量也均显著高于对照组(P<0.05或P<0.01)。表明BVDV 感染正常家兔后会促进小肠细胞中COX-2、IL-8、GRO-α基因的表达以及脾细胞中COX-2、IL-8、MIP-3α、GRO-α 基因的表达。
3 讨论
免疫机能健全的健康易感牛群中发生的首次BVDV 感染通常为急性感染。BVDV 急性感染会造成病毒血症、繁殖障碍、免疫抑制等,导致机体继发感染几率大大增加[4,11]。本试验通过模拟BVDV急性感染,对BVDV 感染前后COX-2、IL-8、MIP-3α、GRO-α的表达量进行测定,发现感染后COX-2、IL-8、GRO-α的表达量均显著高于未感染前。从BVDV 感染后COX-2 m RNA 的显著升高可以得出结论,COX-2参与了BVDV 感染宿主的病理过程。COX-2 的启动子序列中含有核转录因子κB(NFκB)特异结合序列,该序列与NF-κB 结合后可以促进COX-2 基因的转录,因而COX-2 表达的上调伴随NF-κB 的活化[7]。参与IL-8诱导的经典转录因子是NF-κB。在人体胃癌中,NF-κB 通过正反馈作用调控IL-8 转录进而刺激肿瘤血管生成,促进肿瘤的浸润和转移[12]。IL-8 在胃癌中通过上调基质金属蛋白酶(matrix metalloproteinase,MMP)表达来促进肿瘤转移,高度表达的IL-8 参与促结肠癌的生长转移。在结肠癌中,NF-κB 刺激IL-8 产生,且内源性IL-8 又能激活NF-κB[13]。FREDERICKSEN等[14]发现BVDV-1能够通过NF-κB信号传导途径诱导牛细胞中IL-8的产生。另有报道发现GRO-α在结肠癌肝转移的细胞中诱导的信号转导通路主要与NF-кB及AKT 相关[10]。COX-2、IL-8及GROα的调控都与NF-кB信号通路相关,推测BVDV 感染宿主的过程中是通过激活NF-к 途径来促使COX-2、IL-8和GRO-αm RNA 表达上调。
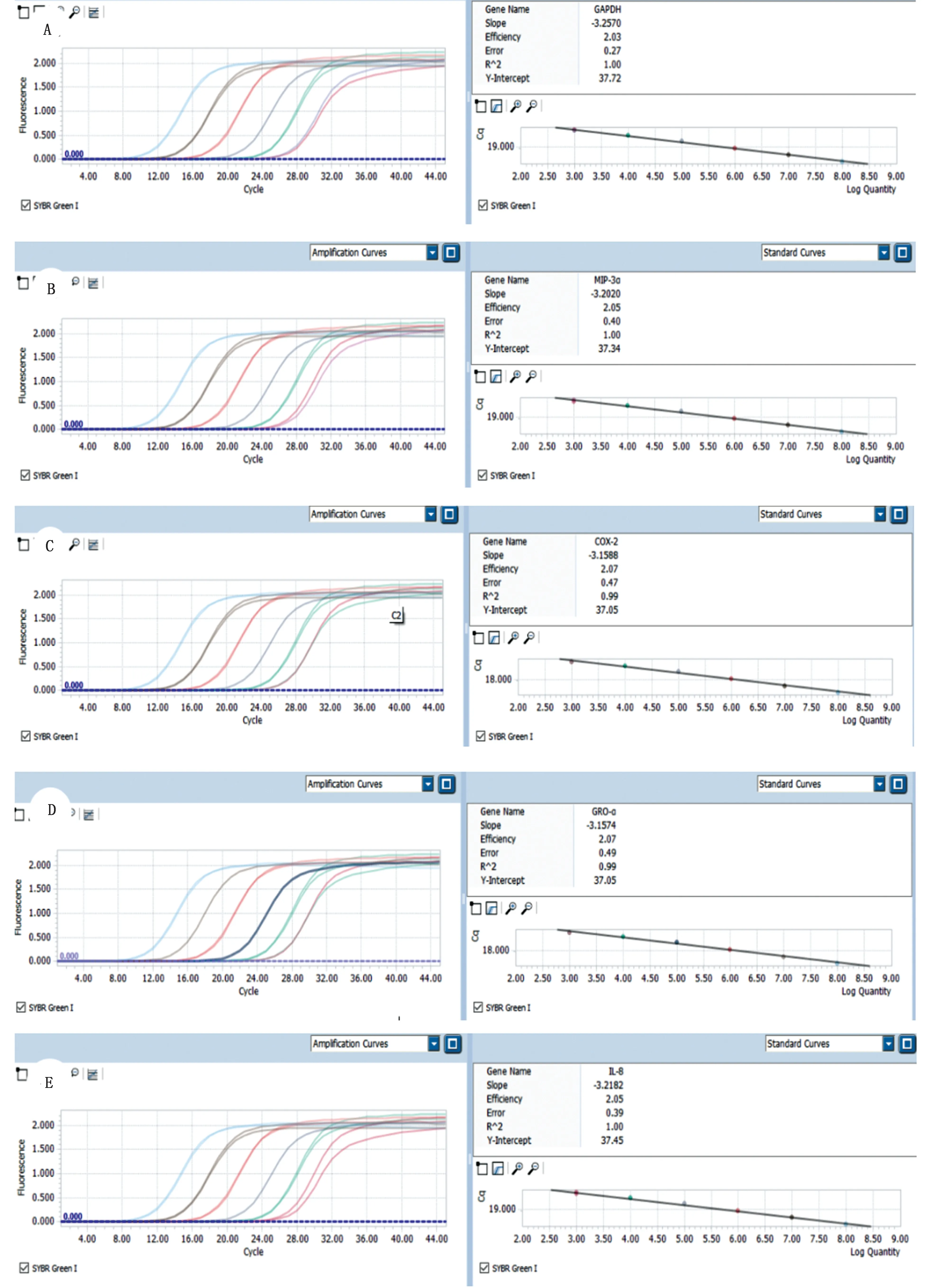
图4 炎症因子与内参基因PCR 扩增标准曲线 A.内参基因GAPDH;B.MIP-3α基因;C.COX-2基因;D.GRO-α基因;E.IL-8基因
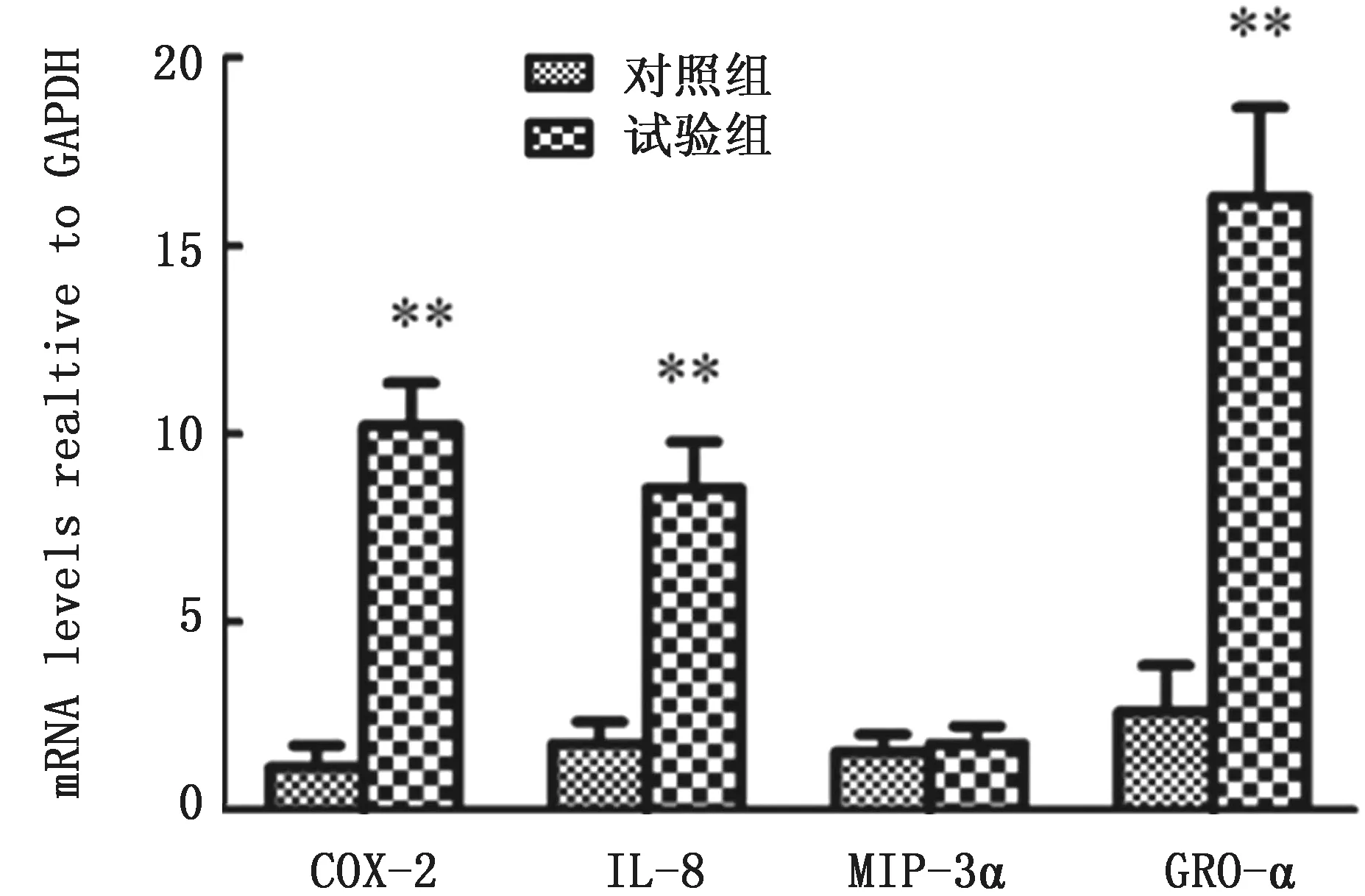
图5 BVDV 感染MDBK 细胞前后COX-2、IL-8、MIP-3α、GRO-α的m RNA 表达谱 与对照组相比,∗P <0.05;∗∗P<0.01。下同
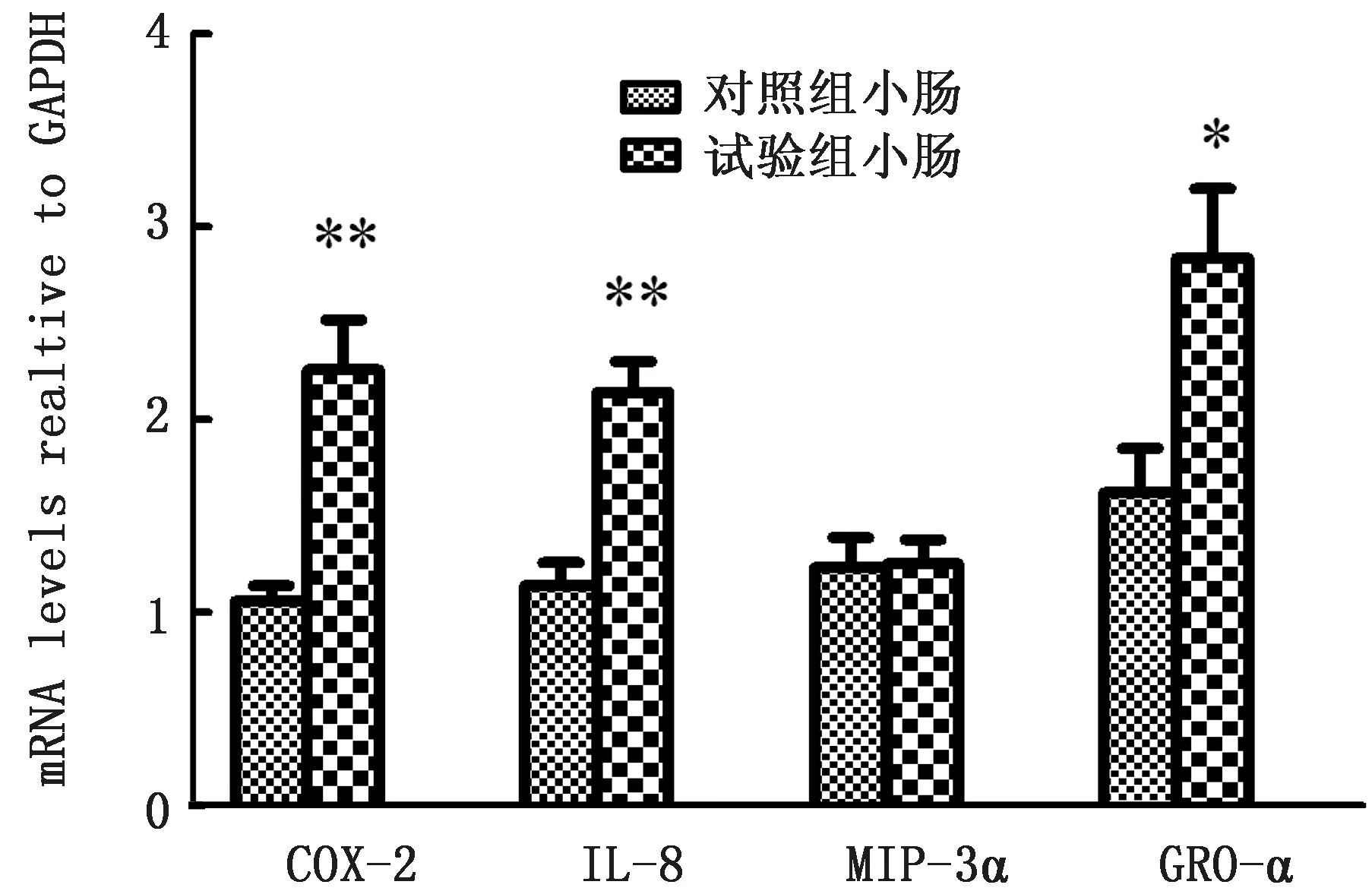
图6 BVDV 感染家兔小肠细胞前后COX-2、IL-8、MIP-3α、GRO-α的m RNA 表达谱
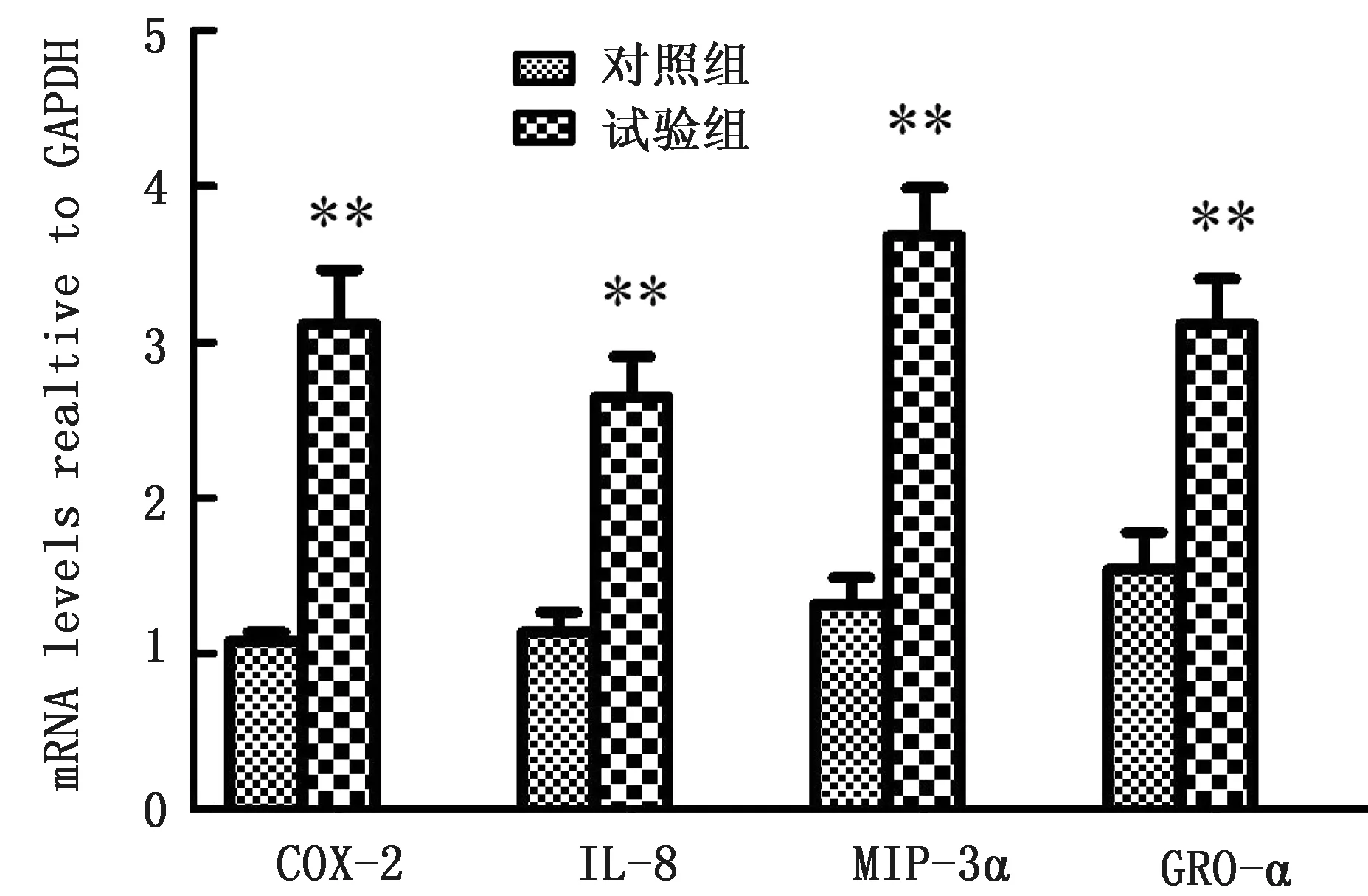
图7 BVDV 感染家兔脾细胞前后COX-2、IL-8、MIP-3α、GRO-α的mRNA 表 达谱
MIP-3α在BVDV 感染MDBK 前后并无显著性差异(P>0.05),而在感染后的家兔脾脏细胞中表达量有显著升高(P<0.01);这就说明BVDV 感染细胞并不会直接诱导MIP-3α的增加,可能是通过机体的免疫途径诱导产生。作为重要的新型免疫细胞之一,辅助性T 淋巴细胞17(Th17)所介导的炎症反应在纤维化发生发展过程中具有重要作用。在局部组织病灶募集Th17 的过程中,需要大量趋化因子。作为一类小分子质量趋化因子,巨噬细胞炎性蛋白3α(MIP-3α)能有效结合Th17 表面高表达的趋化因子受体6,并形成趋化轴,能有效招募Th17[9]。脾脏中有免疫细胞如巨噬细胞,在细胞受到病毒感染后激活免疫途径促使MIP-3α表达量增加。推测MIP-3α在脾脏抗BVDV 感染过程中发挥着重要的作用。
健康牛犊通过鼻腔感染BVDV 的试验证明,病毒集中存在的部位依次是肠细胞、淋巴结、胸腺、脾脏淋巴结、扁桃体和肝脏[15]。本试验通过分离BVDV 感染前后小肠细胞和脾细胞,检测发现家兔感染后小肠细胞和脾细胞中COX-2、IL-8、GRO-α m RNA 表达量显著高于未感染组(P<0.01或P<0.05),而只有脾细胞中MIP-3αm RNA 表达量显著高于未感染组(P<0.01)。从BVDV-1感染宿主细胞差异基因分析了解到,差异基因参与的分子功能主要有催化活性、结合活性、酶调节活性、分子转导活性和蛋白结合转录因子活性等,并且差异表达基因主要参与细胞自噬、细胞凋亡、免疫调节因子等相关的信号通路[16]。然而这些基因的表达到底是由哪种信号通路的哪种功能调节的,仍然值得去探索。
