对2019年北京高考化学试题第28题的评析和思考
2020-03-07温利权刘松伟陈瑞雪孙文利
温利权 刘松伟 陈瑞雪 孙文利


摘要: 重现对2019年北京高考化学试题第28题所述实验中气体制取与除杂、产物分离与鉴定、产物来源探析等实验探究全过程,通过实验说明SO2和AgNO3溶液反应过程中溶液酸碱性变化及其对产物的影响、不同洗涤试剂对沉淀量及其组分的影响,并从微观和定量的角度进行分析;对试题中隐含的实验问题进行探究;对SO2和AgNO3溶液反应过程中氧化还原反应和复分解反应的竞争关系进行简要的理论分析。
关键词: 2019年高考; 化学试题; 复分解反应; 氧化还原反应
文章编号: 10056629(2020)01009404
中图分类号: G633.8
文献标识码: B
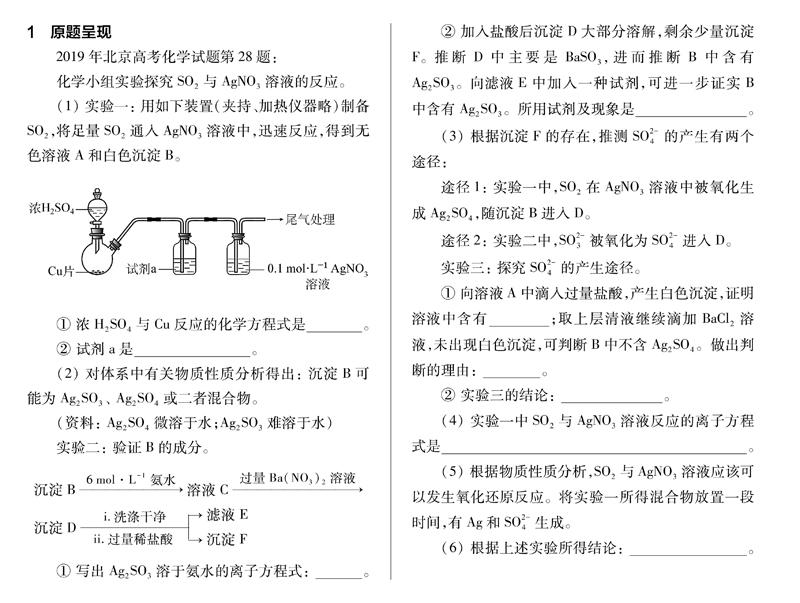
1 原题呈现
2019年北京高考化学试题第28题:
化学小组实验探究SO2与AgNO3溶液的反应。
(1) 实验一: 用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
① 浓H2SO4与Cu反应的化学方程式是 。
② 試剂a是____________。
(2) 对体系中有关物质性质分析得出: 沉淀B可能为Ag2SO3、 Ag2SO4或二者混合物。
(资料: Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二: 验证B的成分。
沉淀B6mol·L-1氨水溶液C过量Ba(NO3)2溶液
沉淀Di.洗涤干净 ii.过量稀盐酸 →滤液E
→沉淀F
① 写出Ag2SO3溶于氨水的离子方程式: 。
② 加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是 。
(3) 根据沉淀F的存在,推测SO2-4的产生有两个途径:
途径1: 实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2: 实验二中,SO2-3被氧化为SO2-4进入D。
实验三: 探究SO2-4的产生途径。
① 向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有______;取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由: ______。
② 实验三的结论: ______ 。
(4) 实验一中SO2与AgNO3溶液反应的离子方程式是 。
(5) 根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和SO2-4生成。
(6) 根据上述实验所得结论: 。
2 重现实验及相关问题分析
按照题目所述实验过程进行实验,所有现象均可明显重现,现就完成实验过程中的一些发现和认识进行分析讨论。
2.1 实验一的操作及实验一所得固体处理
取5g Cu片加入10mL浓硫酸,加热,产生的气体经饱和NaHSO3溶液洗涤,通入0.1mol·L-1 AgNO3溶液中,立刻产生白色沉淀,一段时间后分离,得白色沉淀和无色溶液。这一过程中测定0.1mol·L-1 AgNO3溶液pH≈5,反应后溶液pH=1.5(精密pH试纸测定),对照测定饱和SO2水溶液pH=1.8。由于反应体系通入SO2后,溶液pH主要受H2SO3影响,且SO2与AgNO3溶液反应后pH降低,因此初始AgNO3溶液的pH对反应无影响。题目没有给出溶液pH变化信息,也未在此设问,原因是SO2与AgNO3溶液无论发生复分解反应还是发生氧化还原反应,均会产生H+,即溶液pH降低只能说明二者发生了反应,但无法判断发生了哪类反应。
实验一所得白色沉淀是否在实验二中直接使用,中间处理过程试题未做说明。考虑到后续要检查沉淀中的SO2-3,而沉淀沾有或包裹有SO2溶液时会对检测造成干扰,所以应将沉淀洗净。实际操作: 取白色沉淀洗涤多次,直至用1mol·L-1 HCl检测洗涤液不再产生白色沉淀为止。
2.2 实验二的操作及洗涤试剂的选择
取洗净的白色沉淀加入6mol·L-1氨水,沉淀完全溶解,无黑色不溶物,说明没有Ag生成。继续向溶液中加入足量0.1mol·L-1 Ba(NO3)2溶液,产生白色沉淀,离心,用6mol·L-1氨水洗涤,直至用浓盐酸检测洗涤液不产生白色沉淀。取沉淀D加入1mol·L-1HCl,沉淀大部分溶解,过程中可见少量微小气泡,略有刺激性气味,说明沉淀中含有SO2-3。继续滴入未加H2SO4酸化的KMnO4溶液,溶液褪色且产生白色浑浊,进一步证明沉淀D中含有BaSO3,由此推断B中含有Ag2SO3,即SO2与AgNO3溶液发生了复分解反应: 2Ag++H2SO3Ag2SO3↓+2H+。
试题未指明沉淀D的洗涤试剂,实验中发现用水洗涤比用氨水洗涤后续所得沉淀F的相对量大,猜测水洗时F中含有Ag+。用Na2S溶液检验沉淀F,有黑色沉淀生成,猜测正确。进而可得,若用水洗涤沉淀D,则无法说明沉淀F为BaSO4。Ag+进入沉淀F中的可能过程: (1)溶解实验一所得白色沉淀时,为避免氨水过量生成不稳定的Ag3N[1],通常所加氨水量是使沉淀恰好溶解为止,此时Ag++2NH3·H2OAg(NH3)+2+2H2O恰好处于平衡点,加入Ba(NO3)2溶液后,对原溶液而言是稀释作用,上述平衡逆向移动,产生的Ag+与溶液中SO2-3又形成Ag2SO3进入D中。(2)用水洗涤沉淀D时,稀释了固体表面和沉淀包裹的银氨溶液,上述平衡逆向移动,Ag+与SO2-3形成Ag2SO3进入F中。实验发现: 用2mol·L-1氨水洗涤沉淀D时,在F中加入Na2S也会产生黑色Ag2S沉淀,而用6mol·L-1氨水洗涤沉淀D时,在F中加入Na2S不产生黑色Ag2S沉淀。试题不指明洗涤试剂,只指明洗涤干净,应该是发现了该问题,但由于不在实验探究主题之内而未作明示与设问。试题中溶解沉淀B的试剂为6mol·L-1氨水,浓度较大,洗涤沉淀B的试剂应该也是较浓的氨水,以防止Ag+进入F中。
2.3 实验三的操作及产生SO2-4原因的补充实验
取实验一中无色溶液,加入1mol·L-1 HCl至白色沉淀不再產生,既说明溶液中有Ag+,同时又确保Ag+不干扰后续测定。离心,取上层清液加入0.1mol·L-1 BaCl2溶液,无白色沉淀,说明在实验时间内SO2与AgNO3溶液未生成Ag2SO4沉淀。这一实验过程中的思维逻辑是: 若沉淀中有微溶物Ag2SO4,则溶液中必有SO2-4,加入BaCl2溶液后必有白色沉淀生成。从溶度积看,Ksp(Ag2SO4)=1.20×10-5, Ksp(BaSO4)=1.07×10-10,前者远大于后者,当用Ba2+检测不到SO2-4时,溶液中的SO2-4不会和Ag+产生沉淀。
试题未探讨实验二中产生SO2-4的原因。笔者认为溶液中的Ag(NH3)+2和溶解的O2均可作为氧化剂,若Ag(NH3)+2氧化SO2-3应生成Ag,实际实验中未见黑色Ag生成,可排除这种可能。为证明溶解的O2可将溶液中正四价硫氧化,补充实验如下: 向饱和SO2溶液中加入过量氨水,测定溶液pH>14,放置5min,用稀盐酸酸化后加入BaCl2溶液,有白色沉淀生成;同时作对照实验,将饱和SO2溶液也放置5min,加入稀盐酸和BaCl2溶液,无白色沉淀生成。补充实验说明SO2在碱性条件下易被氧化。此实验也间接说明了实验二中产生SO2-4的原因。
2.4 试题第(5)问实验操作
将过量SO2通入0.1mol·L-1AgNO3溶液中,然后将混合物密封放置24 h,观察到固体由白色变为灰色,继续放置10天,沉淀颜色灰色加深。离心,取上层清液,加入0.1mol·L-1 Ba(NO3)2溶液,立即产生大量白色沉淀,说明放置过程中有SO2-4生成。由于SO2-4可能是SO2-3被Ag+、 NO-3(H+)或溶解的O2等氧化得到,因此SO2-4的生成不能作为Ag+与H2SO3反应的直接证据,应进一步检测Ag的生成。
取灰色沉淀用6mol·L-1氨水洗涤干净,在剩余黑色固体中,加入浓硝酸,固体溶解,有红棕色气体。向反应后溶液中加入0.1mol·L-1 Ba(NO3)2溶液,无沉淀生成,排除黑色固体为Ag2S的可能;向反应后溶液中加入1mol·L-1 HCl溶液,有白色沉淀,证明剩余固体中含Ag。
从整体看,初始反应物为SO2和AgNO3,最终有Ag和SO2-4生成,总反应可写成2Ag++H2SO3+H2O2Ag↓+SO2-4+4H+。从放置产生Ag的过程看,氧化剂可能是Ag2SO3或溶液中的Ag+,还原剂可能是H2SO3、溶液中SO2-3或Ag2SO3中的SO2-3,如需确定过程中的反应,还需进一步探究。
3 对实验结论的理论分析
3.1 热力学分析
查阅兰氏手册[2]: Ksp(Ag2SO3)=1.49×10-14, Ksp(Ag2SO4)=1.20×10-5
SO2-4+4H++2e-H2SO3+H2Oφθ(SO2-4/H2SO3)=0.172V
Ag++e-Ag φθ(Ag+/Ag)=0.7996V
291K时[3],
SO2+xH2OSO2·xH2OH++HSO-3+(x-1)H2O K1=1.54×10-2
HSO-3H++SO2-3 K2=1.02×10-7
当SO2与AgNO3溶液发生复分解反应时:
2Ag++H2SO3Ag2SO3+2H+ K=K1K2Ksp=1.05×105 (1)
当SO2与AgNO3溶液发生氧化还原反应时:
2Ag++H2SO3+H2O2Ag+SO2-4+4H+
lgK=2×[φθ(Ag+/Ag)-φθ(SO2-4/H2SO3)]0.0592=21.2 K=1021.2=1.59×1021 (2)
(2)的平衡常数远远大于(1),即发生氧化还原反应的趋势远大于发生复分解反应,反应更趋向于生成Ag和SO2-4。但能否发生热力学趋势较大的反应,还需要看动力学因素。
3.2 动力学分析
溶液中发生复分解反应时活化能很小,发生氧化还原反应时活化能较高,酸、碱、盐之间既能发生复分解反应又能发生氧化还原反应时,先发生复分解反应。本题涉及实验中,优先发生复分解反应,溶液中c(Ag+)、 c(SO2-3)迅速降低,Ag+的氧化性与SO2-3的还原性减弱,氧化还原反应较难发生,我们所熟知的Ag+和I-的反应也是这种情况。
3.3 当生成Ag2SO3时,Ag+与SO2-3能否发生氧化还原的热力学分析
查阅数据: 291K时,SO2在水中溶解度为12.14g[4]。此时溶液中c(H2SO3)=1.90mol·L-1(将SO2·H2O写作H2SO3)
当溶液中SO2足量,且生成Ag2SO3时,测定溶液pH=1.5,即c(H+)=0.032mol·L-1
∵ K1·K2=[H+]2[SO2-3][H2SO3]≈0.0322×[SO2-3]1.90
∴ [SO2-3]=2.91×10-6mol·L-1
∵ [Ag+]2[SO2-3]=Ksp(Ag2SO3)=1.49×10-14 ∴ [Ag+]=7.16×10-5mol·L-1
此时φ(Ag+/Ag)=φθ(Ag+/Ag)+0.0592lg[Ag+]=0.554V
φ(Ag+/Ag)=0.554V仍大于φθ(SO2-4/H2SO3)=0.172V,发生氧化还原反应趋势仍然很大。相关文献[5]也显示Ag2SO3可分解生成Ag2SO4和SO2,即: 2Ag2SO32Ag+2Ag++SO2-4+SO2。
综上,理论上SO2与AgNO3溶液发生氧化还原反应的趋势大于发生复分解反應的趋势,但SO2与AgNO3溶液发生复分解反应的速率大于发生氧化还原反应的速率,复分解反应发生后,正一价的Ag+仍可氧化SO2-3。理论分析与实验结果相吻合。
4 实验后的反思
4.1 对SO2与AgNO3溶液反应的再认识
2019年北京高考化学试题第28题解决了中学化学教学一直悬而未决的一个问题。徐泓[6]等老师在“由2013年北京理综卷第28(3)题引发的探究和思考”一文中已探讨过SO2与AgNO3溶液反应这个问题,但未引起足够重视。文中所述“部分高中化学教师认为SO2与酸化的AgNO3溶液反应时,SO2会被氧化,生成Ag2SO4沉淀;还有一部分教师对“SO2与酸化的AgNO3溶液是否能生成白色沉淀”产生质疑;没有一名受访教师认为生成的沉淀可能是Ag2SO3”,这种认识现在仍广泛存在。即使有少数教师认为沉淀是Ag2SO3,也不能确定是否含有Ag2SO4。试题的探究对该问题给出了确定的答案。
2Ag++H2SO3Ag2SO3↓+2H+的反应中弱酸生成了强酸,与“强酸制弱酸”的一般认知不符,原因是有溶解度小的Ag2SO3生成,即饱和SO2溶液中电离出的少量SO2-3遇Ag+即可生成Ag2SO3沉淀,使反应发生。试题提示对复分解反应的原理要深度思考,生成沉淀、气体或弱电解质的复分解反应的微观本质是使溶液中的离子浓度发生变化。
试题进一步指出SO2与AgNO3溶液长时间放置可发生氧化还原反应,提示我们分析化学反应时要同时考虑热力学因素与动力学因素,即高中化学所学的反应限度与反应速率对反应的影响。
4.2 关于实验的讨论
试题由于篇幅所限,很多实验问题虽有涉及,但未进行深入探讨或设问。例如溶解白色沉淀B为什么没有选择常用的盐酸、硫酸或硝酸,而是选择氨水?洗涤沉淀D时选择的洗涤剂到底是什么?水洗和氨水洗涤有什么区别?实验二中氧化SO2-3的氧化剂是什么?实验一和实验二对比,为什么SO2-3在实验二中更容易被氧化?在通入过量SO2情况下,为何溶液A还能检测到Ag+?这些实验所带来的问题值得我们进一步探讨。
4.3 试题呈现形式带来的思考
28题的呈现方式与前几年略有不同。首先,试题直接给出产物可能性并进行探究,这与常规的分析、假设、实验的探究环节不同,学生应自行分析SO2和AgNO3溶液反应体系的微粒成分,补充认识可能产生Ag2SO3或Ag2SO4的原因。其次,实验二探究过程不是在提出假设的基础上进行逐项排除问题,而是进行总体实验设计,同时检验沉淀中可能含有的成分,这种总体设计的分离和检验方法具有更高的可信性和更高的说服力,尤其是结合实验三证明没有产生Ag2SO4。最后第(6)问归纳实验结论并引导考生进行一定程度的理性分析,具有开放性,考查了对实验探究过程的理解。上述试题的变化对考生逻辑分析能力和实验设计的理解能力提出了更高要求。
5 试题对于教学和复习的提示
试题考查考生熟知的SO2等核心元素化合物的性质、常见气体制备和除杂、离子检验等基础知识,引导高三复习和教学重视基础知识、基本技能与基本方法;试题考查到银氨溶液的反应原理与应用、体系中干扰因素的判断与排除、时间对反应的影响等,引导高三复习和教学注重知识的应用;试题隐含实验过程中不同pH对反应的影响、溶剂的选择等问题,提示高三复习和教学应注重知识的延伸与拓展。
试题展示了完整的实验探究过程,注重反应原理与化学实验融合的特色,提示高三复习应关注化学原理引导下的探究活动,尤其是探究前的预测与分析。试题展示了真实问题的复杂性,揭示了物质微粒种类与性质的关联,以及多个反应间存在的竞争关系,提示高三教学要提升对复杂体系的认识,关注反应中的主次矛盾以及相互转化。试题沿实验探究过程的时间线和逻辑线展开,在探究过程中深入考查分析问题、解决问题的逻辑思维能力和实验能力,提示高三复习应关注证据意识和探究精神等学科核心素养,贯彻落实新课标精神。
参考文献:
[1][5]张青莲主编. 无机化学丛书(第六卷)[M]. 北京: 科学出版社, 1995: 438,501
[2][4]Dean J.A. 兰氏化学手册(第一版)[M]. 北京: 科学出版社, 1991: 5~9.
[3]北京师范大学. 无机化学(第四版)[M]. 北京: 高等教育出版社, 2009: 501.
[6]徐泓, 沈艳等. 由2013年北京理综卷第28(3)题引发的探究和思考[J]. 化学教学, 2014, (7): 93~96.
