浓硫酸与铜反应实验的改进
2020-03-07张红卫
张红卫
摘要: 浓硫酸与铜反应的实验是体现浓硫酸具有强氧化性的重要实验。针对现行三套教材中该实验和文献中若干改进实验存在的不足提出新的改进方案。用Y型管做反应容器;用针筒注水、双联打气球打气来排尽装置内残存的SO2,并用双球漏斗内碱液吸收。新的改进实验集成度高、操作简便、现象明显、绿色环保。
关键词: 浓硫酸与铜反应; Y型管; 双联打气球; 双球漏斗; 实验装置改进
文章编号: 10056629(2020)01006703
中图分类号: G633.8
文献标识码: B
1教材中的实验概述
浓硫酸与铜反应的实验是体现浓硫酸具有强氧化性的重要实验。我国现有3个版本的高中化学教材编排了该实验,并进行了不同的设计。
1.1人教版教材
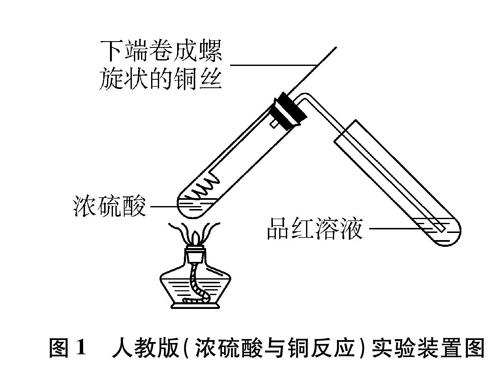
人教版
教材实验装置如图1(夹持装置已略去,下同)所示[1]。该实验方案操作简便、现象明显,但存在的不足之处是: 实验装置的气密性和抽拉铜丝的灵活性不易兼顾,在多次使用后尤甚;缺少尾气处理装置,SO2外逸明显;检验产物CuSO4时,需拔掉橡皮塞,残存在装置内的SO2直接扩散到空气中。
1.2上科版教材
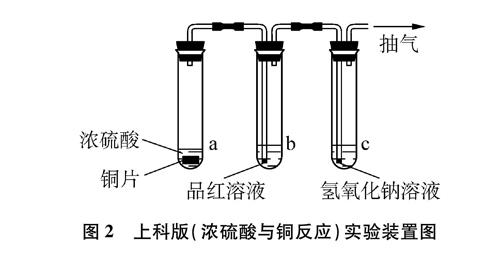
上科版
教材实验装置如图2所示[2]。该实验方案虽有相同优点,
但在实际操作中也有不足: 一般学校无抽气设备,导致该方案难推广;橡皮管的存在,导致装置无法抽真空;检验产物CuSO4时,也需拔掉橡皮塞,残存在装置内的SO2直接扩散到空气中。
1.3苏教版教材
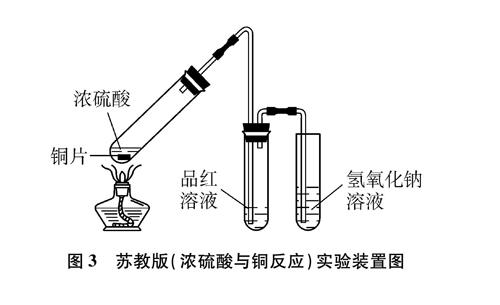
苏教版
教材实验装置如图3所示[3]。该实验方案虽然操作简便、现象明显,但在实际操作中,为防止倒吸,停止加热前需打开双孔橡皮塞,此时浓硫酸与铜还在反应,SO2大量外逸;反应后溶液蓝色很淡,稍冷却即转为无色,不利于CuSO4的判断。
2文献中的实验概述
查阅各种教学期刊,关于“浓硫酸与铜反应”的论文主要有三类。
第一类为研究实验现象。李颖、刘怀乐[4]通过实验证明,铜片变黑,是由于不同条件下的先后反应和若干的平行反应,生成了CuS、 Cu2S、 Cu2O、 Cu2SO4和S等一系列物质的混合物。夏立先[5]通过实验证明,浓硫酸和铜反应后溶液呈绿色,是由于铜片表面未清洗,含有氯元素。
第二类为控制实验条件。王继璋[6]通过实验证明,先把浓硫酸加热到260℃,再加入铜片反应,可减少黑色物质生成。宋志贵[7]通过实验证明,使用市售浓硫酸和水的体积比在2.5∶1~3∶1时,实验效果较好。
第三类为改进实验装置。这类研究主要围绕以下四点: 倒吸可防、反应可控、污染可除、操作可行。如陈海涛[8]设计如图4的实验装置。实验时,在试管外用
磁铁吸引试管内的封铁玻璃管,带动螺旋状铜丝沿着试管内壁上下滑动,控制反应进程。结束时,用气球打气筒向受热试管内打气,以驱除残存SO2、加快试管冷却、防止品红溶液倒吸。但制作封铁玻璃管较繁琐、实验操作较复杂,且连接气球打气筒的玻璃导管未接近浓硫酸,受热试管内的SO2不易排尽。
综上所述,针对教材和文献中实验的不足之处,笔者对该实验进行了新的改进。
3新改進的实验
3.1实验用品
器材: 铁架台(带铁夹)、酒精灯、火柴、Y型管、双孔橡皮塞、安全漏斗(环颈双球)、直角导管、橡皮管、单向阀、滤纸条、滴管(带刻度)、双联打气球、针筒等
药品: 市售浓硫酸、网线铜丝、水、品红溶液、饱和NaOH溶液
3.2实验装置
新改进的实验装置如图5所示。
3.3实验操作、现象及结论
(1) 按图5所示搭建实验装置,在保证装置气密性的基础上加注药品。
① 在Y型管左侧依次加入网线铜丝(长度约4cm)、浓硫酸(体积约1.5mL);在右侧加水(体积约2mL)。
② 把滤纸条(大小与市售pH试纸相当)粘附在直角导管的外壁,并用品红溶液润湿;向双球漏斗中注入饱和氢氧化钠溶液(体积约1.5mL)。塞好双孔橡皮塞后固定Y型管。
(2) 加热。铜丝变黑、产生气泡、管中充满白雾。反应约半分钟后停止加热,铜丝消失,管底出现灰白色不溶物,溶液呈淡蓝色,滤纸条褪色(证明有SO2生成)。
(3) 冷却后,反应液呈无色。取下Y型管并旋转,使一侧反应液慢慢倾入另一侧水中,并混合均匀,得稳定、鲜明的蓝色溶液(证明有硫酸铜生成)。
(4) 课后,先用针筒从单向阀注水至接近直角导管底部,再换用双联打气球打气,排尽装置中残存SO2至双球漏斗中的
NaOH吸收。
3.4实验疑问解释
(1) 处理尾气时,为何采用环颈双球漏斗盛放饱和NaOH溶液,而不采用更常见的漏斗或长颈漏斗盛放蘸有NaOH溶液的棉球?
① 采用环颈双球漏斗,便于盛放吸收液且能达到图2中的吸收效果。若采用漏斗或长颈漏斗盛放蘸有NaOH溶液的棉球,不仅吸收效率低,而且NaOH溶液的量不易控制,太少,SO2的吸收效果不好;太多,溶液会流入Y型管中影响实验。
② 采用饱和NaOH溶液,利用其浓度大能加快吸收速率,且其呈油状,黏稠度高,使SO2不易逸出,有利于提高吸收效率。
但要注意,所加溶液不能过多,以不进入双球漏斗球部为宜,防止冷却时发生倒吸。
(2) 为何采用细铜丝让其耗尽,而不采用反应进程可控的铜片或粗铜丝?
① 从实验目的角度,
让铜丝消失,有利于简化实验装置、分析反应本质、达到实验目的。如果铜有剩余,则需要花费较多时间解释其表面黑色现象,不仅冲淡实验教学主题,而且对于高一学生或基础一般的学生,还很难得出正确结论。
当然,在实验过程中,也同样会观察到铜丝表面变黑的现象,只是最终会全部转化进入溶液。对学有余力、学有能力的学生可开设微课进行相关研究[9]。
② 从二次使用角度,
反应之后,剩余粗铜丝(或铜片)的表面已发黑,还需经过拉直、打磨,再卷成螺旋状才能二次使用,没有比用一次性耗尽的细铜丝更方便。
③ 从试剂用量角度,
本实验控制反应进程的目的是防止浪费药品。而改进实验中铜和浓硫酸的用量都很少,故没有必要设置控制反应进程的措施。否则,会让实验复杂化。
所以,把铜丝完全耗尽,把接触控制转化为用量控制,更有利于操作和教学。
(3) 要观察CuSO4溶液的蓝色,为什么需把反应液倒入水中?
根据苏教版教材[10]实验: 向胆矾晶体中加入少许浓硫酸并搅拌,观察到胆矾由蓝色变成灰白色,可见常温下浓硫酸的吸水性强于CuSO4。根据文献[11, 12]得知: 反应完毕,硫酸浓度依然较高,冷却后不利于CuSO4形成水溶液,也就不利于观察到蓝色。为了让实际现象与理论描述保持一致,须加入适量的水,使形成CuSO4的稀硫酸溶液。
4改进实验的优点
(1) 集成度高。将反应发生、产物检验、尾气处理等装置进行集成,有利于课堂演示时进行巡展。
(2) 操作简便、现象明显。只需旋转Y型管,就能观察到稳定、鲜明的蓝色溶液。
(3) 绿色环保。用针筒注水、双联打气球打气,可排尽体系中残存SO2。用盛放少许碱液的双球漏斗,既消除倒吸隐患,又解决SO2污染问题。
参考文献:
[1]宋心琦. 普通高中课程标准实驗教科书·化学1(必修)[M]. 北京: 人民教育出版社, 2007: 101.
[2]姚子鹏. 高级中学课本《化学》高中一年级第二学期(试用本)[M]. 上海: 上海科学技术出版社, 2007: 15.
[3][10]王祖浩主编. 普通高中课程标准实验教科书·化学1(必修)[M]. 南京: 江苏教育出版社, 2009: 91~92.
[4]李颖、 刘怀乐. 对铜和浓硫酸共热反应实验变黑现象的再认识[J]. 化学教育, 2007, (11): 51~52, 54.
[5]夏立先. 对铜与浓硫酸反应溶液呈绿色的实验探究[J]. 化学教学, 2015, (7): 64~65.
[6]王继璋. 温度对铜和浓硫酸反应的影响探究[J]. 化学教育, 2013, (9): 64~68.
[7]宋志贵. 对铜和浓硫酸反应的再认识[J]. 中学化学教学参考, 2011, (10): 64.
[8]陈海涛. 铜与浓硫酸反应实验方案的新设计[J]. 化学教学, 2015, (10): 65~68.
[9][11]江合佩. 基于提升学生实验科学素养的“翻转课堂”教学研究——以“探究铜与浓硫酸反应的异常现象”为例[J]. 化学教与学, 2016, (2): 11~15.
[12]吕绪河等. 浓硫酸与铜反应实验的再改进[J]. 化学教学, 2014, (7): 64~66.
