肉牛呼吸道感染主要细菌性病原多重PCR检测方法的建立
2020-03-07张玉龙马志宇崔耀成谭天宇姚彩霞樊利虹左之才才冬杰
张玉龙,马志宇,崔耀成,谭天宇,姚彩霞,樊利虹,左之才,才冬杰
(四川农业大学 动物医学院 动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
由于长距离运输或早期断奶等应激造成肉牛机体免疫力下降,一些寄生于肉牛鼻、咽和气管的正常菌群可能下行至支气管和肺脏中,并在其内定植,激发潜在的病毒感染并造成机体上呼吸道黏膜损伤,从而引起继发性细菌感染,严重影响肉牛产业的健康发展[1-3]。多杀性巴氏杆菌(Pasteurellamultocida)、溶血性曼氏杆菌(Hemolyticbacterium)、肺炎克雷伯菌(Klebsiellapneumoniae)、不动杆菌(Acinetobacter)等是引起牛呼吸道疾病(bovine respiratory disease,BRD)的细菌性病原菌[4]。本实验室从肉牛呼吸道中多次分离到多杀性巴氏杆菌、肺炎克雷伯菌和不动杆菌,其中不动杆菌属中约翰逊不动杆菌(Acinetobacterjohnsonii)检出频数最高。
临床常用的传统细菌学检验方法需经过细菌培养、染色镜检、生化鉴定等步骤,过程繁琐,费时费力,难以满足临床试验的需要[5]。PCR检测方法耗时短,可信度高,可用作病原菌检测,主要包括巢式PCR、荧光定量PCR、多重PCR[6]。多重PCR主要用于多种病原微生物的同时检测或某些病原微生物鉴定、某些遗传病及癌基因的分型鉴定,其操作简单,成本低,可快速鉴定细菌[7],为病原菌的检测和鉴定提供了准确、可靠的方法[8-10]。本研究建立了一种同时检测肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌这3种肉牛呼吸道病原菌的多重PCR方法,旨在为快速检测牛呼吸道疾病病原菌提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株
肺炎克雷伯菌(Klebsiellapneumoniae,BNCC102997)、约翰逊不动杆菌(Acinetobacterjohnsonii,BNCC341940)、多杀性巴氏杆菌(Pasteurellamultocida,ATCC15742)购自北京北纳创联生物技术研究院;柯氏柠檬酸杆菌(Citrobacter,1Y-2)、铜绿假单胞菌(Pseudomonasaeruginosa,3D-5)、深红沙雷氏菌(Serratiamarcescens,1B-4)、鲍曼不动杆菌(Acinetobacter baumannii,SF5B-5)、皮特不动杆菌(Acinetobacterpittii,SF1-JM-1)、变形杆菌(Proteusbacillusvulgaris,3B-5)、大肠埃希菌(Escherichiacoli,13-1)、志贺氏菌(Shigella,13-2)、奈瑟菌(Neisseria,9-1-2)、摩根菌(Morganella,464P-1)均由本实验室分离保存。
1.1.2 主要试剂与仪器
大豆酪蛋白琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)、脑心浸出液肉汤(HBI)、血琼脂基础、麦康凯琼脂培养基均购自成都浩博优有限公司;DNA Marker、2×TaqPCR Master Mix、双蒸水、50 bp DNA Ladder、Goldview、琼脂糖均购于成都擎科伟业生物技术有限公司。PCR仪购自Thermo Fisher公司,电泳仪购自北京六一生物科技有限公司,全自动凝胶成像系统购自Bio-Rad公司。
1.2 引物设计
根据文献[11]和Genbank数据库中肺炎克雷伯菌Khe基因、约翰逊不动杆菌Ptk基因、多杀性巴氏杆菌Abhd基因,利用Primer 5.0和Oligo 6.0软件设计3对特异性引物(表1),引物由成都擎科伟业生物技术有限公司合成。
1.3 DNA提取
取1 mL扩增培养24 h的菌液,按照Ezup柱式基因组DNA抽提试剂盒(细菌)说明书步骤提取细菌基因组DNA,用NanoDropTMOne超微量紫外分光光度计检测病原菌基因组DNA浓度。
1.4 单重PCR扩增
以病原菌基因组DNA作为模板,采用10 μL体系进行PCR扩增,并进行单重PCR的特异性、退火温度、敏感度验证。PCR反应体系为:2×TaqPCR Master Mix 5 μL,ddH2O 3 μL,引物各0.5 μL,模板1 μL。以3%琼脂凝胶电泳检测基因组DNA。

表1 引物信息Table 1 The information of primers
1.5 多重PCR退火温度与引物浓度优化
将肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌的基因组DNA等量混匀作为模板,优化退火温度(57~62 ℃),引物的量(0.8~3.0 μmoL·L-1),确保各病原菌扩增效率保持一致。以目的条带明显、引物二聚体少、无非特异性扩增条带为标准,确定多重PCR的最佳反应体系和反应条件。
1.6 多重PCR检测的特异性试验
以本实验室分离的病原菌扩增培养液作为模板,利用优化的多重PCR最佳反应体系与反应条件进行扩增,评价多重PCR的特异性试验。
1.7 多重PCR检测的敏感性试验
将病原菌基因组DNA进行10-1、10-2、10-3、10-4、10-5、10-6这6个梯度稀释,以稀释液作为模板进行多重PCR敏感性与单重PCR敏感度比较,评价多重PCR的灵敏度。
1.8 临床样品的检测
用建立的多重PCR检测法和传统细菌学检测法,对采集的35份具有不同程度呼吸症状的肉牛鼻腔拭子样品进行检测,并对比2种方法的检出率。同时,用多重PCR对样品进行重复检测,检测多重PCR的可重复性。
2 结果与分析
2.1 单重PCR扩增结果
通过全功能成像仪观察凝胶电泳结果,3对特异性引物都能够扩增出相应的条带并且目的条带大小与预期的相符,多杀性巴氏杆菌目的条带大小是462 bp(图1),肺炎克雷伯菌是226 bp(图2),约翰逊不动杆菌是365 bp(图3)。
以病原菌基因组DNA的10-1、10-2、10-3、10-4、10-5、10-6梯度稀释液作为模板进行单重PCR检测。结果显示,单重PCR检测肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌的检测下限分别为69.8×10-5、208.9×10-6、70.8 ×10-3ng·μL-1。将退火温度设定为57、58、59、60、61、62 ℃,进行单重PCR的退火温度试验。结果表明,肺炎克雷伯菌的最佳的退火温度是58 ℃,约翰逊不动杆菌的最佳退火温度是59 ℃,多杀性巴氏杆菌的最佳退火温度是61 ℃(图4)。

M,50 bp DNA Ladder Marker;1,多杀性巴氏杆菌;2,肺炎克雷伯菌;3,溶血性曼氏杆菌;4,约翰逊不动杆菌;5,铜绿假单胞菌;6,阴性对照。M, 50 bp DNA Ladder Marker; 1, Pasteurella multocida; 2, Klebsiella pneumonia; 3, Hemolytic bacterium; 4, Acinetobacter johnsonii; 5, Pseudomonas aeruginosa; 6, Negative control.图1 多杀性巴氏杆菌特异性扩增结果Fig.1 Specific amplification results of Pasteurella multocida

M,50 bp DNA Ladder Marker;1,肺炎克雷伯菌;2,多杀性巴氏杆菌; 3,溶血性曼氏杆菌;4,约翰逊不动杆菌;5,铜绿假单胞菌;6,阴性对照。M, 50 bp DNA Ladder Marker; 1, Klebsiella pneumonia; 2, Pasteurella multocida; 3, Hemolytic bacterium; 4, Acinetobacter johnsonii; 5, Pseudomonas aeruginosa; 6, Negative control.图2 肺炎克雷伯菌特异性扩增结果Fig.2 Specific amplification results of Klebsiella pneumoniae

M,50 bp DNA Ladder Marker;1,约翰逊不动杆菌;2,多杀性巴氏杆菌;3,肺炎克雷伯菌;4,溶血性曼氏杆菌;5,铜绿假单胞菌;6,阴性对照。M, 50 bp DNA Ladder Marker; 1, Acinetobacter johnsonii; 2, Pasteurella multocida; 3, Klebsiella pneumonia; 4, Hemolytic bacterium; 5, Pseudomonas aeruginosa; 6, Negative control.图3 约翰逊不动杆菌特异性扩增结果Fig.3 Specific amplification results of Acinetobacter johnsonii
2.2 多重PCR反应体系与反应条件优化
通过多重PCR引物的量(0.8~3.0 μL)与退火温度(57~62 ℃)的优化,以不产生非特异性条带,目的条带扩增效率高,减少产生引物二聚体为目的,最终获得多重PCR的最佳反应体系为50 μL,其中肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌引物各1 μL,模板各2 μL,酶25 μL,水13 μL。最佳反应条件为:95 ℃ 5 min;95 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。
2.2.1 引物浓度优化结果
调整约翰逊不动杆菌、肺炎克雷伯菌、多杀性巴氏杆菌的引物比例,优化多重PCR引物浓度。当约翰逊不动杆菌、肺炎克雷伯菌、多杀性巴氏杆菌的引物比例为1∶1∶1时不产生非特异性条带,目的条带扩增效率高。
2.2.2 多重PCR退火温度试验
以肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌的病原菌基因组DNA等量混合作模板,将退火温度设定为57、58、59、60、61、62 ℃,以梯度温度作为退火温度进行多重PCR的退火温度试验。结果表明,多重PCR的退火温度为58 ℃时,扩增效果最好(图5)。
2.3 多重PCR检测的特异性试验结果
利用建立的多重PCR方法对本实验室分离的病原菌扩增培养液进行检测。以肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌扩增培养液等量混匀作为模板,50 μL体系中,3对特异性引物只扩增出对应的目的条带(图6)。
如图7所示,肺炎克雷伯菌在226 bp,约翰逊不动杆菌在365 bp,多杀性巴氏杆菌在462 bp处出现特异性条带,而其他10种牛呼吸道病原菌未出现特异性条带,3次重复试验得到相同的结果,表明该方法有良好的特异性和重复性。
2.4 多重PCR检测的敏感性试验结果
将3种病原菌基因组DNA的10-1、10-2、10-3、10-4、10-5、10-6这6种稀释液分别等量混合制作模板,利用建立的多重PCR方法进行灵敏度验证。该方法对3种肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌基因组DNA的检测下限分别为69.8×10-5、208.9×10-4、70.8×10-3ng·μL-1,肺炎克雷伯菌与多杀性巴氏杆菌的灵敏度略低于与单重PCR,多杀性巴氏杆菌的灵敏度与单重PCR灵敏度一致(图8)。
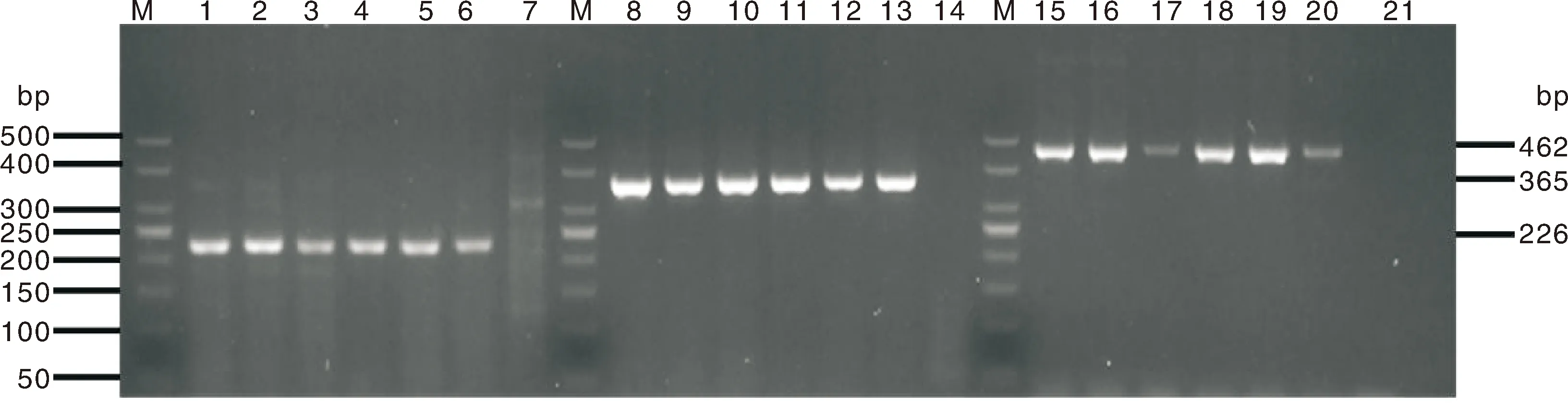
M,50 bp DNA Ladder Marker;1~6,57~62 ℃,8~13,57~62 ℃,15~20,57~62 ℃,7、14、21,阴性对照。M, 50 bp DNA Ladder Marker; 1-6,57~62 ℃; 8-13, 57~62 ℃; 15-20, 57~62 ℃; 7, 14, 21, Negetive control。图4 肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌退火温度扩增结果Fig.4 Annealing temperature amplification results of Klebsiella pneumoniae, Acinetobacter johnsonii and Pasteurella multocida

M,50 bp DNA Ladder Marker;1~6,57~62 ℃;7,阴性对照。M, 50 bp DNA Ladder Marker; 1-6,57~62 ℃; 7, Negetive control。图5 多重PCR退火温度优化结果Fig.5 Optimization results of multiplex annealing temperature

M,50 bp DNA Ladder Marker;1,肺炎克雷伯菌;2,约翰逊不动杆菌;3,多杀性巴氏杆菌;4~6,阴性对照。M, 50 bp DNA Ladder Marker; 1, Klebsiella pneumonia; 2, Acinetobacter johnsonii; 3, Pasteurella multocida;4-6, Negative control.图6 多重PCR特异性扩增结果Fig.6 The primer specificity of multiplex PCR

M,50 bp DNA Ladder Marker;1,阳性对照;2,肺炎克雷伯菌;3,约翰逊不动杆菌;4,多杀性巴氏杆菌;5,志贺氏菌;6,奈瑟菌;7,深红沙雷氏菌;8,鲍曼不动杆菌;9,皮特不动杆菌;10,摩根菌;11,变形杆菌;12,大肠埃希菌;13,柯氏柠檬酸杆菌;14,铜绿假单胞菌;15,阴性对照。M, 50 bp DNA Ladder Marker; 1, Positive control; 2, Klebsiella pneumonia; 3, Acinetobacter johnsonii; 4, Pasteurella multocida;5, Shigella; 6, Neisseria; 7, Serratia marcescens; 8, Acinetobacter baumannii; 9, Acinetobacter pittii; 10, Morganella; 11, Proteus; 12, Escherichia coli; 13, Citrobacter; 14, Pseudomonas aeruginosa; 15, Negative control.图7 13种病原菌的多重PCR特异性扩增结果Fig.7 Multiplex PCR analysis of thirteen kinds of pathogens
2.5 临床样品的检测
利用建立的多重PCR方法检测35份临床样品。如图9所示,共10条泳道呈阳性结果,其中约翰逊不动杆菌4份,多杀性巴氏杆菌3份,肺炎克雷伯菌4份。35份临床样品种,1个样品同时检测出约翰逊不动杆菌和多杀性巴氏杆菌这2种病原菌,证明牛呼吸道疾病存在混合感染。同时,对PCR扩增的阳性样品进行测序,经NCBI序列比对相似性均高于99%,表明多重PCR检测方法能够对临床样品进行准确检测。用多重PCR对样品进行重复检测,检测的结果一致,能够实现多重PCR检测的可重复性。
2.6 多重PCR与细胞学检验的符合率
通过多重PCR与细胞学检验对35份临床样品进行检测,并用卡方检验对不同感染类型进行分析。如表2所示,多重PCR检测法检出致病菌11株,致病菌检出率为31.4%;传统细菌学培养法检出致病菌7株,检出率为20.0%。通过卡方检验比较2种方法的检出率结果,表明多重PCR检测方法具有临床样品检测的应用能力。

M,50 bp DNA Ladder Marker;1,阳性对照;2,10-1 ng·μL-1;3,10-2 ng·μL-1;4,10-3 ng·μL-1;5,10-4 ng·μL-1;6,10-5 ng·μL-1;7,10-6 ng·μL-1;8,10-7 ng·μL-1;9,阴性对照。M, 50 bp DNA Ladder Marker; 1, Positive control; 2, 10-1 ng·μL-1; 3, 10-2 ng·μL-1; 4, 10-3 ng·μL-1; 5, 10-4 ng·μL-1; 6, 10-5 ng·μL-1; 7, 10-6 ng·μL-1; 8, 10-7 ng·μL-1; 9, Negative control.图8 多重PCR敏感性扩增结果Fig.8 The sensitivity of amplification results of multiplex PCR
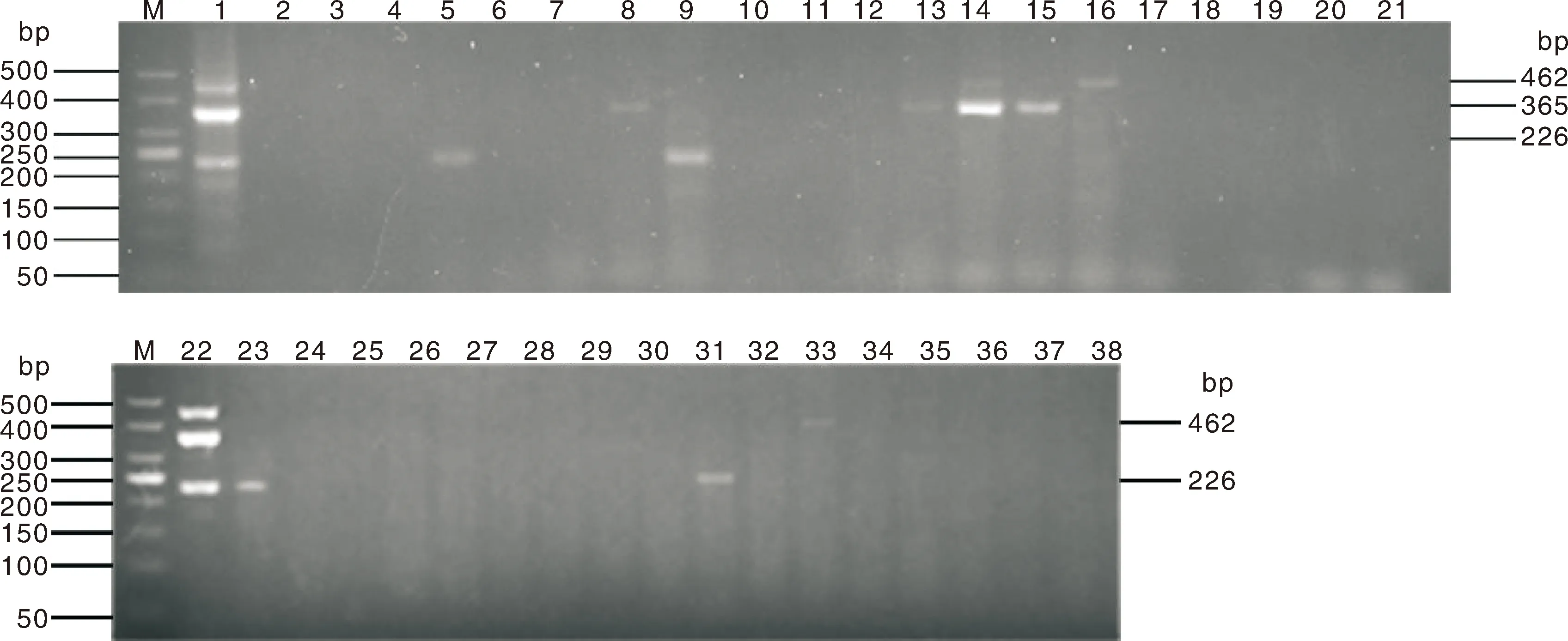
M,50 bp DNA Ladder Marker;1、22,阳性对照;2~20、23~37,临床样品;21、38,阴性对照。M, 50 bp DNA Ladder Marker; 1 and 22, Positive control; 2-20, 23-37, Clinical samples; 21 and 38, Negative control.图9 临床样品检测多重PCR扩增结果Fig.9 Multiplex PCR amplification results of clinical sample detection

表2 两种方法对不同类型致病菌的检出率比较Table 2 Comparison of detection rates of different types of pathogenic bacteria by two methods
3 讨论
牛呼吸道疾病严重影响肉牛养殖业的健康发展[12]。肺炎克雷伯菌、多杀性巴氏杆菌、不动杆菌是引起牛呼吸道疾病的病原菌[13]。本试验旨在通过构建肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌检测方法,为肉牛养殖中细菌性病原的快速检测提供参考,最终为牛呼吸道疾病的防控奠定基础。
传统细菌学检测法检验步骤烦琐,检测周期较长。为了提高检测效率,通过优化PCR检测方法的特异性、灵敏度、退火温度,建立一种能够同时检测出肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌的多重PCR技术。通过单重PCR与多重PCR特异性试验,本研究建立的多重PCR检测法能够检出肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌这3种目标病原菌,而对于其他10种常见呼吸道病原菌均不能检出,并且该方法具有较好的特异性和重复性。张曼等[14]建立的禽多杀性巴氏杆菌、副鸡嗜血杆菌和大肠埃希菌多重PCR检测方法中,禽多杀性巴氏杆菌DNA检测下限为24.3 pg·μL-1,本研究中多重PCR方法多杀性巴氏杆菌检测下限是70.8 pg·μL-1;张越华等[15]建立的SPF级实验小鼠4种致病菌多重PCR方法中肺炎克雷伯菌最低检出量为10-5ng·μL-1,本实验室建立的多重PCR肺炎克雷伯菌最低检出量为69.8×10-5ng·μL-1;祝岩波等[16]建立的实验动物4种病原体多重PCR方法中肺炎克雷伯菌敏感性为10 pg·μL-1,多杀性巴氏杆菌、支气管鲍特杆菌、支原体敏感性为1 pg·μL-1,本实验室建立多重PCR方法中肺炎克雷伯菌敏感度为0.7 pg·μL-1,多杀性巴氏杆菌为70.8 pg·μL-1。通过综合对比发现,本研究建立的多重PCR方法可以达到检测临床样品的要求。
本研究建立的多重PCR方法可以同时检测出肺炎克雷伯菌、约翰逊不动杆菌、多杀性巴氏杆菌,具有操作简单、快速、准确等优点,且有较强的特异性、敏感性。通过临床样品检测结果显示,多重PCR检测法检出率高于传统细菌学检测法,表明多重PCR检测方法能够对临床样品进行准确检测,具有临床样品检测的应用能力。本研究建立的多重PCR方法为肉牛呼吸道主要病原菌的快速检测提供了重要的技术手段,为临床上快速鉴别诊断3种病原菌引起的肉牛呼吸道疾病提供了一种有效的检测方法。
