SERM治疗绝经前乳腺癌的不良反应及与预后的相关性
2020-03-04魏盘妹顾然陈天文李呈英朱靖齐柯
魏盘妹?顾然?陈天文?李呈英?朱靖?齐柯
【摘要】目的探討选择性雌激素受体调节剂(SERM)他莫昔芬/托瑞米芬治疗绝经前乳腺癌患者的不良反应及其与预后的相关性。方法 回顾分析诊治的乳腺癌患者资料,筛选出服用他莫昔芬或托瑞米芬内分泌治疗的绝经前ER/PR阳性乳腺癌患者,随访记录患者出现的治疗相关性不良反应和复发、转移及死亡情况,分析他莫昔芬和托瑞米芬的不良反应与无病生存率的相关性,以及它们对患者预后的影响。结果 174例(38.6%)乳腺癌患者在内分泌治疗过程中出现了潮热等更年期症状,其5年无病生存率比无出现更年期症状的乳腺癌患者低(P < 0.05);内分泌治疗有引起妇科症状的乳腺癌患者的5年无病生存率较无出现该症状者有轻微提高趋势(98.9% vs 94.9%,P = 0.070);使用托瑞米芬的患者更年期症状较使用他莫昔芬患者更常见(44.5% vs 33.3%, P < 0.05),而前者5年无病生存率也较后者高(97.2% vs 90.0%,P < 0.05)。结论 绝经前ER/PR阳性早期乳腺癌患者接受SERM内分泌治疗引起的更年期症状与无病生存率的改善有相关性。托瑞米芬引起的更年期症状比他莫昔芬更常见。使用托瑞米芬者较使用他莫昔芬者临床获益更多。
【关键词】选择性雌激素受体调节剂;生存;不良反应;内分泌治疗;乳腺癌
Study on the correlation between the side effects of endocrine therapy of SERM drugs and the prognosis of premenopausal breast cancer patients Wei Panmei, Gu Ran, Chen Tianwen, Li Chengying, Zhu Jing, Qi Ke. Department of Breast Surgery, Nanshan District Peoples Hospital, Shenzhen 510082, China
Corresponding author, Qi Ke, E-mail: 2914771612@ qq. com
【Abstract】Objective To study the correlation between the side effects of selective estrogen receptor regulator(SERM) and the prognosis of premenopausal breast cancer patients. Methods The data of patients with breast cancer were analyzed retrospectively. the patients with premenopausal ER/PR positive breast cancer treated with SERM were screened out. The side effects of endocrine therapy and recurrence, metastasis and death were recorded. The correlation between side effects of endocrine therapy and disease-free survival rate(DFSR), as well as the influence of tamoxifen and toremifen on clinical prognosis were analyzed. Results 174 cases (38.6%) of breast cancer patients developed climacteric symptoms such as hot flash during endocrine therapy. The five-year DFSR was lower than that of breast cancer patients without climacteric symptoms (P < 0.05). The five-year DFSR of breast cancer patients with gynecological symptoms caused by endocrine therapy was higher than that of patients without gynecological symptoms (98.9% vs. 94.9%,P = 0.070), and climacteric symptoms were more common in patients treated with tamoxifen than those treated with tamoxifen (44.5% vs. 33.3%, P < 0.05), and five-year DFSR in patients with tamoxifen was more beneficial than that in patients with tamoxifen (97.2% vs. 90%, P < 0.05). Conclusions The climacteric symptoms caused by selective estrogen receptor regulator (SERMs) endocrine therapy are correlated with the improvement of disease-free survival in patients with premenopausal ER/PR positive early breast cancer. Toremifen is more common than tamoxifen in endocrine therapy in premenopausal breast cancer patients. Patients with premenopausal breast cancer benefit more clinically from tamoxifen than those with tamoxifen.
【Key words】Selective estrogen receptor regulator;Survival;Side effects;Endocrine therapy;
Breast cancer
乳腺癌是女性最常见的恶性肿瘤,75%的早期乳腺癌为激素受体阳性型,选择性雌激素受体调节剂(SERM)是治疗绝经前激素受体阳性型乳腺癌患者的重要药物,可明显改善这类患者的无病生存期(DFS)和总生存期(OS)[1]。SERM类药物包括他莫昔芬和托瑞米芬,其作用机制是基于靶器官、靶组织、剂量及疗程长短等在体内起雌激素拮抗作用或雌激素样作用[2]。SERM类药物通过雌激素拮抗作用抑制乳腺癌细胞的生长,并促进其凋亡而达到治疗肿瘤的目的,但也因雌激素的拮抗作用而引起血管舒缩症状如潮热和情绪障碍等[3]。
在抗肿瘤治疗过程中,治疗相关性不良反应难以避免,然而某些特定不良反应的出现常提示个体对药物反应良好,例如,使用表皮生长因子类药物治疗的患者出现皮疹则预示临床预后良好[4]。因雌激素拮抗引起的更年期症状(如潮热、出汗等)是他莫昔芬常见的不良反应[3]。既往的研究显示绝经后乳腺癌患者在内分泌治疗过程中出现潮热或肌肉关节疼痛症状者较无出现者的临床预后好[5]。上述研究结果提示了内分泌治疗引起的某些特定的不良反应可能是药物有效标志。在本研究中,笔者分析在使用SERM内分泌治疗的绝经前雌激素受体/孕激素受体(ER/PR)阳性早期乳腺癌患者中,药物引起的不良反应与患者的临床预后是否有关,同时比较他莫昔芬和托瑞米芬出现不良反应及对临床预后影响的差异。
对象与方法
一、研究对象
选择2004年1月至2014年6月在华中科技大学协和深圳医院和中山大学孙逸仙纪念医院乳腺外科收治的初治无远处转移的原发乳腺癌患者为研究对象,按以下纳入及排除标准对其进行筛选。纳入标准: ①绝经前ER/PR阳性乳腺癌患者; ② 辅助内分泌治疗为他莫昔芬或托瑞米芬。排除标准: ① 治疗过程中出现绝经;②同时患有对侧原发乳腺癌;③未按指征行手术、放射治疗、化学治疗或辅助内分泌治疗;④既往或同时患有其他非乳腺恶性肿瘤。共有451例患者符合上述标准,所有患者均接受了乳腺癌保乳根治术或乳腺癌改良根治术,术后按指征进行规范的辅助化学治疗及放射治疗,并在化学治疗结束后开始行SERM类药物内分泌治疗。其中服用他莫昔芬者纳入TAM组,服用托瑞米芬者纳入TOR组。
二、 方 法
术后患者需按医嘱定期复诊,通过门诊或电话随访方式收集患者在使用他莫昔芬或托瑞米芬治疗过程中出现的不良反应,主要分为3类:①更年期症状,包括潮热、夜间盗汗、失眠、情绪障碍等;②妇科症状,包括阴道异常流血、子宫内膜增厚、子宫内膜癌、卵巢囊肿等;③肌肉骨关节疼痛症状。随访日期截至2019年7月11日,未出现复发的存活患者和失访患者的分析结点为其最后1次随访时间。DFS定义为从治疗开始至局部复发、区域复发和远处转移,因总死亡人数太少(共5例),本研究主要研究终点设为DFS。
三、统计学处理
采用SPSS 16.0处理数据。分类资料用例(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,log-rank检验对比生存曲线,用单因素和多因素Cox回归分析2组间可能影响预后的因素:年龄、肿瘤大小、淋巴结状态、组织学分级、手术方式、化学治疗、辅助内分泌治疗、放射治疗以及SERM类药物引起的不良反应[6]。P < 0.05为差异有统计学意义。
结果
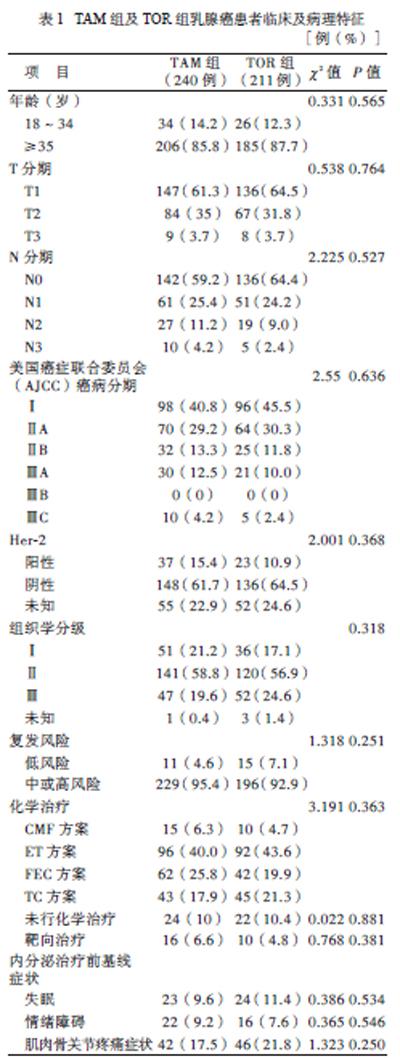
一、TAM组及TOR组乳癌腺患者的临床及病理特征
2组患者的临床及病理特征比较差异无统计学意义(P均 > 0.05),见表1。
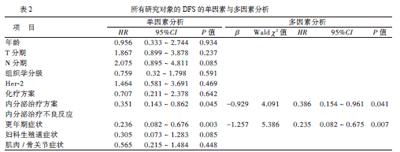
二、DFS的单因素分析和多因素分析
本次研究中,患者5年总生存率和5年无病生存率(DFSR)分別为98.9%和93.3%,其中TAM组患者5年总生存率和5年DFSR分别为97.9%和90.4%;TOR组患者5年OS和5年DFSR分别为100%和97.2%。
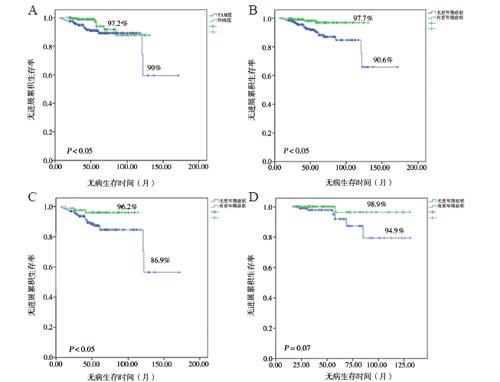
因死亡人数仅5例,故不行总生存分析,只对DFS的影响因素进行分析。我们从单因素分析结果中选出对临床预后有影响的因素(P < 0.05)进行多因素分析,找出影响临床预后的危险因素。Kaplan-Meier生存曲线显示内分泌药物类型(他莫昔芬与托瑞米芬)和内分泌治疗过程中出现的更年期症状这一不良反应对DFS有影响,TOR组比TAM组患者5年DFSR更高(97.2% vs. 90.0%,P < 0.05,图1A);内分泌治疗过程中出现更年期症状者比无出现者DFSR更高(97.7% vs. 90.6%,P < 0.05,图1B);妇科生殖道症状与肌肉/骨关节症状的出现与否对DFS的影响差异无统计学意义,而Cox多因素分析则表明内分泌治疗引起的更年期症状是DFS的独立影响因素,内分泌治疗引起更年期症状与DFS的改善有关(HR = 0.235, 95%CI = 0.082 ~ 0.675, P < 0.05);TOR组比TAM组患者DFS有所改善(HR = 0.386,95%CI = 0.154 ~ 0.961,P < 0.05),见表2。
三、分别对TAM组和TOR组的DFS进行亚组分析
TAM组患者更年期症状发生率为33.3%,TOR组患者更年期症状发生率为44.5%,两者差异有统计学意义(P < 0.05),见表3。TAM组患者的DFS生存曲线分析显示,服用他莫昔芬出现更年期症状患者的5年DFSR比无出现者更高(96.2% vs. 86.9%,P < 0.05,图1C),TOR组患者的DFS生存曲线分析显示,虽然有无更年期症状对DFSR的影响无差异,但可以看出,服用托瑞米芬出现更年期症状患者的5年DFSR较无出现更年期症状者有轻微提高的趋势,但比较差异尚未有统计学意义(98.9% vs. 94.9%,P = 0.070,图1D)。
讨论
本次研究结果表明,使用他莫昔芬或托瑞米芬进行内分泌治疗引起的更年期症状与DFS的改善有关,妇科生殖道症状和肌肉/骨关节症状的出现与否则对DFS的影响不明显。托瑞米芬较他莫昔芬更容易引起更年期症状,而使用托瑞米芬的患者复发转移率也较使用他莫昔芬的患者低,提示内分泌治疗引起的更年期症状这一特定不良反应与临床预后的改善有相关性。
关于他莫昔芬引起的更年期症状及其与临床预后的关系的机制已有学者进行了研究,有学者曾对潮热的遗传药理学进行研究发现,基因型为高代谢活力型CYP2D6的乳腺癌患者服用他莫昔芬内分泌治疗,其DFS要比中等代谢活力型或无代谢活力型CYP2D6的乳腺癌患者长[7]。在本研究中,潮热等更年期症状在托瑞米芬组更常见。托瑞米芬与他莫昔芬在分子结构上的差别为分子侧链上多了一个氯离子,其代谢机制与他莫昔芬不同,与CYP2D6酶无相关性[8]。而中国人群CYP2D6基因型较常见为中等代谢活力型或无代谢活力型,这个群体对他莫昔芬代谢效能低,这可能是他莫昔芬组出现的更年期症状较托瑞米芬组少,预后稍差的主要原因[9]。
骨质丢失是抗雌激素治疗中可预测的结果,使用芳香酶抑制剂(AI)类药物内分泌治疗的乳腺癌患者骨质丢失非常明显[10]。在使用AI类药物内分泌治疗的患者中,肌肉/骨关节疼痛症状特别明显,其与更长的DFS和OS有关[11]。而在本次研究中,我们并未发现肌肉/骨关节症状与DFS有明显相关性,其中的原因可能为,SERM类药物在骨关节具有部分雌激素受体兴奋作用,从而预防骨质丢失,起保护作用,因此较少引起肌肉骨关节症状[12-13]。至于服用SERM出现肌肉/骨关节痛的可能原因,Blencowe等(2010年)通过研究发现,服用普通他莫昔芬的患者出現的关节痛症状在转用诺瓦得士后消失,这提示可能是普通他莫昔芬的辅料引起了关节症状,但具体机制仍待进一步深入的研究。
尽管内分泌治疗可有效降低乳腺癌复发风险,但实际上患者对AI类药物和他莫昔芬的治疗依从性都不甚理想,从而降低了药物的疗效。我们的研究结果提示在内分泌治疗过程中,面对药物引起的不良反应,医患沟通非常重要,当患者在治疗中出现药物不良反应时,医师应及时对其进行科学宣教,告知患者内分泌治疗过程中出现的某些不良反应可能是药物疗效良好的表现,必要时予对症处理,从而提高患者在漫长的内分泌治疗过程中的依从性。同时,我们的研究也提出了一个问题,针对由SERM引起的不良反应的治疗是否合适,因为如果它们的作用机制一致,改善内分泌药物引起的不良反应的药物也可能降低内分泌药物的疗效。
参 考 文 献
[1] Charlier C, Colin C, Merville MP, Gielen J, Lambotte R, Plomteux G, Castronovo V. Tamoxifen in the treatment of breast cancer. J Gynecol Obstet Biol Reprod (Paris),1994,23(7):751-756.
[2] Patel HK, Bihani T. Selective estrogen receptor modulators (SERMs) and selective estrogen receptor degraders (SERDs) in cancer treatment. Pharmacol Ther, 2018,186:1-24.
[3] Yang G, Nowsheen S, Aziz K, Georgakilas AG. Toxicity and adverse effects of Tamoxifen and other anti-estrogen drugs. Pha-rmacol Ther, 2013,139(3):392-404.
[4] Steffens M, Paul T, Hichert V, Scholl C, von Mallek D, Stelzer C, S?rgel F, Reiser B, Schumann C, Rüdiger S, Boeck S, Heinemann V, K?chele V, Seufferlein T, Stingl J. Dosing to rash?—The role of erlotinib metabolic ratio from patient serum in the search of predictive biomarkers for EGFR inhibitor-mediated skin rash. Eur J Cancer, 2016,55:131-139.
[5] Fontein DB, Charehbili A, Nortier JW, Putter H, Kranenbarg EM, Kroep JR, Linn SC, van de Velde CJ. Specific adverse events are associated with response to exemestane therapy in postmenopausal breast cancer patients: results from the TEAMIIA study (BOOG2006-04). Eur J Surg Oncol, 2017,43(4):619-624.
[6] Goldhirsch A, Wood WC, Gelber RD, Coates AS, Thürlimann B, Senn HJ; 10th St. Gallen conference. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007. Ann Oncol, 2007,18(7):1133-1144.
[7] Sanchez-Spitman AB, Dezentjé VO, Swen JJ, Moes DJAR, Gelderblom H, Guchelaar HJ. Genetic polymorphisms of 3-untranslated region of SULT1A1 and their impact on tamoxifen metabolism and efficacy. Breast Cancer Res Treat, 2018,172(2):401-411.
[8] Watanabe M, Watanabe N, Maruyama S, Kawashiro T. Compar-ative metabolic study between two selective estrogen receptor modulators, toremifene and tamoxifen, in human liver micros-omes. Drug Metab Pharmacokinet, 2015,30(5):325-333.
[9] Bezerra LS, Santos-Veloso MAO, Bezerra Junior NDS, Fonseca LCD, Sales WLA. Impacts of cytochrome P450 2D6 (CYP2D6) genetic polymorphism in tamoxifen therapy for breast cancer. Rev Bras Ginecol Obstet, 2018,40(12):794-799.
[10] Kwan ML, Yao S, Laurent CA, Roh JM, Quesenberry CP Jr, Kushi LH, Lo JC. Changes in bone mineral density in women with breast cancer receiving aromatase inhibitor therapy. Breast Cancer Res Treat, 2018,168(2):523-530.
[11] Huober J, Cole BF, Rabaglio M, Giobbie-Hurder A, Wu J, Ejlertsen B, Bonnefoi H, Forbes JF, Neven P, Láng I, Smith I, Wardley A, Price KN, Goldhirsch A, Coates AS, Colleoni M, Gelber RD, Thürlimann B; BIG 1-98 Collaborative and International Breast Cancer Study Groups. Symptoms of end-ocrine treatment and outcome in the BIG 1-98 study. Breast Cancer Res Treat, 2014,143(1):159-169.
[12] B?rjesson AE, Farman HH, Movérare-Skrtic S, Engdahl C, Antal MC, Koskela A, Tuukkanen J, Carlsten H, Krust A, Chambon P, Sj?gren K, Lagerquist MK, Windahl SH, Ohlsson C. SERMs have substance-specific effects on bone, and these effects are mediated via ERαAF-1 in female mice. Am J Physiol Endocrinol Metab, 2016,310(11):E912-E918.
[13] Honma N, Makita M, Saji S, Mikami T, Ogata H, Horii R, Akiyama F, Iwase T, Ohno S. Characteristics of adverse events of endocrine therapies among older patients with breast cancer. Support Care Cancer, 2019,27(10):3813-3822.
(收稿日期:2019-10-22)
(本文編辑:洪悦民)
