HSP70-肝癌抗原肽复合物修饰DC瘤苗对CIK细胞增殖活性及表型变化的影响
2020-03-04潘洁宋慧东王巧瑜萧间开
潘洁?宋慧东?王巧瑜?萧间开
【摘 要】目的 研究熱休克蛋白70(HSP70)-肝癌抗原肽(SMMC7721人肝癌细胞株)复合物修饰的树突状细胞(DC)对细胞因子诱导的杀伤(CIK)细胞的增殖活性及表型的影响。方法 获取健康供者的外周血单个核细胞(PBMC),培养2 h,贴壁细胞诱导分化DC,非贴壁细胞用于诱导培养CIK细胞,DC生长第7日开始负载HSP70(A组)、肝癌抗原肽(B组)、HSP70-肝癌抗原肽复合物(C组),另设单纯DC组(D组),流式细胞检测CD80、CD86的表达,体外构建HSP70-抗原肽复合物-DC瘤苗,并将其和CIK细胞按1∶10的比例混合培养5 d,四甲基偶氮唑蓝法检测细胞增殖能力,以流式细胞仪检测DC及CIK细胞膜表面分子表达。结果 HSP70-肝癌抗原肽复合物可促进DC成熟,DC表面分子CD86、CD80在C组表达均较D组高(P均< 0.01)。HSP70-肝癌抗原肽复合物-DC瘤苗可明显刺激CIK细胞的增殖。HSP70-肝癌抗原肽复合物-DC瘤苗与CIK共培养可使CIK细胞CD3+CD8+、CD3+CD56+的表达提高,与单纯培养CIK细胞比较差异均有统计学意义(P均< 0.05)。结论 HSP70-肝癌抗原肽复合物能提高DC表面分子CD80、CD86 等表达,诱导DC的成熟,HSP70-抗原肽复合物-DC瘤苗与CIK细胞共培养可明显增加CIK细胞的增殖活性,提高CIK细胞CD3+CD8+、CD3+CD56+的表达。
【关键词】热休克蛋白70-肝癌抗原肽复合物;热休克蛋白70;树突状细胞;
细胞因子诱导的杀伤细胞;免疫治疗
Effect of HSP-70 hepatoma antigen peptide complex-modified dendritic cells on proliferation activity and phenotype of CIK cells Pan Jie, Song Huidong, Wang Qiaoyu, Xiao Jiankai. Department of Gastroen-terolgy, Guangzhou No.12 Hospital, Guangzhou 510620, China
【Abstract】Objective To evaluate the effect of dendritic cells(DC) modified by heat shock protein 70(HSP70) -SMMC7721 tumor peptide complex upon the proliferation activities and phenotype changes of cytokine-induced killer(CIK) cells. Methods Peripheral blood mononuclear cells were obtained from healthy donors and cultured for 2 h. The adherent cells were induced to differentiate DC and non-adherent cells were utilized to induce CIK cells. DCs were loaded with HSP70 (group A), hepatoma antigen peptide (group B) and HSP70-hepatoma antigen peptide complex (group C) on the seventh day of growth, and DC alone were allocated into group D. The expression of CD80 and CD86 was detected by flow cytometry. HSP70-antigen peptide complex-DC tumor vaccine was constructed in vitro, and co-cultured with CIK cells at a ratio of 1:10. The proliferation of CIK was measured by MTT assay. The expression of molecules on the membrane surface of DCs and CIK was observed by flow cytometry. Results HSP70-SMMC7721 peptide complex could accelerate the maturity of DC. The expression levels of CD80 and CD86 on the membrane surface of DC in group C were significantly higher compared with those in group D (both P < 0.01). HSP70-antigen peptide complex-DC tumor vaccine could remarkably stimulate the proliferation of CIK cells. The expression levels of CD3+CD8+, CD3+CD56+ in CIK cells were significantly up-regulated after the co-culture of HSP70-antigen peptide complex-DC tumor vaccine and CIK compared with those after the culture of CIK cells alone (all P < 0.05). Conclusions HSP70-SMMC7721 tumor peptide complex can up-regulate the expression levels of CD80 and CD86 on the membrane surface of DC and induce the maturity of DC. The co-culture of HSP70-antigen peptide complex-DC tumor vaccine and CIK cells can significantly enhance the proliferation activity and up-regulate the expression levels of CD3+CD8+, CD3+CD56+ in CIK cells.
【Key words】Heat shock protein 70-SMMC7721 tumor peptide complex;Heat shock protein 70;
Dendritic cell;Cytokine-induced killer;Immunotherapy
原发性肝癌是高度恶性的肿瘤,病死率高居我国肿瘤的第二位。目前晚期肝癌尚无特效的治疗方法。近年来,随着生物治疗技术的突破,为肝癌的治疗提供了新的模式,其中细胞因子诱导的杀伤(CIK)细胞和树突状细胞(DC)的抗肿瘤免疫治疗是国内外研究的热点。目前已有不少DC-CIK 细胞免疫治疗用于多种实体肿瘤的基础及临床研究,也取得到了一定的成果,但在晚期肝癌治疗方面尚不成熟[1]。由于肝癌患者体内的DC存在功能缺陷,从而不能诱发抗原特异性T淋巴细胞应答, 因此,如何在体外诱导功能性DC应用于肝癌患者的主动免疫治疗,有重要的临床意义。本研究拟构建热休克蛋白70(HSP70)-肝癌抗原肽复合物修饰DC瘤苗,并将此DC瘤苗和CIK细胞共培养,观察DC-CIK的增殖活性和表型变化。探讨HSP70-肝癌抗原肽复合物对DC成熟的作用及其对CIK细胞群增殖的影响,为将来进一步应用于肝癌的免疫治疗提供理论依据。
材料与方法
一、材 料
胎牛血清(FBS)、完全1640培养基和淋巴细胞分离液购自美国Gibco公司;HSP70购自美国Cal-biochem公司;SMMC-7721肝癌细胞株为本实验室液氮保存株;人粒细胞-巨噬细胞集落刺激因子(GM-CSF)、人IL-4购自peprotech公司;异硫氰酸荧光素(FITC)标记的鼠抗人CD86、CD80单克隆抗体购自美国Immunotech公司;FITC标记的鼠抗人CD3、CD4 单抗,藻红蛋白(PE)标记的CD8、CD56单抗购自Santa Cruz 公司;二甲基亚砜及四甲基偶氮唑蓝(MTT)购自美国Sigma公司。
二、方 法
1.肿瘤抗原制备
取对数生长期的SMMC-7721细胞,调细胞浓度为5×106/ml,细胞反复冻融3次(-80℃与37℃,10 分/次),显微镜下观察无细胞结构后, 3000 r/min离心30 min,离心半径为10 cm,用滤器将上清过滤于无菌EP管中(相当于癌细胞107/ml),放置在-80℃冰箱保存备用。
2. SMMC-7721抗原肽与 HSP70 体外结合
按 Blanchere等[2]报道的方法,用磷酸盐缓冲液(PBS)将HSP70、SMMC-7721抗原肽、MgCl2、ADP调整各种成分的比例,使最终浓度为HSP70 120 μg/ml、抗原肽75 mg/L、MgCl2 1 mmol/L、ADP 1 mmol/L,充分混匀后在 37℃水浴中反应2 h备用。
3. DC的体外培养
采集健康供者外周抗凝血50 ml,用淋巴细胞分离液( Ficoll)分离出外周血单个核细胞 (PBMC),用1640完全培养基重悬细胞,调细胞浓度为(4 ~ 5)×106/ml,放置于37℃、5%CO2培养箱中培养2 h。收集未贴壁细胞待用,留下的贴壁细胞加入含1000 U/ml的GM-CSF、500 U/ml的IL-4和10%胎牛血清的1640培养液继续培养,隔日半量换液并补充细胞因子(首次浓度的1/2),培养7 d后收集的细胞即为未致敏DC。
4. CIK细胞的体外诱导和扩增
用含10%人AB血清的1640培养液将方法3收集的非贴壁细胞调浓度为(2 ~ 3)×106/ml,加入1000 U/ml的IFN-α懸浮培养,24 h后加入1
μg/ml的CD3单克隆抗体和1000 U/ml的IL-2,继续培养1周,每隔3 d半量换液1次,并补充等量的IL-2,用1640培养液调细胞浓度为(2 ~ 3) ×106/ml备用。
5. HSP70-肝癌抗原肽复合物修饰DC及检测细胞表型
收集方法3制备的未致敏DC,用1640培养液调细胞浓度为5×106/ml,6孔细胞培养板中进行培养(100 μl/孔),分别加入下列物质:HSP70组(A组),加入HSP70(120 μg/ml);肝癌抗原组(B组),按肝癌细胞(SMMC7721)与DC以10∶1的比例加入肝癌抗原(相当于106 /ml);HSP70+肝癌抗原组(C组),加入方法2制备的HSP70-肝癌抗原复合物120 μg/ml;单独DC组(D组)。37℃、5% CO2培养箱中培养,48 h后(即开始培养的第9日)分别收集4组DC备用。各组收集部分细胞进行细胞计数,调为每个试管中1×104个细胞,分别加入FITC标记的抗CD80、CD86单抗4℃反应45 min,用流式细胞仪(FCM)检测DC细胞表型。
6. DC与CIK细胞共培养
将方法5制备的各组DC细胞和CIK细胞按1∶10混合培养5 d得到DC-CIK细胞。
7.共培养后CIK细胞表型的测定
在CIK细胞培养的第0、14日分别取少量细胞进行流式细胞术测定,方法5制备的C组与CIK共培养3 d后进行流式细胞术测定。DC-CIK调浓度为5×106/ml, 分别加入FITC标记的鼠抗人CD3、CD4和PE标记的鼠抗人CD8、CD56各20 μl, 4℃避光孵育40 min,FCM检测CIK细胞表型。
8.不同组DC对CIK细胞增殖活性的影响
设单纯CIK为对照组,收集方法5制备的致敏DC,加入丝裂霉素A(25 μg/ml),37℃孵育30 min。调细胞浓度为1×105 /ml,与CIK细胞按1∶10比例混合,将细胞悬液加入24孔培养板,于37℃培养3 d,加入MTT 50 μl(3 mg/ml),后继续培养6 h,3000 r/min离心10 min,弃上清液,每孔加入二甲基亚砜100 μl(400 mmol/L)振荡10 min,于570 nm处测定吸光度(OD)值,每组6复孔,重复3次取均值,分别计算各组刺激指数(SI)。SI =实验组OD值/对照组OD值。
三、统计学处理
实验数据采用SPSS 17.0分析,所有数据均以表示,2组间比较采用独立样本t检验,前、后比较用配对t检验,多组间比较用方差分析,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果
一、细胞的表型分析
1.DC表型分析
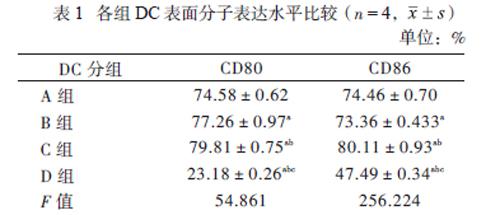
经FCM分析表明,抗原刺激后DC的CD80、CD86表达阳性率明显增加,符合成熟DC表型变化,见表1。A、B、C 3组与D组比较均升高(P均< 0.05),其中以C组表达率最高,A、B、C 3组之间比较差异均有统计学意义(P均< 0.05)。
2.CIK表型分析
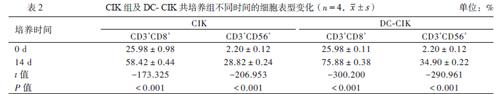
经FCM分析表明,随着培养时间的增加, CIK细胞中CD3+CD8+、CD3+CD56+双阳性细胞的百分含量逐渐上升;在培养的第14日,2组细胞的CD3+CD8+、CD3+CD56+细胞群百分含量均较培养前明显增加,差异均有统计学意义(P均< 0.01),与DC共培养的CIK细胞CD3+CD8+、CD3+CD56+双阳性细胞的百分含量更高,与单纯CIK组比较差异均有统计学意义(P均< 0.05),见表2。
3.不同组别DC对CIK细胞增殖作用的影响
在培养的第3日CIK细胞开始增殖,体积变大、细胞质丰富,并出现多形性,第5日以后进入快速增殖期,第9日与DC细胞共培养后,CIK细胞具有更高的增殖活性,14 d左右达到增殖高峰,MTT法显示各组的OD值分别为:A组0.44± 0.02、B组0.44±0.02、C组0.62±0.16、D组0.23±0.01、对照组0.18±0.01,A、B、C、D 4组与对照组比较差异均有统计学意义(P均< 0.05),其中以C组为最高,A、B、C、D 4组之间比较差异均有统计学意义(P均< 0.05)。SI以C组为最高,与A、B、D 3组比较差异均有统计学意义(P均< 0.05)。
讨论
DC是体内功能最强的抗原提呈细胞,也是唯一能激活初始T淋巴细胞的抗原提呈细胞,在抗肿瘤免疫方面起着主导作用[3]。只有成熟的DC才能刺激淋巴细胞增殖,从而激发有效的免疫应答反应,而肿瘤患者体内DC存在数量和功能上的缺陷,是肿瘤免疫缺陷的主要原因,因此,如何充分激活并发挥 DC的功能活性,将成为抗肿瘤免疫治疗的关键[4]。
HSP70家族是一类重要的应激蛋白,作为一种分子伴侣,具有增强细胞免疫的佐剂作用和激活DC的能力, 在抗肿瘤免疫中可发挥重要作用[5]。肿瘤细胞抗原肽属于小分子量物质,抗原提呈细胞DC等难以将它们捕获,DC表面存在HSP70高亲和力受体CD91,HSP70可以加工肿瘤抗原并递呈到DC细胞表面,从而活化T淋巴细胞,产生特异性的抗肿瘤细胞免疫[6]。因此,HSP 具有强有力的增强细胞免疫的功能,在抗肿瘤免疫中可发挥重要的辅助作用,对开发肿瘤疫苗具有重要的意义[7]。
CIK细胞是一种非MHC限制性的细胞毒性T淋巴细胞,其主要效应细胞表面表达CD3+CD56+,具有广谱、强效的杀伤肿瘤细胞特性。有研究显示将DC和CIK细胞混合培养时,细胞因子释放增加,可使CIK细胞增殖速度加快、细胞毒性增强,并使其杀瘤活性增高[8]。因此,本研究从细胞研究水平,应用HSP70与人SMMC-7721肝癌细胞冻融抗原修饰DC,促进DC的活化成熟,然后将活化的DC与CIK细胞按比例共同培养,觀察DC和CIK的增殖能力及表型的变化。
研究结果表明,肝癌冻融抗原和HSP70联合作用于DC与肝癌冻融抗原修饰DC均可以诱导DC高表达表面分子CD80、CD86,促进DC成熟,增强DC刺激CIK增殖的能力,其中以肝癌冻融抗原和HSP70联合作用组的DC更加成熟,同单独应用肝癌冻融抗原及HSP70相比,其诱导CIK细胞增殖的能力更强,与M?rten等[9]研究结果相似,并且DC-CIK细胞群的增殖活性比同源CIK细胞更强,共培养5 d后DC-CIK的刺激指数较单独CIK组明显提高,同时CIK细胞中CD3+CD8+、CD3+CD56+的比例明显增高,说明大量成熟DC可以进一步促进CIK细胞的成熟,其机制可能与成熟DC分泌高水平的IL-2、IL-12和IFN等细胞因子有关[10]。本研究为DC-CIK应用于肝癌治疗提供了初步的实验依据,是将主动特异性免疫治疗和过继免疫治疗相结合产生更有效的肿瘤免疫治疗方法的初步探索。
综上所述,HSP70-肝癌抗原肽复合物能提高 DC 表面分子 CD80、CD86等表达,诱导 DC 的成熟,HSP70-抗原肽复合物-DC瘤苗与CIK细胞共培养可明显增加CIK细胞的增殖活性,提高CIK细胞CD3+CD8+、CD3+CD56+ 的表达。
参 考 文 献
[1] 张鹏,姜华,刘瑞磊, 刘宇,张翘楚,黄勇.三阴乳腺癌疫苗刺激T淋巴细胞增殖免疫效应观察. 新医学,2012, 43(12):861-865,897.
[2] Blanchere NE,Li ZH,Chandawarkar RY,Suto R, Jaikaria NS, Basu S, Udono H, Srivastava PK. Heat shock protein-pepide complexes, reconstituted in vivo,elicit peptide-specific cytotoxic T lymphocyte response and tumor immunity. J Exp Med,1997,186(8):1315-1322.
[3] Kaplowitz N. Idiosyncratic drug hepatotoxicity. Nat Rev Drug Discov,2005,4(6):489-499.
[4] Watkins PB, Seeff LB. Drug-induced liver injury: summary of a single topic clinical research conference. Hepatology,2006,43(3):618-631.
[5] Wan T,Zhou X,Chen G, An H, Chen T, Zhang W, Liu S, Jiang Y, Yang F, Wu Y, Cao X. Novel heat shock protein Hsp70L1 activates dendritic cells and acts as a Thl polarizing adjuvant. Blood,2004,103(5):1747-1754.
[6] Basu S,Binder RJ,Ramalingam T, Srivastava PK. CD91 is a common receptor for heat shock proteing gp96, hsp90, hsp70 and calreticulin. Immunity,2001,14(3): 303-313.
[7] Moroi Y,Mayhew M, Trcka J,Hoe MH, Takechi Y, Hartl FU, Rothman JE, Houghton AN. Induction of cellular immunity by immunization with novel hybrid peptides complexed to heat shock protein 70. Proc Natl Acad Sci U S A, 2000, v97(7): 3485-3490.
[8] Pievani A, Belussi C, Klein C, Rambaldi A, Golay J, Introna M. Enhanced killing of human B-cell lymphoma targets by combined use of cytokine-induced killer cell(CIK) cultures and anti-CD20 antibodies. Blood,2011,117(2):510-518.
[9] M?rten A, Renoth S, von Lilienfeld-Toal M, Buttgereit P, Schakowski F, Glasmacher A, Sauerbruch T, Schmidt-Wolf IG. Enhanced lytic activity of cytokine-induced killer cells against multiple myelom a cells after co-culture with idiotype-pulsed dendritic cells. Haematologica, 2001,86(10):1029-1037.
[10] Zoll B, Lefterova P, Ebert O, Huhn D, Von Ruecker A, Schmidt-Wolf IG. Modulation of cell surface Markers on NK-like T lymphocytes by using IL-2, IL-7 or IL-12 in vitro stimulation. Cytokine, 2000,12(9): 1385-1390.
(收稿日期:2019-10-12)
(本文編辑:杨江瑜)
