部分氧解耦煤化学链燃烧中硫的演化与分布
2020-03-04王保文李贺宇蔡中元梁彦琛
王保文, 李贺宇, 王 维, 蔡中元, 姜 涛, 梁彦琛
(华北水利水电大学 电力学院,河南 郑州 450045)
煤燃烧产生的CO2是导致全球气候变暖的重要原因,控制并减少燃煤CO2排放非常关键。煤化学链燃烧(CLC)是创新的煤燃烧技术,其通过高活性载氧体代替空气,可以在保证煤高效利用和NOx有效减排的前提下,实现燃煤CO2的低成本在线捕集,具有极大的学术研究意义和应用前景[1]。以CuFe2O4作为载氧体的部分氧解耦煤化学链燃烧(CLPOU)技术是Fe2O3基CLC技术与CuO基氧解耦化学链技术(CLOU)的有机结合,在集成单金属载氧体各自优点的基础上,CuFe2O4既能直接分解释放O2、又能进一步传递残余Fe2O3中晶格氧,对煤的充分转化非常有利,极具发展潜力和应用价值。然而,硫元素作为煤中含有的主要元素之一,直接参与化学链燃烧中会引起极大的危害。一方面,煤中硫元素的演化及其与载氧体的反应会导致载氧体中毒失活和系统运行的不稳定;另一方面,燃料反应器和空气反应器出口释放的气相硫化物会造成CO2的后处理困难及环境污染[2-3]。
煤中硫元素的赋存形态、迁移转化及其与载氧体交互作用的复杂性和潜在危害性,使深入研究煤化学链燃烧中硫的演化显得十分必要。东南大学沈来宏教授课题组[4-6]研究了煤和高硫石油焦在化学链燃烧和气化过程中的反应性能及硫的转化;西班牙ICB-CSIC研究所的Adanez-Rubio等[7]及Mendiara等[8]分别对西班牙高硫褐煤与CuO载氧体、铁矿石载氧体的反应过程中硫组分分布进行了研究;华中科技大学赵海波教授课题组[9-11]研究了煤中硫在热解及化学链氧解耦燃烧过程中的演化;笔者所在课题组[12-13]则基于热重红外分析技术对包括CuFe2O4在内的多种复合载氧体与高硫煤的化学链燃烧时的演化加以研究。鉴于部分氧解耦煤化学链燃烧中CuFe2O4的高温部分氧解耦特性[14]、煤中硫组分的迁移转化及其与载氧体在高浓度CO2气氛下相互作用的复杂性,目前对CuFe2O4在部分氧解耦化学链燃烧(CLPOU)过程中气、固相硫的演化及分布有待深入研究。
在以煤为燃料的化学链燃烧中,硫可能形成气相硫化物或固相硫化物。硫的演化及分布与其反应条件紧密相关。鉴于煤中硫组分赋存形态的复杂性,笔者选取富含黄铁矿硫的六枝煤为研究对象,在高温固定床反应器上,系统研究了在六枝煤与CuFe2O4复合载氧体的CLPOU过程中硫的演化及分布,并进一步考察反应温度、载氧体过量系数及CO2反应气氛对硫迁移转化的影响。
1 实验部分
1.1 实验原料
实验所用煤种为六枝原煤,记为LZ。原料煤在105 ℃下真空干燥24 h,然后真空研磨至粒径 105~300 μm 作为实验用煤样品。CuFe2O4载氧体采用溶胶-凝胶燃烧合成法(SGCS)制备,具体制备方法参照作者所在课题组前期文献[12]。制备的CuFe2O4载氧体同样研磨为105~300 μm颗粒。基于作者所在课题组前期研究[3],采用质量平衡法确定载氧体的添加量,将载氧体与LZ煤样品颗粒按设定比例混合搅拌均匀,确保煤充分转化。LZ煤的工业分析、元素分析及灰分分析如表1所示。根据国家标准《煤中各种形态硫的测定方法》(GB/T 215—2003)进行煤中形态硫的测定,结果示于表2中。结合表1和表2可以看出,实验所用的LZ煤为中高硫煤,其中黄铁矿硫占总硫的质量分数约75%,而煤灰中矿物质以SiO2、Al2O3等为主。
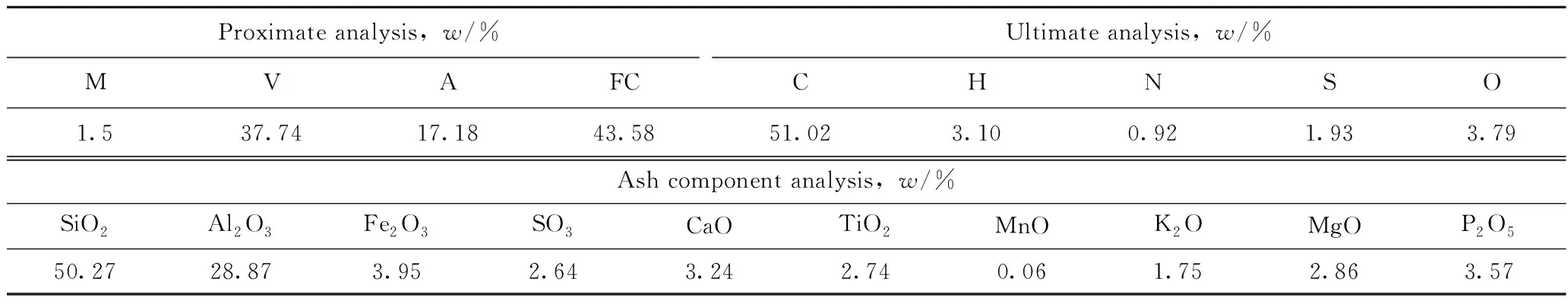
表1 LZ煤的元素分析、工业分析及灰成分分析Table 1 Ultimate analysis, proximate analysis and ash component analysis of LZ coal

表2 LZ煤的形态硫分析Table 2 Sulfur forms analysis of LZ coal
1.2 实验装置和步骤
实验在自建的高温固定床反应器上进行,具体如图1所示。该反应器主要由供气系统、流量控制系统、管式炉反应器、烟气后处理及分析系统4部分组成。反应器主体为双温水平式管式炉,加热区中心部位设置有K型热电偶并通过温控仪精确调控。反应管为耐高温石英管(Φ60 mm×2000 mm),其尾部外伸部分为样品冷却区,以保证在管内惰性气氛保护下输送样品及快速降温。烟气经除尘、冷凝、干燥后分别通入在线红外煤气分析仪和微量硫分析仪中,分别检测CO2、CO、CH4、H2、O2等常量气体及SO2、H2S、COS、CS2等微量气相硫化物的浓度。
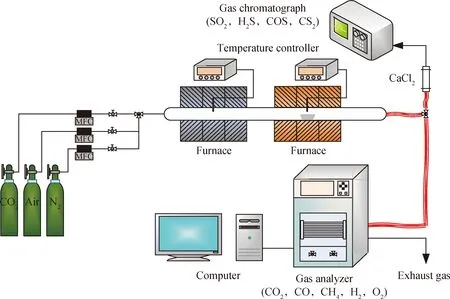
图1 高温固定床反应器系统示意图Fig.1 Schematic diagram of the high temperature fixed-bed reactor system
分别按程序升温实验方法和等温实验方法进行LZ煤与CuFe2O4载氧体的燃烧实验,两种方法中LZ煤分别取0.5 g和0.3 g。在程序升温实验中,以10 ℃/min升至1000 ℃,每2.5 min采用气袋定时收集,离线测试气相硫组分含量。等温实验中,在800~950 ℃时,载氧体过量系数α取1~2.5,每0.5 min采气一次。进行多次预实验,便于对反应过程气相产物的准确测量。此外,为研究CO2反应气氛对燃烧过程的影响,在上述纯N2气氛实验基础上,还进行了N2-CO2混合气等温实验,在纯N2和N2-CO2两种不同反应气氛下的气体流量均为1.25 L/min。由于载氧体与LZ煤的质量比变化较大,因此在等温实验中,通过改变煤的质量来调整载氧体过量系数α的值,具体参见作者所在课题组前期研究[3]。为了便于分析,对实验结果进行归一化处理,即通过不同工况下的单位煤中硫释放浓度,比较不同工况下硫的释放量。
对于实验中收集的固相产物,采用X射线衍射仪(XRD,PANalytical X’Pert PRO,荷兰)对物相组分加以识别,采用场发射扫描电镜-能谱仪(FESEM-EDX,JEOL JSM-7610/7001,日本)研究微观形貌及微区产物元素分布,采用X射线光电子能谱仪(XPS,Thermo ScientificTM,K-AlphaTM+,美国)对表面化学价态进行分析。
1.3 数据处理
实验过程中,尾部烟气流量Fout由N2平衡法计算得到,计算公式如下:
(1)
其中:Fin为反应器入口烟气的摩尔流量,mol/min;yCO、yCO2、yCH4、yH2、yO2分别表示尾部烟气中CO、CO2、CH4、H2、O2的体积分数,%。
根据含碳气体的浓度变化情况,计算反应过程中碳总转化率(XC,%)、转化速率(RC(t),%/min)及CO2产率(γCO2,%):
XC=
(2)
(3)
(4)
式中:t0为反应开始时的时间,min;Fout(t)为t时刻出口烟气的摩尔流量,mol/min;yCO(t)、yCO2(t)、yCH4(t)分别为t时刻气体产物中CO、CO2、CH4的体积分数,%;nC,coal为燃料中C原子的物质的量,mol。
对于气相硫组分的释放,通过对尾气中各种气相硫的释放体积分数进行积分,计算煤中硫的释放率(ωSO2,%):
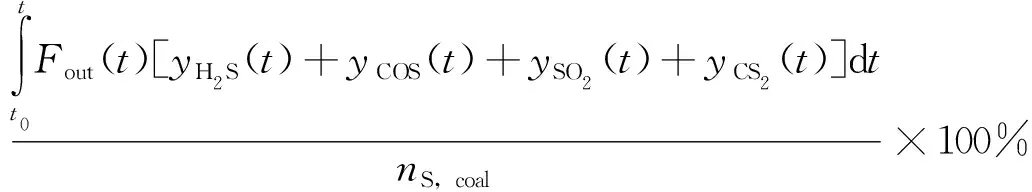
(5)
式中:yH2S(t)、yCOS(t)、yCS2(t)、ySO2(t)分别为t时刻气体产物中H2S、COS、CS2、SO2的质量分数,μg/g;nS,coal为燃料中S原子的物质的量,mol。
2 结果与讨论
2.1 LZ煤与CuFe2O4载氧体程序升温实验
鉴于煤中不同硫组分反应活性的差异性,为了充分体现LZ煤与CuFe2O4载氧体在反应过程中气相硫组分的演化及分布,实验首先采用程序升温对N2气氛下LZ煤与CuFe2O4载氧体反应特性加以初步研究,结果如图2所示。图2(a)和图2(b)分别为出口尾气中常量气体及微量气相硫化物的释放曲线。
如图2(a)所示,当LZ煤与CuFe2O4载氧体反应时,反应尾气经冷凝干燥后,常量气体以CO2为主,其释放曲线为双峰曲线。由于反应器附带温控仪,在程序升温过程中,随着反应时间的增加,反应温度相应增加。图2(a)中基于反应时间的CO2释放峰值对应温度分别为560 ℃和900 ℃,分别对应LZ煤一次热解产物(如CO、CH4等)和二次热解产物(H2、CO)及残余焦炭与CuFe2O4载氧体反应产生的CO2的释放过程,其反应式如式(6)~(8)所示[15]。同时,在576 ℃的较低温度下,由于煤一次热解产生的CH4未完全被CuFe2O4复合载氧体充分氧化,在反应器出口的尾气中发现少量CH4残存。
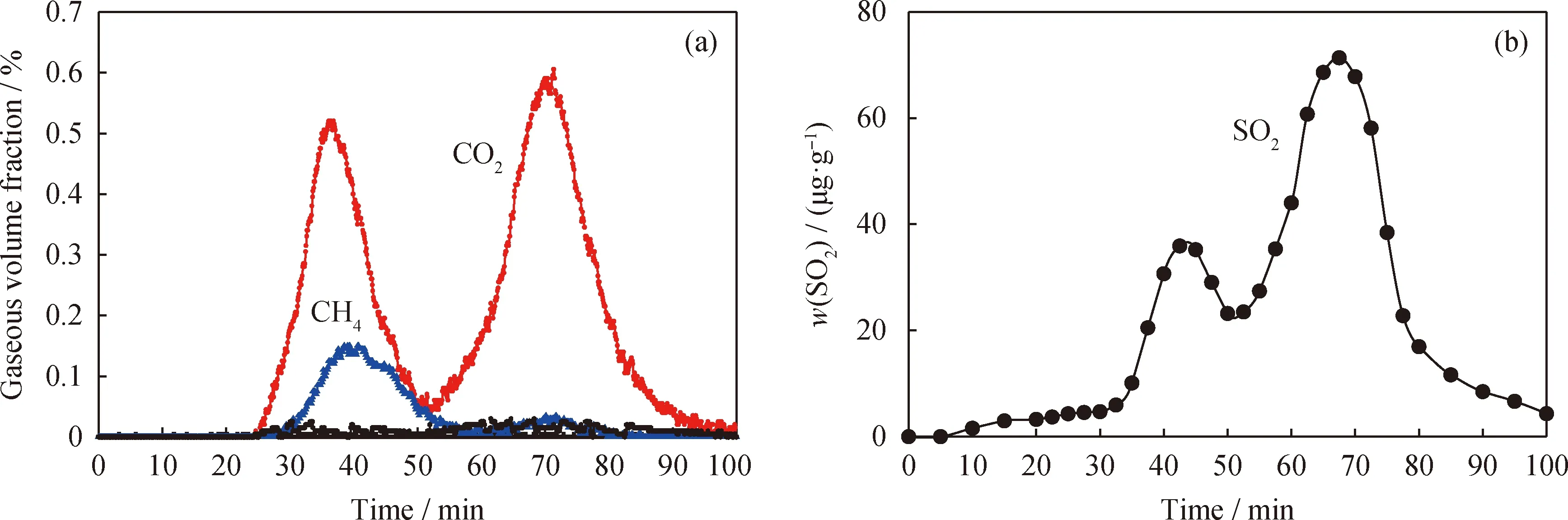
图2 LZ+CuFe2O4程序升温CLPOU阶段气相产物释放曲线Fig.2 Gaseous products release curves of LZ+CuFe2O4 during CLPOU process(a) Conventional gas; (b) Trace gaseous sulfur Reaction conditions: α=1; N2 atmosphere
3CuFe2O4+4CO→3Cu+2Fe3O4+4CO2
(6)
3CuFe2O4+4H2→3Cu+2Fe3O4+4H2O
(7)
3CuFe2O4+CH4→
3Cu+2Fe3O4+CO2+2H2O
(8)
从图2(b)可以看出,程序升温过程中,释放的气相硫组分仅有SO2。SO2在300 ℃的较低温度下开始释放,随着温度的升高,分别在625 ℃和 875 ℃ 时达到2个释放峰值,且875 ℃时的SO2形成及释放浓度更大。程序升温初期产生的少量SO2可能来源于煤和CuFe2O4载氧体微孔中的吸附氧与煤中少量热稳定较差的脂肪族硫化物反应[16]。625 ℃ 时释放SO2主要由LZ煤中黄铁矿硫歧化热解释放的H2S与CuFe2O4载氧体反应产生,其反应如式(9)所示。在局部高浓度H2S气氛下,SO2还可能通过式(10)所示的路径产生。同时,由于Cu基载氧体与硫具有较好的结合性[17],在此路径下还会生成部分金属硫化物Cu2S。
9CuFe2O4+4H2S→
9Cu+6Fe3O4+4SO2+4H2O
(9)
9CuFe2O4+7H2S→
4.5Cu2S+6Fe3O4+2.5SO2+7H2O
(10)
随着温度的逐渐升高,载氧体的反应活性进一步提高,在875 ℃的较高温度下,SO2释放达到了最大峰值。结合相关文献[7],高温下SO2的释放来源可能包括:1)高温下载氧体与含硫半焦反应释放出的SO2,由于煤热解过程中存在硫向半焦中富集的现象[18],因而高温下释放的SO2明显大于低温下的;2)CuFe2O4载氧体在高温下具有氧解耦特性,形成的局部微氧气氛有助于煤分子结构中C—S键的断裂,促进残余焦炭中的有机硫转化为SO2[19];3)参考Gayan等[20]对Cu基载氧体的相关研究,低温下经式(10)生成的Cu2S还可能在高温下与CuFe2O4发生式(11)所示的固-固反应,释放出SO2。
2Cu2S+3CuFe2O4→7Cu+2Fe3O4+2SO2
(11)
2.2 LZ煤与CuFe2O4载氧体等温实验
基于程序升温研究结果,为在更接近实际工况下研究LZ高硫煤与CuFe2O4载氧体反应特性,采用等温实验形式,系统考察了反应温度、CuFe2O4载氧体过量系数及CO2反应气氛对LZ煤化学链燃烧性能的影响。
2.2.1 反应温度的影响
首先,对CuFe2O4载氧体与LZ煤进行CLPOU反应时不同还原温度的影响加以研究,如图3所示。由图3(a)可见,CuFe2O4载氧体在高温下快速释放出O2,部分未与煤反应的O2在载气N2的吹扫下,逸出反应器。在反应初期,由于煤热解而释放的CH4未被充分氧化,部分CH4随N2逸出反应器。随着反应温度从800 ℃逐渐升至950 ℃,CuFe2O4载氧体的反应活性逐渐提高,先后与煤热解而释放的挥发分和残余半焦反应,生成CO2。由于LZ煤为典型烟煤,挥发分快速反应生成CO2,而残余焦炭的氧化较为缓慢。升高温度有助于CuFe2O4直接分解释放出O2,从而促进了LZ煤热解残焦的氧化燃烧。当反应温度由800 ℃升至 950 ℃ 时,LZ煤热解产生的挥发分及残余半焦与CuFe2O4反应的主要气相产物CO2尾部曲线延迟有效减少,说明高温促进了LZ煤的充分反应。但是需要注意的是,尽管提高反应温度有助于煤的转化,但过高的温度容易导致载氧体团聚烧结,并在实际的工业化应用中出现“脱流态化”的问题[21]。进一步,基于图3(a)中LZ与CuFe2O4在不同温度下反应产生气体的体积分布,由公式(2)及(4)可以计算出LZ煤不同反应温度下碳转化率及反应尾气中CO2气体体积产率,如图3(b)所示。由图3(b)可见,随着反应温度增加,LZ煤碳转化率显著增加,相应的尾气中CO2体积产率也会明显增加。这对于反应尾气中CO2的捕集是有利的。
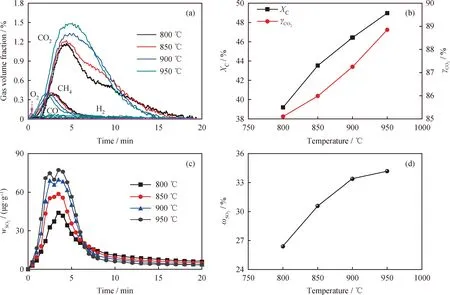
图3 反应温度对LZ+CuFe2O4等温反应碳转化及硫释放的影响Fig.3 Effects of temperatures on the carbon transformation and sulfur release for LZ+CuFe2O4(a) Conventional gas release curve; (b) Carbon conversion (XC) and CO2 yield (γCO2);(c) Trace sulfur release curve; (d) Sulfur release rate (ωSO2)Reaction conditions: α=1; N2 atmosphere
在LZ煤等温CLPOU过程的尾气中,气相硫仅为SO2,未发现H2S、COS、CS2等成分。这与文献[7]的结论是一致的,说明CuFe2O4载氧体具有较高的反应活性,与LZ煤反应时能提供更多的晶格氧,使煤中各种硫组分近完全氧化成了气相SO2。SO2的释放主要集中在前6 min,之后SO2释放缓慢,且浓度较低(图3(c))。在反应的前6 min,SO2的释放可分为2个阶段。在第一个阶段(0~3 min),含黄铁矿硫的LZ煤快速热解,释放出H2S、COS、CS2等多种气相硫组分,其被CuFe2O4载氧体进一步氧化为SO2,反应如式(9)、(12)和(13)。而当局部H2S、COS、CS2等气相硫浓度较高时,CuFe2O4不能充分将其氧化为SO2,由于铜具有的良好固硫效果,部分气相硫组分会以固相Cu2S的形式存在,反应如式(10)、(14)和(15)所示。随着温度升高,CuFe2O4载氧体的反应活性提高,能有效促进气相硫化物H2S、COS、CS2的氧化,SO2释放峰值逐渐升高,减少了气相硫化物向固相硫的转化。第二阶段(3~6 min)释放的SO2可能来源于:1)CuFe2O4载氧体对煤中残余黄铁矿(FeS2)的氧化,反应如式(16)和式(17)所示;2)煤中有机硫(LZ煤中原生有机硫和热解过程中新形成的有机硫)的氧化;3)CuFe2O4载氧体与金属硫化物的氧化反应,如式(11)所示。与第一阶段的SO2释放类似,升高温度将促进第二阶段气相SO2的释放[22]。
根据图3(c)中气相SO2的释放曲线,由公式(5)可以计算出不同反应温度下反应产生SO2占LZ煤中总硫的质量分数(图3(d))。由图3(d)可知,随着反应温度升高,LZ煤中有更多的S组分转化成气相SO2而释出。因此,尽管反应温度升高有利于LZ煤的碳转化,但也会导致更多气相SO2释放,不利于CO2的分离捕集。因此,对于高硫煤的化学链燃烧,反应温度的选择需要综合考虑。
9CuFe2O4+4COS→9Cu+6Fe3O4+4SO2+4CO2
(12)
9CuFe2O4+2CS2→9Cu+6Fe3O4+4SO2+2CO2
(13)
9CuFe2O4+7COS→4.5Cu2S+
6Fe3O4+2.5SO2+7CO2
(14)
9CuFe2O4+3.5CS2→4.5Cu2S+
6Fe3O4+2.5SO2+3.5CO2
(15)
2CuFe2O4+4FeS2→Cu2S+Fe3O4+5FeS+2SO2
(16)
2CuFe2O4+3FeS2→2Cu+Fe3O4+4FeS+2SO2
(17)
2.2.2 载氧体过量系数α的影响
基于载氧体过量系数α,在反应温度为900 ℃、N2气氛下,研究了载氧体添加量对LZ煤等温CLOPU过程中碳、硫组分释放的影响,结果如图4。
从图4(a)可以看出,随着α的增加,LZ煤热解产物与CuFe2O4载氧体在0~5 min初始反应阶段的碳转化速率并未明显提高。而在反应进行到 5 min 后,当LZ煤焦被CuFe2O4载氧体氧化时,提高载氧体添加量则对其具有明显的促进作用。随着α的逐渐增加,由图4(b)可知,LZ煤的碳转化率、转化速率及CO2产率均大幅提高;当α为2.5时,几乎实现了LZ煤中碳组分的完全转化。但在实际工业化应用中,单纯提高载氧体的量会造成载氧体的极大浪费,并增加系统的初始投资成本和后期运行费用[23]。考虑到当α大于1.5时,如图4(b)所示,CO2产率的增速较小,说明通过单纯增加载氧体加入量来提高CO2产率的作用已趋缓。因此,从系统经济性和能源利用的角度分析,载氧体过量系数α取1.5较为合适。
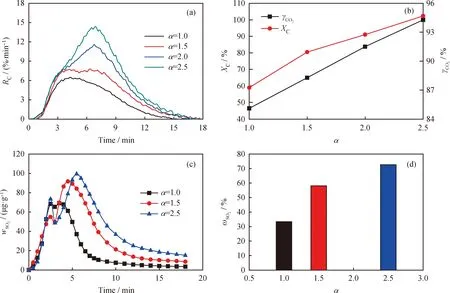
图4 载氧体过量系数α对LZ+CuFe2O4等温反应碳转化及硫释放的影响Fig.4 Effects of the OC excess number α on the carbon conversion and sulfur release for LZ+CuFe2O4(a) Conventional gas release curve; (b) Carbon conversion (XC) and CO2 yield (γCO2);(c) Trace sulfur release curve; (d) Sulfur release rate (ωSO2)Reaction conditions: T=900 ℃; N2 atmosphere
LZ煤SO2的释放曲线存在2个释放峰值,见图4(c)。第一个释放峰归属于气相硫H2S、COS与CuFe2O4的反应,随着α值从1增至2.5, SO2释放的第一峰峰值先降低后升高。这可能是由于当α值较小时,随着载氧体比例的增加,其Cu基氧化物的固硫效果也增强[24],有助于将LZ煤热解产生的气相硫化物固定为金属硫化物;而当α值进一步增大,CuFe2O4载氧体过量,气相硫化物被直接氧化为SO2[25],因而释放增多。
第二个SO2释放峰,主要是CuFe2O4载氧体与黄铁矿硫或第一阶段形成的金属硫化物发生固-固反应。从图4(c)和(d)可以看出,载氧体添加比例对第二阶段的SO2释放量具有显著影响[9]。随着α值的增大,过量的CuFe2O4载氧体加速了黄铁矿硫或金属硫化物的氧化,使单位质量煤的硫释放量显著增加。值得注意的是,即使在α=2.5时,CuFe2O4载氧体也不能保证煤中硫以气相SO2的形式完全转化。
2.2.3 CO2反应气氛的影响
在实际煤化学链燃烧过程中,煤及载氧体的反应主要在较高CO2反应浓度下进行。因此,在α=1.0、900 ℃、40%CO2/60%N2的条件下,进一步探索了较高CO2浓度对煤中气相硫组分释放的影响。LZ煤等温热解和等温CLPOU过程中气相SO2的释放曲线如图5所示。
由图5(a)可以发现:反应初期,COS快速释放,其主要来自热解产物CO与黄铁矿硫发生气-固反应或与黄铁矿硫歧化热解产生的活性硫结合;随着反应的进行,在40%CO2/60%N2气氛下,残余焦炭继续气化生成CO。进而生成COS,一直持续到反应后期。另外,热解初期产生的SO2主要来于硫酸盐硫的分解,而反应后期SO2的释放增多,主要是因为煤中的硫在CO2气氛下会进一步分解。
添加定量CuFe2O4载氧体后,反应初期的SO2释放与100% N2气氛下基本相同,说明CO2的加入并未影响LZ煤热解气相硫化物与CuFe2O4的反应。而随着反应的进行,SO2的第二个释放峰峰值显著降低,如图5(b)所示。其原因可能是外加CO2促进了煤中碳基质的高温气化,形成的气化产物CO优先与CuFe2O4反应,降低了煤中残余黄铁矿硫和有机硫的氧化。同时,载氧体生成的还原态Cu与H2S结合形成金属硫化物,抑制了SO2的产生。反应后期,相比于100% N2气氛,40%CO2/60%N2气氛下的SO2释放浓度略高。这是因为:一方面,CO2气氛可以促进煤中C—S键断裂,有利于LZ煤中有机硫的转化成SO2[26];另一方面,CuFe2O4载氧体会与煤中残余黄铁矿硫及金属硫化物反应,释放出少量SO2。
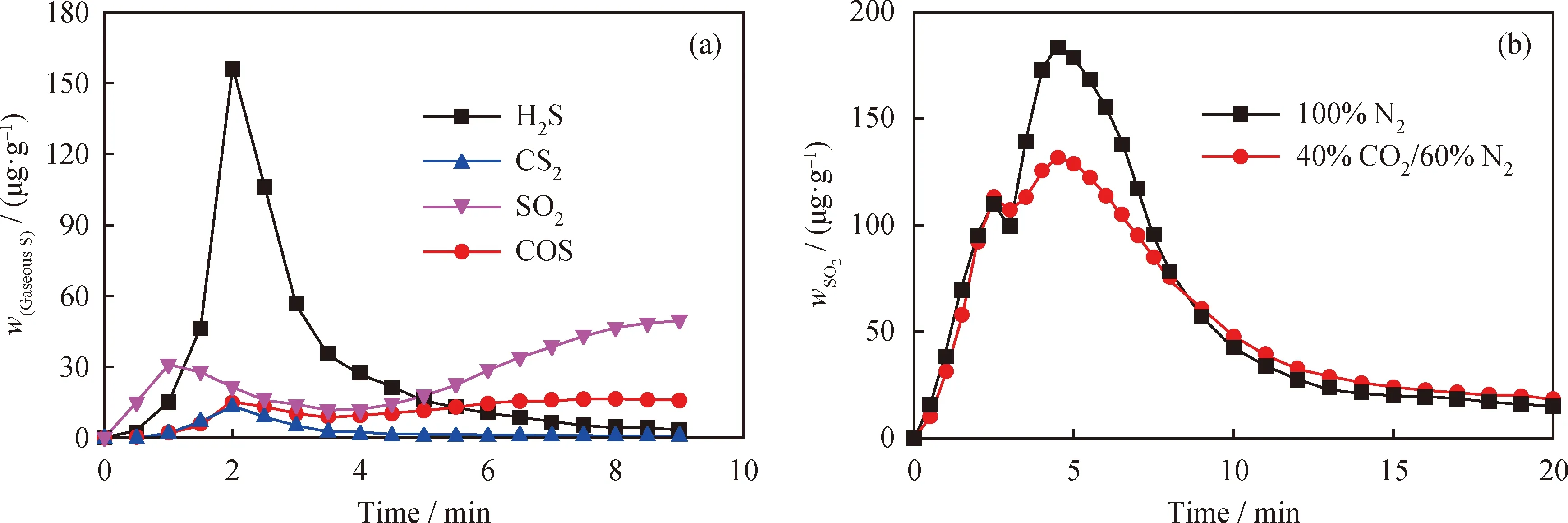
图5 CO2气氛对LZ热解及LZ+CuFe2O4中气相硫释放的影响Fig.5 Effects of the CO2 atmosphere on the LZ pyrolysis and sulfur release in LZ+CuFe2O4(a) LZ pyrolysis; (b) LZ+CuFe2O4 Reaction conditions:α=1.0; T=900 ℃; 40%CO2/60%N2 atmosphere
2.3 固相产物表征
采用XRD、FESEM-EDX、XPS等多种表征技术,对固相产物的物相组成、微观形貌和价态变化进行了深入研究。图6为α为1和1.5时LZ煤与CuFe2O4载氧体固相产物的XRD物相组成分析。由图6可知,LZ煤与CuFe2O4载氧体固相反应的主要产物为Fe3O4和Cu,还有部分CuFeO2和Fe2O3。这主要是由于CuFe2O4在等温CLPOU反应过程中首先受热分解为CuFeO2、Fe2O3,并释放出部分O2与LZ煤反应[27];随后中间产物CuFeO2及Fe2O3进一步与煤热解产物及残余半焦反应,被还原为Cu和Fe3O4[28]。当载氧体过量系数α从1提高至1.5时,未反应的CuFeO2及Fe2O3等中间产物的衍射峰强相对升高。
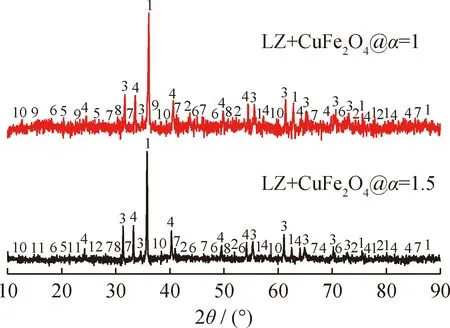
图6 不同α时LZ+CuFe2O4固相反应产物的XRD图谱Fig.6 XRD patterns of LZ+CuFe2O4 solid products with different α values Reaction conditions: T=900 ℃; N2 atmosphere
此外,在LZ原煤与CuFe2O4载氧体固相反应产物中检测到金属硫化物,包括Cu2S、黄铁矿FeS2及其热解产物FeS等。其中,Cu2S主要来源于载氧体还原Cu与H2S的结合。当α为1.5时,载氧体过量,固体产物检测到硫酸盐(FeSO4、CaSO4等),FeSO4可能由黄铁矿及其热解产物的氧化而来,而CaSO4则来源于CaO与SO2的氧化反应。除上述主要固相产物外,LZ煤中存在的Si、Al等矿物质组分(如SiO2、KAlSi3O8)及其与活性组分进一步结合形成的硅酸盐(如Fe2SiO4)同样值得关注。
这些低熔点的惰性物质可能对系统的长期运行造成不良影响。
图7为LZ煤+CuFe2O4载氧体固相反应产物的SEM微观形貌。从图7可以看出,经过900 ℃的等温CLPOU反应,固相产物表面仍具有较为丰富的孔隙结构,没有出现明显的烧结及团聚现象。进一步,采用能谱仪对图7上随机选取的点(点1和点2)的元素浓度进行测试,结果如表3所示。从表3可见,LZ+CuFe2O4还原产物的随机点上的C原子分数分别为17.24%和16.80%,说明反应后有一定的焦炭残余。同时,点2上Cu原子浓度高于点1上的,说明反应后还原的Cu单质原子有一定程度的界面迁移。相对于Cu,Fe的抗烧结性能更强,因而两点上Fe原子浓度差异不大。另外,两个点上有O原子,且原子分数高于40%的残余,说明还原载氧体中的氧未能充分利用。至于Si、Al、Ca原子在两个点上浓度差异较大,说明化学链燃烧后煤中典型Si、Al、Ca等矿物质分布呈离散性。固相中的S元素在两点上的浓度值都很小,说明LZ煤与CuFe2O4载氧体固相产物中含硫固相产物较少。

图7 LZ煤+CuFe2O4载氧体固相反应产物的微观形貌Fig.7 Micro-morphology of solid products of LZ+CueroReaction conditions: α=1.0; T=900 ℃; N2 atmosphere
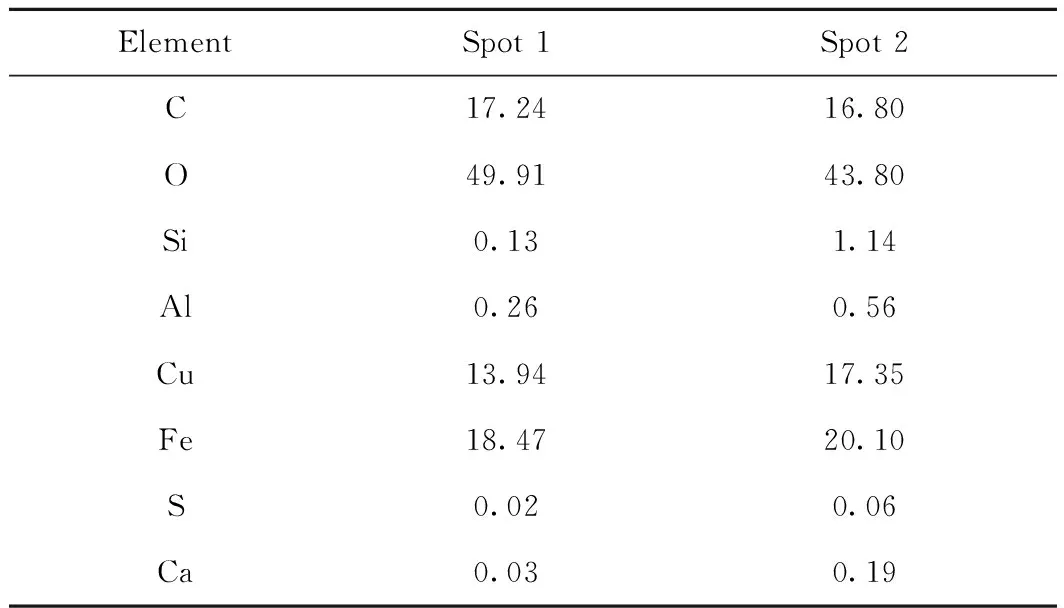
表3 固相反应产物的原子分布Table 3 Atom distribution of solid products c/%
进一步采用XPS对LZ煤与CuFe2O4载氧体反应固相产物中的各类含碳官能团及硫组分加以研究,结果如图8所示。结合图8(a)中对C 1s的分峰拟合,固相产物中含碳官能团以残余的碳基质以及热稳定性较高的脂肪族或芳香族碳基官能团(C—C/C—H)为主,因此使得LZ煤的碳转化率低,煤中碳组分难以充分利用和高效转化[15]。而对于样品中S元素,随机点上测得的浓度较低,结合XRD及图8(b) XPS图谱,固相反应产物中硫的主要赋存形态为FeS、FeS2及Cu2S为代表的无机硫化物,脂肪族有机硫、噻吩硫、砜及亚砜在内的有机硫,还有部分硫酸盐硫(FeSO4、CaSO4及中间产物CaSO3)。
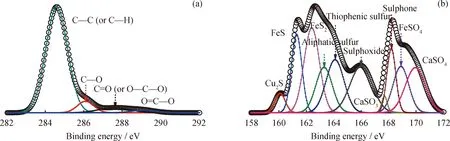
图8 LZ煤+CuFe2O4载氧体固相反应产物的XPS图谱Fig.8 XPS spectrums of solid product of LZ+CuFe2O4(a) C 1s; (b) S 2p Reaction conditions: α=1.0; T=900 ℃; N2 atmosphere
综上,不同运行参数下的气、固相硫演化分布结果表明,在保证系统经济运行的前提下,高活性的CuFe2O4载氧体难以保证煤中的硫充分转化为气相SO2的形式释出,总会有一定的固相硫化物组分形成,被携带进入空气反应器中,氧化后与残余空气一并排放,对环境造成一定的危害。而得益于Cu基氧化物和还原Cu单质与硫具有较大的结合势能,通过优化运行参数,可以将煤中的硫定向转化为固相金属硫化物Cu2S,则有望实现煤化学链燃烧过程中碳、硫组分的协同在线控制。
3 结 论
考察了六枝煤与CuFe2O4复合载氧体在部分氧解耦化学链燃烧(CLPOU)过程的反应特性及反应温度、载氧体量、CO2气氛对硫迁移转化的影响。主要结论如下:
(1)在LZ煤与CuFe2O4载氧体的程序升温实验及等温实验中,反应器出口干烟气以CO2为主,气相硫主要为SO2,而固相硫则以Cu2S为主。
(2)提高反应温度和载氧体添加量会促进煤中硫的氧化,使气相SO2的释放量增加;而CO2气氛在一定程度上可以抑制SO2的产生。
(3)鉴于复合载氧体的高反应活性及Cu基氧化物和还原Cu的良好固硫特性,CuFe2O4载氧体有望实现煤化学链燃烧过程中碳、硫组分的协同在线控制。
