老年男性肌少症严重程度与肺功能及活动耐量的相关性探讨
2020-03-03赵婷周伊南李敏静葛晓晓葛海燕朱迎钢李向阳
赵婷,周伊南,李敏静,葛晓晓,葛海燕,朱迎钢,李向阳
复旦大学附属华东医院呼吸与危重症医学科,上海200040
慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)是我国城镇居民死亡的主要原因之一。根据最新流行病学资料显示,我国COPD的整体患病率为8.6% [1],40 岁以上人群的患病率达13.6%,男性发病率(19.0%)高于女性(8.1%)[2]。由于COPD 早期起病隐匿,临床症状不典型,只有约12%的COPD 患者曾经做过肺功能测试[1],绝大部分患者对于肺功能监测及活动耐量变化的认知严重不足。
研究表明,早期肌肉功能下降与活动减少有关,肌肉消耗可进一步降低身体活动能力、运动耐力和生活质量,并且是导致肺功能下降的一个重要危险因素。最新国际工作组将失去肌肉质量和力量并伴有功能障碍和临床不良结局[3]的综合征称为肌肉减少症(sarcopenia)。有文献报道,肌少症与非肌少症患者相比跌倒或死亡风险高3 倍,且肌少症本身可导致致残率和住院风险升高[4],截至目前关于肌少症与肺功能下降的相关性尚未完全阐明。
肌少症患者血清中存在多种炎症因子水平升高,且高水平的炎症因子与肌肉力量和质量呈负相关[5]。老年男性作为COPD 发病的高危人群,探讨此类人群的肌少症程度与肺功能及活动耐量下降的相关性具有重要临床意义。
本研究拟通过比较老年男性肌少症中的肺功能及活动耐量水平差异,明确肌少症的严重程度与肺功能减退及COPD 发病的相关性,并进一步分析血清炎症细胞因子水平在评价肺功能及活动耐量下降程度中的价值,为早期发现高危人群中COPD 患者提供理论依据。
1 资料与方法
1.1 基本情况 研究共纳入2018年8月—2019年5月间复旦大学附属华东医院呼吸科住院符合肌少症诊断标准的男性患者共46 例,年龄60~89 岁,平均(80.2±8.8)岁。COPD 诊断符合GOLD2016 推荐的诊断标准的稳定期COPD 患者,基线内容包括一般情况,身高体重测定并测算体质量指数(BMI)、疾病家族史、既往史、烟酒嗜好、药物服用史等。
1.2 方法 肌少症诊断方法:(1)肌肉质量测量:应用双能X 线骨密度吸收仪(dual energy X-ray absorptiometry,DXA)进行患者全身体成分分析得出其四肢骨骼肌量,四肢骨骼肌指数(SMI,kg/m2)=四肢骨骼肌质量(kg)/身高(m2);(2)握力测量:采用CARMY EH101 型号握力计分别测量左右手握力,重复并记录最大值(3)所有患者完成6 min 行走试验,记录步行速度最大值。
1.3 纳入与排除标准 研究对象需符合以下所有纳入标准并签署知情同意书。(1)年龄≥60 岁;(2)符合肌少症的诊断标准:亚洲肌少症工作组专家共识将SMI 设为:男性<7.0 kg/m2,女性<5.7 kg/m2;亚洲肌少症工作组将优势手握力设为男性<26 kg,女性<18 kg;患者步速小于0.8 m/s 定位行走能力减退,以上符合第1 条及后两条中任意1 条,即符合肌少症诊断;(3)能配合完成相关检查,具备基本沟通理解能力。排除标准:(1)近期发热或急性感染性疾病患者;(2)严重心、肺、肾、脑疾病,预期无法完成步速检测等骨折长期卧床患者;(3)未控制的严重内分泌疾病,自身免疫疾病及精神病患者。本研究通过复旦大学附属华东医院伦理审批(2019K125)并取得患者知情同意。
1.4 肺功能检测 所有入组患者的肺功能检测采用MasterScreen PFT System 系统(Jager,Germany)。检测项目包括第1 s 用力呼气容积(FEV1),用力肺活量(FVC),并计算统计FEV1 占预计值的百分比(FEV1%pred)和FEV1 占FVC 的百分比(FEV1/FVC)。
1.5 活动耐量评估 (1)COPD 评估测试(COPD assessment test,CAT)问卷[6]:共包括8 个问题(咳嗽、咳痰、胸闷、爬坡或上一层楼梯的感觉、家务活动、离家外出信心程度、睡眠和精力)。每个问题从轻到重依次为0~5 分,CAT 分值范围是0~40 分。根据得分划分为“轻微影响”,“中等影响”,“严重影响”及“非常严重影响”。由研究者讲述问卷评分方法后由患者独立完成问卷;(2)改良英国MRC 呼吸困难指数量表(mMRC)[7] 为目前临床应用广泛的呼吸困难评估表,主要分为0~6 级,级数越高,呼吸困难越严重。
1.6 血清炎症因子及相关指标检测 抽取清晨空腹肘静脉血5 mL,分离血浆取上清液,采用酶联免疫吸附剂测定(ELISA)法(试剂盒Arigo ELISA KIT,批号05109442)检测血清白介素2(IL-2)、白介素4(IL-4)、白介素6(IL-6)、白介素8(IL-8)含量、血清白蛋白(ALCYON300 雅培生化分析仪及生化试剂)及血红蛋白水平(Hb)(XN-20 血液分析仪及原装配套试剂,日本Sysmex 公司)。
1.7 统计学分析 采用SPSS 22.0 软件进行数据处理。计量资料中呈正态分布者以均数±标准差(±s)表示,组间比较采用t 检验或方差分析;呈偏态分布者以中位数和四分位数间距[M(Q1,Q3)] 表示。参数相关性分析采用Pearson 分析法,非参数相关性分析采用Spearman 分析法。检测指标与肺功能FEV1 的回归分析采用线性回归分析。P<0.05 为差异具有统计学意义。
2 结果
2.1 患者一般资料 46 例老年男性患者的一般资料及指标结果见表1。其中住院的首要诊断包括:COPD肺康复治疗22 例(48%),发现肺小结节10 例(22%),房性早搏7 例(15%),头晕和眩晕7 例(15%)。

表1 患者一般资料表
2.2 SMI 与肺功能及炎症因子水平的相关性分析 通过相关分析发现,SMI 与肺功能指标(FEV1/FVC 以及FEV1)、CAT、mMRC、IL-6 及骨矿含量(BMC)呈中等程度相关(P<0.01);同时发现,FEV1 与IL-8水平亦呈负相关(r=-0.34,P=0.032)。见表2。
2.3 检测指标与肺功能FEV1 的回归分析 BMC、CAT、IL-6、IL-8、SMI 等指标与肺功能指标(FEV1)之间存在正相关(r=0.841,P<0.001)。进一步分析发现,CAT 评分、IL-8 与 FEV1 呈负相关(r 值分别为-0.545,-0.266,P<0.05),SMI 与FEV1 呈正相关(r=0.276,P<0.05)提示CAT 评分越高、IL-8 越高且SMI 越低时,预示FEV1 越低;反之,CAT 评分越低、IL-8 越低且SMI 越高时,预示FEV1 越高(P<0.05),见表3。
3 讨论
尽管已有国外研究报道[8-9],在COPD 患者中体重丢失越严重,GOLD 分级以及FEV1 下降的严重程度越重,但是有关低骨骼肌指数与所有老年男性人群肺功能减退的相关性资料尚为空白。本研究以双源X 线DXA 金标准测试的SMI 为基础,发现SMI 与FEV1 下降呈高度相关,进一步证实SMI 与FEV1 的相关性不仅存在于COPD 患者中,甚至在无症状或无基础肺病老年人中,骨骼肌减退与肺功能下降亦存在一定相关性。推测其原因主要是由于上肢肌力与肺最大吸气呼气压有关,有报道显示呼气肌功能锻炼能明显增加呼气峰流速,增加肺活量,由于骨骼肌衰退患者呼吸肌力量减退,肺部吸气及呼气力度下降,肺功能下降,造成FVC 及FEV1 数值下降。此外,全身炎症反应增强也可能参与骨骼肌衰退的发生机制[10],受此影响肺弹性回缩及膨胀受限,最终引起肺容量及FEV1 下降,由于在COPD 患者中骨骼肌衰退是一项预后不良的独立预测因子,本研究进一步为骨骼肌衰退是否可作为老年男性肺功能下降的预测随访指标提供依据。
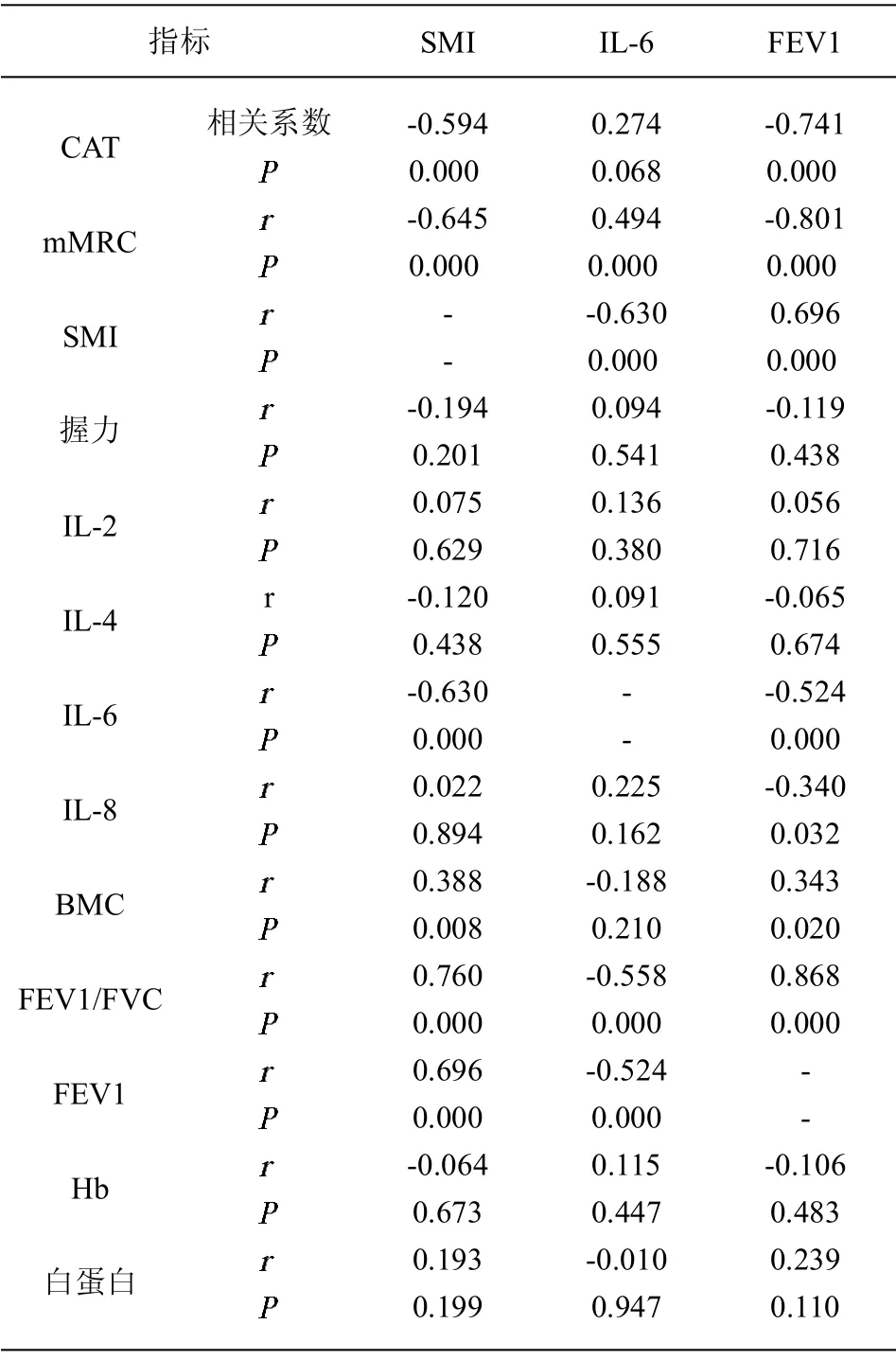
表2 四肢骨骼肌指数与相关因素的相关分析表
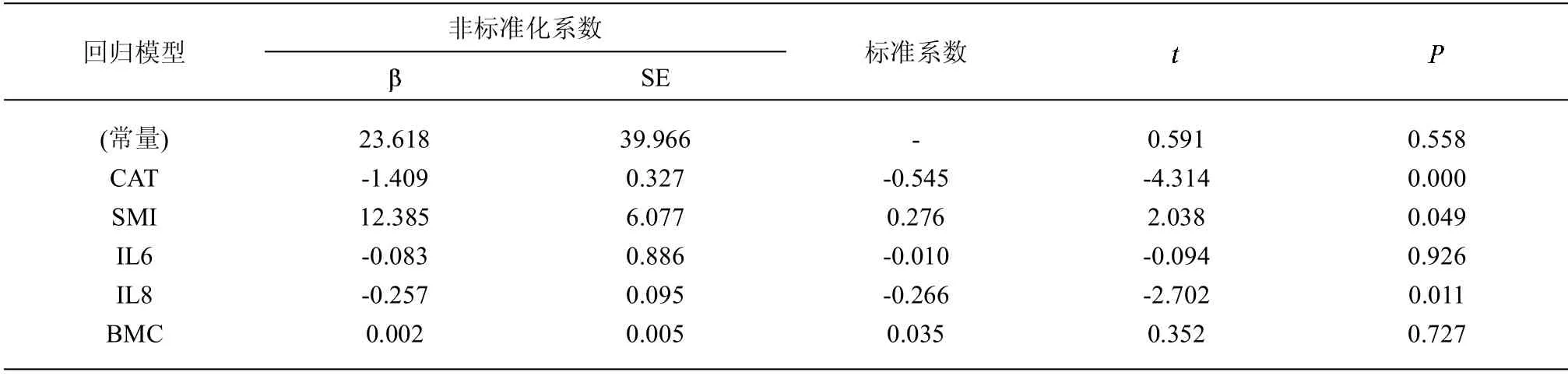
表3 肺功能FEV1 的回归分析
CAT 及mMRC 评分是临床上有效的评估老年患者活动耐量的指标,在COPD 患者中应用广泛,可用于预测COPD 患者发病率与生存率,但目前认为该类指标与6 min 步行试验类似,与老年人日常生活能力及肺功能结果高度相关[11]。本研究结果发现CAT及mMRC 评分与老年男性人群的SMI 存在一定相关性,相关系数中度相关,肌少患者SMI 越低,CAT 评分及mMRC 分级越高,提示活动耐量越差。通常认为,肌肉组织随年龄增长及激素水平下降而逐渐萎缩,肌肉功能的减退不仅对呼吸功能造成影响,还会引起一系列变化包括体重丢失、营养不良、增加心血管疾病发作风险、激素代谢紊乱、骨质疏松、焦虑及抑郁症等,从而全面影响生活质量[12]。本研究提示SMI可以作为临床上老年患者,尤其是老年男性肌少症患者的整体生活质量及生存率的重要参考指标。
近年来炎症介质,尤其是IL-6 在肌少症中的作用逐渐被重视,有研究报告,机体氧化应激和炎症介质水平升高可能参与了肌少症发病机制。本研究结果发现,SMI 与IL-6 变化水平密切相关,提示在临床上可以结合血清IL-6 水平这一量化指标对患者肌肉衰弱程度进行评估和对比。分析原因可能与随年龄增加,体内产生慢性低水平炎症反应有关,已有文献提示低水平炎症反应在肌少症疾病进展中发挥极其重要的作用,炎症反应水平随细胞衰老和器官功能退化而逐渐升高,促炎因子如IL-6 的水平增高可达2~4 倍[13]。体内高水平的IL-6 与骨骼肌肌量及肌力下降有关,可造成老年衰弱等多种临床不良事件及结局的发生[14],与Cesari 等[15] 的调查结果一致。已有多个体外实验证实炎症细胞因子可通过调节碳水化合物和脂质代谢,增加卫星细胞增殖直接造成局部骨骼肌功能减退,导致肌肉量下降,分析其发生可能的机制为炎症因子抑制肌肉蛋白质合成,加速蛋白质分解,并上调肌肉生长抑制素和肌肉萎缩蛋白的表达[16],体内注入IL-6的肌肉中观察到的变化表明生长因子如IGF-1 相关信号传导的平衡发生改变,会影响肌原纤维蛋白合成,加速骨骼肌萎缩[17]。
通过回归分析发现,IL-8 水平与肺功能结果呈负相关,IL-8 越高则预示FEV1 越低,肺功能下降程度越严重。已有文献发现IL-8 与COPD 关系密切,与稳定期相比,COPD 急性加重期的IL-8 水平明显升高;且COPD 患者肺泡巨噬细胞释放的IL-8 不仅与FEV1/FVC 呈负相关,且与50%用力肺活量时最大呼气流量(V50)、25%用力肺活量时最大呼气流量(V25)等反映小气道功能的数个指标密切相关,被认为是肺功能下降的重要影响因素[18-19]。本研究结果补充验证了IL-8 在判断老年男性肌少症人群肺功能预后中的应用价值。考虑到IL-6 及IL-8 等水平通常在急性炎症性感染以及COPD 急性加重期明显升高,为了避免偏倚,本研究收集处于COPD 稳定期的患者,肺康复比例48%,但事实上仍有可能存在COPD 患者合并慢性结构性肺病(如支气管扩张等)导致慢性持续性炎症存在,从而影响IL-6 及IL-8 水平。后续试验将进一步对患者随访观察相关炎症指标的动态变化。
综上所述,我们发现在老年男性人群中,SMI 与肺功能指标(FEV1/FVC 以及FEV1)、生活质量评分(CAT 及mMRC)及炎症因子(IL-6)呈高度相关。低骨骼肌指数可作为筛查阻塞性气流受限人群的有效指标,在评价肺功能及生活质量下降严重程度以及判断患者预后中可产生一定的临床价值,为识别COPD高危因素患者奠定了理论基础。
本研究作为探索性研究,存在一定局限型,首先,目前获取的样本量较小,在评价SMI 与肺功能或炎症因子等指标的相关性判读上可能仍存在一定偏移,考虑到有限的病例数,后续试验将进一步增加入组病例数并对不同严重程度COPD 患者、年龄等因素进行亚组分析。其次,老年男性患者常可合并多种慢性基础疾病,老年患者个体差异性极大,可能会对患者肺功能的发展预后产生不同程度的影响,本研究对肌少症主客观指标进行了分析发现其一定的相关性,将来通过康复锻炼等干预手段改善肌少症能否对老年COPD患者预后生存产生影响还需要今后更大样本的临床研究来验证,最终为临床治疗方案调整提供更可靠的依据。
