IGF-1对2,5-己二酮诱导的骨髓间充质干细胞凋亡的拮抗作用研究
2020-03-02白秋芳张继志朴丰源
白秋芳,邹 明,张继志,刘 卓,朴丰源
(1. 大连大学附属中山医院 药剂科,辽宁 大连 116001;2. 大连大学附属中山医院 神经外科,辽宁 大连 116001;3. 锦州医科大学 基础医学实验中心机能学实验平台,辽宁 锦州 121001;4. 大连大学附属中山医院 中心实验室, 辽宁 大连 116001)
骨髓间充质干细胞(BMSCs)是一种来源于骨髓间充质的多能干细胞,在特定条件下可分化为多种细胞系,因此可以成为替代体内受损组织的细胞来源[1-3]。据报道,BMSCs移植可用于治疗糖尿病性周围神经病变[4],并具有促进受损脊髓功能恢复[5],改善梗死后心功能[6]以及修复肾脏损伤[7]等功效。但在实践应用中,BMSCs在机体内的嫁接效率始终不高,只有小部分移植的BMSCs能够在受损的宿主组织中存活[8],大部分干细胞在移植后第1周内就会死亡[9-10],这严重影响到了干细胞治疗的作用时间,并极大地限制了BMSCs移植疗法的应用和推广[11]。研究提示,细胞凋亡是导致移植BMSCs死亡的主要原因[12]。因此,找寻提高BMSCs存活率和/或减少凋亡的方法可能会大大提高BMSCs移植的疗效。
研究发现,通过给予保护剂可增强干细胞在宿主环境中的抵抗力,提高移植细胞的存活[9,13]。胰岛素样生长因子-1(IGF-1)属于多肽类生长因子,在细胞存活和增殖中起着重要作用[14-16]。体外研究表明,IGF-1可抑制运动神经元的凋亡[17]。Yan等[18]报道,IGF-1可保护来源于大鼠坐骨神经组织的雪旺细胞,避免高糖所致的细胞凋亡。Liao等[19]的研究发现,IGF-1可保护人视网膜色素上皮细胞免受胺碘酮诱导的凋亡。Gooch等[20]研究表明,IGF-1可保护MCF-7细胞免受化疗药物阿霉素的促凋亡影响。以上这些研究表明,IGF-1具有抗细胞凋亡的作用。由此,IGF-1对BMSCs凋亡的拮抗作用及其相关机制,引发了我们的关注。
本研究应用2,5-己二酮(HD)作凋亡诱导剂,构建BMSCs凋亡体外模型;应用TUNEL法检测BMSCs的凋亡;应用试剂盒检测caspase-3活性;应用western blot技术检测了Akt和Bad的表达及其磷酸化水平;拟探讨IGF-1对HD诱导所致的BMSCs凋亡的拮抗作用及相关机制,为筛选增强移植BMSCs在宿主体内存活的有效保护剂提供理论依据。
1 材料和方法
1.1 材 料
药物及试剂:HD(Sigma,美国,纯度≥ 99%);p-Akt/Akt抗体(cell signaling,美国);p-Bad/Bad抗体(cell signaling,美国);β-actin抗体(中杉金桥);TUNEL检测试剂盒(KeyGEN BioTECH,中国);caspase-3活性试剂盒(Beyotime,中国)。
1.2 实验方法
1.2.1 大鼠骨髓间充质干细胞(BMSCs)的培养:选取出生2~3周的健康SD大鼠幼鼠,脱臼处死。无菌条件下取出幼鼠的股骨和胫骨,用无菌PBS缓冲液冲洗并收集骨髓,经70 μm滤网过滤后,1000 r/min离心3 min,弃上清。在低糖BMSCs培养基中重悬细胞,并将细胞悬液转移至培养皿中。37 ℃,5% CO2培养15 h后,吸出培养基,PASA润洗3次后,更换新鲜培养基。隔天重复上述润洗操作1次。1周后,可见贴壁的单层成纤维细胞样BMSCs,记为原代(P0)。当P0代细胞融合达60%左右时,以1∶3的比例传代,记为一代细胞(P1)。继续培养2~3天后,当细胞融合至80%~90%左右时,重复上述传代操作,至P5代。应用流式细胞技术检测BMSCs表面标记CD44、CD29,对干细胞进行鉴定。
1.2.2 细胞处理:选取生长状态良好的P5代BMSCs,随机分为对照组,染毒组以及干预组。其中,对照组细胞用生理盐水(Control组)或50 ng/L IGF-1(IGF组)处理24 h;染毒组细胞需在40 mmol/L HD中暴露24 h,建立体外凋亡模型(HD组);干预组细胞则用40 mmol/L HD和不同浓度(50,75和100 ng/L)IGF-1共同处理24 h。按IGF-1的剂量不同,干预组可分为:50 IGF+HD组,75 IGF+HD组以及100 IGF+HD组。
1.2.3 TUNEL检测:实验结束后,先用多聚甲醛将BMSCs在室温下固定20 min。然后,用PBS冲洗3次,并在1% Triton X-100中孵育3~5 min。接下来,将TUNEL反应液加入培养皿中,并在37 ℃,湿盒中避光孵育1 h。待反应结束后,用DAPI处理5 min。在免疫荧光显微镜下对细胞进行计数。AI = (TUNEL阳性细胞的数量/总细胞数量) × 100%。
1.2.4 Caspase-3活性检测:实验结束后收集细胞,并用PBS清洗1次。然后将细胞在冰上裂解15 min。收集上清液4 ℃,16000 g离心10 min。在96孔板的每个孔中加入50 μL反应液,40 μL细胞蛋白裂解液以及10 μL caspase-3 反应底物。37 ℃下孵育2 h后,应用酶标仪在405 nm波长下读取各孔反应液的荧光强度。
1.2.5 Western blot:实验结束后,用PBS清洗细胞2次,然后加入含1% PMSF的RIPA细胞裂解液300 μL,在冰上裂解15 min。按配方配制12 %或10%浓度的分离胶。静置30 min后,配制4%浓缩胶。每个蛋白样品上样30 mg,60 V恒压电泳。30 min后转为120 V恒压电泳,运行至溴酚蓝抵达玻璃板底端为止。电泳结束后,取出凝胶,冰浴中湿转,60 V,120 min。待转膜结束后,将PVDF膜置于5%的牛奶中。摇床封闭1 h后,按比例加入一抗,4 ℃过夜。TBST洗膜4次,每次8 min,加入二抗(1∶5000),室温下摇床孵育1 h。TBST洗膜4次,每次8 min。应用ChemiDocTMXRS+凝胶成像系统进行分析,各组所测蛋白的相对表达水平=所测蛋白的灰密度值/β-actin的灰密度值。
1.3 统计学方法
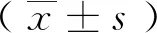
2 结 果
2.1 IGF-1对HD暴露BMSCs的凋亡抑制作用
各组BMSCs的凋亡检测结果如图1所示,HD组BMSCs的TUNEL阳性细胞的比例显著高于Control组(P<0.05);经不同浓度(50,75,100 ng/L)IGF-1干预后,TUNEL阳性细胞的比例显著减少,且该作用具有剂量依赖性,表现为随IGF-1剂量的增加,TUNEL阳性细胞下降的比例也随之增加(P<0.05);而IGF组与Control组间的TUNEL阳性细胞比例无统计学差异(P>0.05)。
a:与Control组比较,P<0.05;b:与HD组比较,P<0.05;c:与50 IGF+HD组比较,P<0.05;d:与75 IGF+HD组比较,P<0.05图1 各组BMSCs的凋亡检测结果(×400)Fig 1 Apoptosis index of BMSCs in each group (×400)
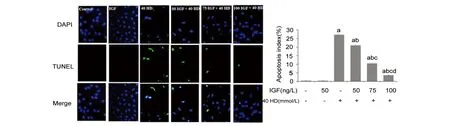
2.2 IGF-1对HD暴露BMSCs中caspase-3活性的影响
各组BMSCs的caspase-3活性检测结果如图2所示,HD组BMSCs的caspase-3活性显著高于Control组(P<0.05);经不同浓度(50,75,100 ng/L)IGF-1干预后,BMSCs的caspase-3活性呈现IGF-1剂量依赖性地降低(P<0.05);而IGF组与Control组间的caspase-3活性无统计学差异(P>0.05)。
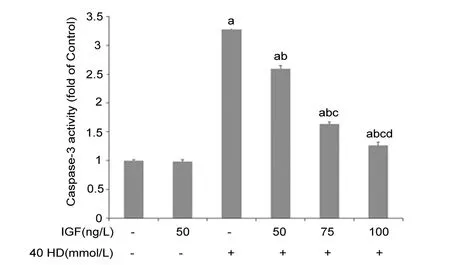
2.3 IGF-1对HD暴露BMSCs中Akt蛋白表达及磷酸化水平的影响
各组BMSCs的Akt蛋白表达及磷酸化水平如图3所示,HD组BMSCs的Akt蛋白磷酸化水平显著低于Control组(P<0.05);经不同浓度(50,75,100 ng/L)IGF-1干预后,BMSCs的Akt蛋白磷酸化水平呈现IGF-1剂量依赖性地增高(P<0.05);而IGF组与Control组间的Akt蛋白磷酸化水平无统计学差异(P>0.05)。此外,各组之间的Akt蛋白表达水平也无统计学差异(P>0.05)。
a:与Control组比较,P<0.05;b:与HD组比较,P<0.05;c:与50 IGF+HD组比较,P<0.05;d:与75 IGF+HD组比较,P<0.05图2 各组BMSCs中caspase-3的活性检测结果Fig 2 Caspase-3 activity of BMSCs in each group
a:与Control组比较,P<0.05;b:与HD组比较,P<0.05;c:与50 IGF+HD组比较,P<0.05;d:与75 IGF+HD组比较,P<0.05图3 各组BMSCs的Akt蛋白表达及磷酸化水平Fig 3 Expression and phosphorylation of Akt in the BMSCs of each group
2.4 IGF-1对HD暴露BMSCs中Bad蛋白表达及磷酸化水平的影响
各组BMSCs的Bad蛋白表达及磷酸化水平如图4所示,HD组BMSCs的Bad蛋白磷酸化水平显著低于Control组(P<0.05);经不同浓度(50,75,100 ng/L)IGF-1干预后,BMSCs的Bad蛋白磷酸化水平呈现IGF-1剂量依赖性地增高(P<0.05);而IGF组与Control组间的Bad蛋白磷酸化水平无统计学差异(P>0.05)。此外,各组之间的Bad蛋白表达水平也无统计学差异(P>0.05)。
3 讨 论
胰岛素样生长因子(insulin growth factor, IGF)与胰岛素高度同源,同属于insulin/IGF家族,是一类结构和功能类似于胰岛素的多肽类物质[21],参与机体多种生理功能的调节。IGF-1是IGF家族中的一员,通过与IGF-1R结合,激活下游相关信号通路,对细胞生长、分化、功能的维持以及凋亡等发挥了重要的生物学调控作用[22]。Tsai等[23]报道,人来源IGF-1对tbx5缺陷斑马鱼胚胎具有潜在抗凋亡作用。研究显示,IGF-1对β淀粉样蛋白诱导的神经元细胞死亡具有拮抗作用。在本研究中,HD组BMSCs细胞的凋亡率和caspase-3活性显著高于Control组。然而添加IGF-1后,BMSCs细胞的凋亡率和caspase-3活性显著低于HD组,且呈现明显的剂量依赖性降低[24],与上述文献报道一致。这提示IGF-1对HD诱导的BMSCs凋亡具有明显拮抗作用。
PI3K/Akt信号通路是细胞内重要的信号传导途径,该通路参与调控了细胞的增殖、凋亡、分化及自我更新等生理过程。研究显示,PI3K/Akt是由IGF-1信号激活的主要通路[25]。Kim等[26]报道,1-甲基-4-苯基吡啶鎓(MPP+)暴露可诱导SH-SY5Y细胞凋亡,并抑制Akt磷酸化,添加IGF-1可拮抗MPP+诱导的细胞凋亡,并上调Akt磷酸化水平。然而,PI3K抑制剂可阻断IGF-1的这些作用。Wang等[27]通过将人视网膜色素上皮细胞D407暴露于硝普钠,诱导视网膜病细胞损伤模型,研究IGF-1对这种损伤的保护作用。结果发现,IGF-1以剂量依赖方式抑制硝普钠对D407的凋亡诱导作用,而用阻断剂干预PI3K/Akt通路后,IGF-1的保护作用被阻断。高玉红等[28]研究表明,添加50 μg/mL IGF-1的奶牛乳腺上皮细胞(BMECs)凋亡率显著低于对照组。然而,加入PI3K抑制剂孵育细胞后,BMECs的凋亡率则显著升高,提示IGF-1的保护作用受到明显抑制。本研究也显示,HD暴露BMSCs的Akt磷酸化水平显著降低。然而添加IGF-1后,HD暴露BMSCs的Akt磷酸化水平得到显著提升。这些结果提示,IGF-1可激活HD暴露BMSCs的PI3K/Akt信号通路。
Bad是Bcl-2家族成员之一,同时也是Akt下游凋亡相关通路中的关键分子。生理情况下,Bad以p-Bad形式与14-3-3蛋白结合,并游离于细胞浆中。当Akt接受上游信号刺激,活化为具有生物活性的Akt(p-Akt)时,能促进Bad磷酸化(p-Bad),并抑制线粒体依赖性凋亡的发生。相反,当凋亡信号转导至p-Bad,会刺激p-Bad去磷酸化释放出Bad,诱导线粒体依赖性凋亡。Yang等[29]研究显示,IGF-1上调缺氧的视网膜神经节细胞Bad磷酸化水平。在本研究中,通过添加IGF-1,可显著改善HD暴露细胞的Bad磷酸化水平。这表明,Akt/Bad信号通路可能参与IGF-1对HD暴露BMSCs的抗凋亡调控。
总之,我们的研究结果显示,IGF-1可抑制HD暴露BMSCs的凋亡,降低caspase-3活性,并上调Akt和Bad的磷酸化水平。提示IGF-1可通过Akt/Bad通路拮抗HD暴露BMSCs的凋亡。我们的发现,为筛选BMSCs移植保护剂提供了一定的理论依据。今后有必要通过体内实验证明IGF-1在体内对移植BMSCs的抗凋亡保护作用;并通过对主要通路蛋白进行干预实验,进一步证明IGF-1激活IGF-1受体并介导Akt/Bad通路拮抗BMSCs凋亡的调控作用。
