油菜附加系EE抗根结线虫的蛋白质组学初步研究
2020-02-25罗红梅HolgerBudahn张绍松
余 萍,董 超,罗红梅,Holger Budahn,张绍松*
(1.云南省农业科学院生物技术与种质资源研究所,云南 昆明 650223; 2.植物育种研究中心园艺作物研究所,德国 奎德林堡 06484)
【研究意义】根结线虫 (Meloidogynespp.) 是世界性重要植物病原线虫,也是中国农作物最主要的病原线虫[1]。其适应性强,传播途径多样,寄主范围广,给农业经济造成严重的损失[2]。据不完全统计,全球每年因线虫危害所造成的农作物损失多达1000亿美元,其中50 %的经济损失是由根结线虫侵害造成的[3-4]。近些年,线虫病的发生日趋严重,已成为当前农业生产中亟待解决的一个问题。控制根结线虫目前应用较广的是杀线虫剂,但在土壤及植株中残留时间长,对生态环境破坏大,大多欧洲国家已经禁止使用。因此,发掘和利用抗根结线虫病的抗性资源是最有效、最经济的防控措施。【前人研究进展】抗根结线虫的R基因已经从多种植物中分离。第1个分离克隆的抗根结线虫R基因是来源于番茄的Mi-1.2基因[5](Vos et al., 1998),随后,来源于马铃薯的Gpa2和Rmc基因[6-7],番茄的Mi9基因[8](Jablonska et al., 2007),樱桃李的Ma基因[9](Claverie et al., 2011),棉花的GHNTR1基因[10](Zhang et al., 2015),基因甜椒的Me[11](Celik et al., 2016)等相继被克隆。油萝卜是十字花科萝卜属萝卜的变种,具有优良的抗病虫基因,如抗根结线虫和孢囊线虫,及其它抗旱、抗寒、耐酸碱等优良特性。已有研究表明抗甜菜胞囊线虫基因Hs1Rph定位在油萝卜D染色体上[12](Budahn et al., 2009)。另外,抗性测定结果显示,油萝卜E染色体携带该抗性基因[13](Zhang et al., 2014)。【本研究切入点】蛋白质组学是一种前沿的方法,用于揭示蛋白质的动态变化,以应对不同的压力因素,包括生物和非生物胁迫。以接种南方根结线虫的油菜(感病)和油菜附加系EE(抗病)的根系为材料,通过蛋白质组学经典的双向电泳方法,结合生物信息学分析,筛选差异表达的蛋白质及预测它们间的关系,以找到与抗线虫密切相关的蛋白质。【拟解决的关键问题】为培育抗性品种提供基因资源,并揭示植物-根结线虫互作机制。
1 材料与方法
1.1 植物材料和线虫培养
以抗根结线虫的油菜附加系EE和感根结线虫的油菜Madora为材料。将该种植株的种子在育苗盘中播种。1个月后,将幼苗移植到9 cm× 9 cm的塑料盆中,该盆中含有400 g包括根结线虫的病土。经测定该病土主要含有南方根结线虫和少量的花生根结线虫,爪哇根结线虫。 植物在气候室18 ℃下培养16 h ,13 ℃,昼夜8 h,持续2个月。 收集根为样品储存在-80 ℃备用。
1.2 试验方法
参考Yu P等的方法[14]。即用TCA/丙酮法分别从3.0 g Madona和Madona ee根中提取总蛋白。使用Bradford方法[15]测定蛋白质浓度。分别使pH 4~7的IPG胶条吸收含600 μg总蛋白质的500 μl水化缓冲液(7 M尿素,2 M硫脲,4 %CHAPS,65 mM DTT,0.2 %IPG缓冲液,0.001 %溴酚蓝)中。在IPGphor II中进行等电聚焦:250 V 30 min,500 V 30 min,1000 V 30 min,8000 V 4 h和8000 V 65000 Vh。聚焦完成后依次置于平衡缓冲液-1(6M尿素,2 %SDS,50 mM Tris-HCl pH 8.8,20 %甘油,2 %DTT)和平衡缓冲液-2(6M尿素,2 %SDS,50 mM Tris-HCl pH 8.8,20 %甘油,2.5 %碘乙酰胺)中分别平衡20 min。转入含12.5 %SDS-PAGE凝胶的GE Ettan DAL Tsix仪器中垂直电泳。电泳后将凝胶用Coomassie Brilliant Blue G-250染色, UMAX Power Look扫描仪以300 dpi灰度模式分辨率扫描, Image Master 2D Platinum软件5.0版(GE Healthcare Bio-Sciences AB,Uppsala,Sweden)进行分析。筛选出分离清晰且具有2倍或更多表达差异的蛋白质点进行质谱鉴定。
1.3 质谱鉴定
蛋白质点经胰蛋白酶酶解,提取和Ziptip脱盐过程,然后取1 μl溶解样品点于样品靶上,让溶剂自然干燥后,再取0.6 μl过饱和CHCA基质溶液点至对应靶位上并自然干燥。样品靶经氮气吹净后放入仪器进靶槽并用串联飞行时间质谱仪(5800 MALDI-TOF/TOF, AB SCIEX)进行测试分析,激光源为波长349 nm 的Nd:YAG 激光器,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据,一级质谱(MS)扫描范围为800~4000 Da,选择信噪比大于50的母离子进行二级质谱(MS/MS)分析,每个样品点上选择10个母离子,二级质谱(MS/MS)累计叠加2500次,碰撞能量2 kV,CID关闭。质谱测试原始文件用Mascot 2.2软件检索NCBInr Brassica_rapa和Raphanus_sativus数据库,最后得到鉴定的蛋白质结果。
1.4 生物信息学分析
通过GO(http://www.geneontology.org/)和WEGO(http://wego.genomics.org.cn/)进行显着差异表达蛋白质的功能注释。 WOLF PSORT(http://www.genscript.com/wolf-psort)用于预测目标蛋白的亚细胞定位。 KEGG(http://www.kegg.jp/)用于分析差异表达蛋白质参与的代谢途径。 STRING(http://www.string-db.org/)用于构建差异表达蛋白质之间的相互作用网络。
2 结果与分析
2.1 差异表达蛋白的鉴定
为了从蛋白水平揭示植物的抗线虫机制,通过2-DE 和 质谱技术研究油菜附加系EE和其供体油
菜Madora 根系差异表达蛋白。 选择pH 4~7的IPG胶条和12.5 %的聚丙烯酰氨凝胶电泳分离植株根系总蛋白质。利用Image Master 5.0分析2-DE扫描 图谱。图1显示Madora和油菜附加系EE分别有 1184和1163 个蛋白点。 以Madora为对照,油菜附加系EE与其相比较,经MALDI-TOF/TOF 质谱成功鉴定了21个差异表达蛋白质,其中蛋白质表达量上调的有12个,下调的有9个(表1)。

图1 植株根部的2-DE图谱Fig.1 The 2-DE maps of plant roots

表1 MALDI-TOF/TOF 质谱鉴定油菜附加系EE和油菜Madora根部差异表达蛋白质

续表1 Continued table 1
2.2 差异蛋白的生物信息学分析
为了阐明差异表达蛋白的功能,通过GO功能分类系统鉴定了这些蛋白的生物过程,分子功能和细胞成分。 结果表明这些蛋白主要分为细胞成分中的细胞,细胞部分和细胞器,分子功能中的结合和催化作用,生物过程中的细胞过程,代谢过程和应激反应(图2)。 WoLF PSORT预测了这些蛋白质的亚细胞定位,其主要定位于细胞外(52.38 %),其次是细胞质(28.57 %),叶绿体(4.76 %),线粒体(4.76 %),内质网(4.76 %),液泡(4.76 %,图3)。
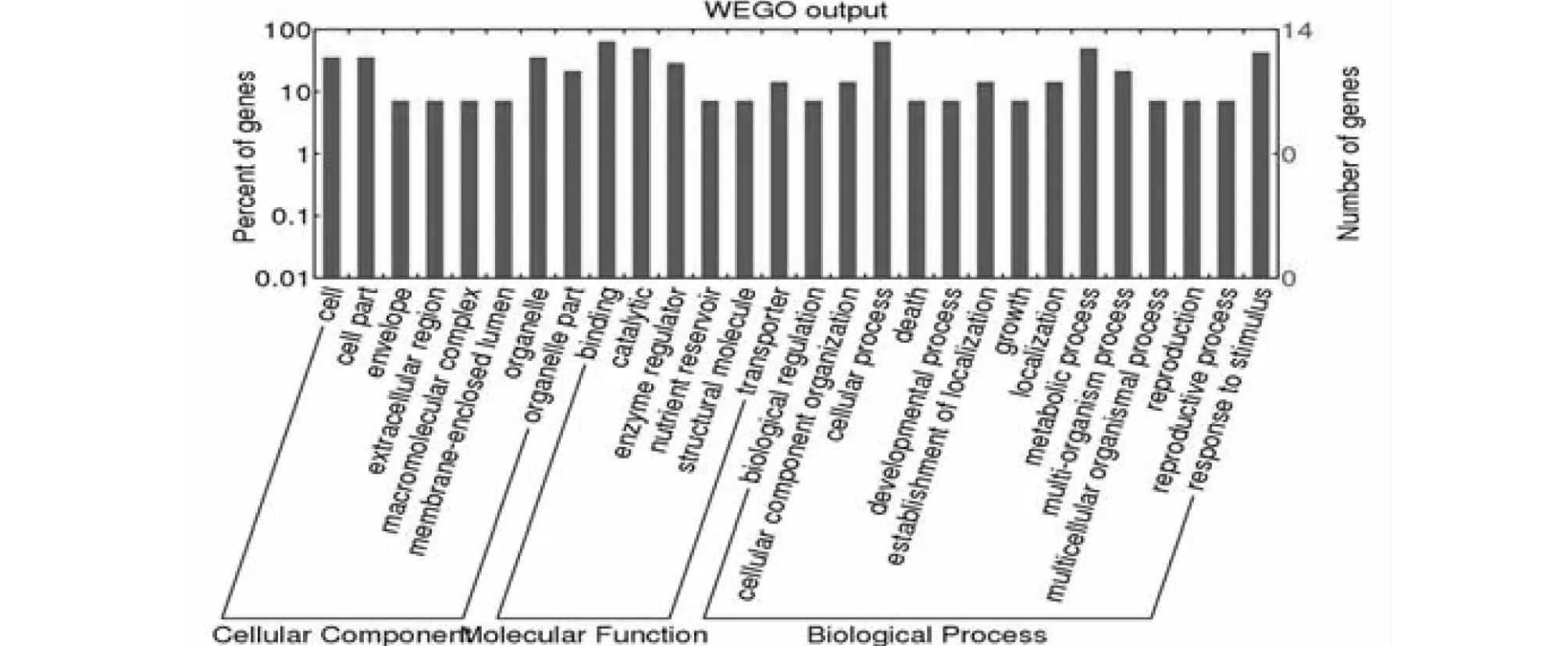
图2 GO和WEGO的功能分类Fig.2 Functional classifications from GO and WEGO
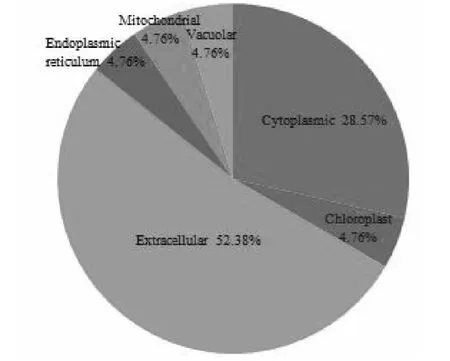
图3 鉴定蛋白质的亚细胞定位Fig.3 Subcellular localization of the identified proteins
通过STRING对所有差异表达的蛋白质绘制蛋白质-蛋白质相互作用网络(图4)。 该图显示,胰蛋白酶抑制剂BvTI(Bra003850.1-P),V型质子ATP酶催化亚基A(Bra003633.1-P)和核苷二磷酸激酶1样亚型X1(Bra030844.1-P)是独立的,与其他蛋白质无关。 然而,ATP合成酶β-2亚基(Bra028648.1-P),苹果酸脱氢酶1(Bra039662.1-P),S-腺苷甲硫氨酸合成酶3(Bra023084.1-P)和S-腺苷甲硫氨酸合酶亚型X2(SAMS-P)4个蛋白质具有一定的相关性。3-异丙基苹果酸脱水酶大亚基(Bra032708.1-P),微管蛋白α-6链(Bra018825.1-P),表皮特异性分泌糖蛋白EP1(Bra035070.1-P),内源性α-淀粉酶/枯草杆菌蛋白酶抑制剂样(Bra016070.1-P),BnaC04g03560D(Bra004819.1-P)和BnaC06g3421 0D(Bra016002.1-P)6个蛋白质具有一定的相关性。
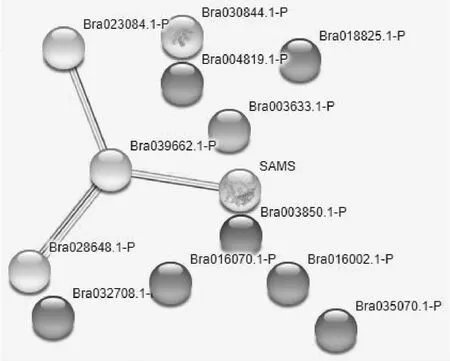
图4 差异表达蛋白质的蛋白质-蛋白质相互作用网络Fig.4 Protein-protein interaction network of the differentially expressed proteins
为了明确差异表达蛋白参与的代谢途径,KEGG用于确定它们属于哪种类型的生化代谢途径。结果显示,共有7种蛋白质参与代谢途径,分别为XP_013676805.1和XP_013673398.1共同参与氧化磷酸化; XP_013748848.1参与柠檬酸循环,半胱氨酸和蛋氨酸代谢,丙酮酸代谢,乙醛酸和二羧酸代谢,光合生物中的碳固定和碳代谢等多种代谢途径; XP_013723181.1和XP_013722790.1共同参与了氨基酸的生物合成;另外,核苷二磷酸激酶1样亚型X1(XP_013649391.1)参与了MAPK信号通路;微管蛋白α-6链(XP_013640865.1)参与了吞噬体。
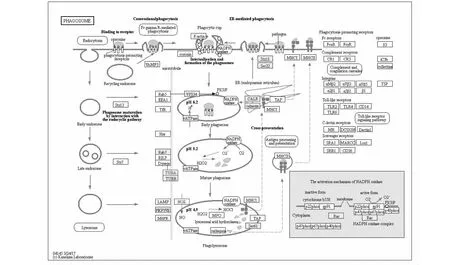
图5 差异表达蛋白的KEGG途径Fig.5 Images of differentially expressed proteins in KEGG pathway
3 讨 论
植物寄生线虫是农业生产中一种常见的病原物,全球每年因植物寄生线虫造成的农作物损失约800亿~1570亿美元不等[16]。其中,危害最为严重的为根结线虫。由于其非特异性、症状隐蔽、缺乏明显损伤而常常被误诊或被忽视。
油萝卜是十字花科萝卜属萝卜的变种,具有优良的抗生物胁迫和非生物胁迫的抗性基因。经长期的杂交选育,已获取9个油菜附加系。其中,油菜附加系EE是油萝卜的E染色体以二倍体形式存在于油菜Madora中,用于研究单个油萝卜染色体对抗性行为的影响。经油菜附加系的抗性测定结果显示,油萝卜E染色体携带抗根结线虫的基因[13]。因此,为了鉴定油萝卜E染色体可能参与介导的抗性蛋白质,将油菜附加系EE与油菜Madora进行比较。21个蛋白质被成功鉴定,其中12个蛋白质上调。上调的蛋白质中,4个蛋白质被鉴定为kunitz型丝氨酸蛋白酶抑制剂DrTI,3个蛋白质为内源性α-淀粉酶/枯草杆菌蛋白酶抑制剂。
蛋白酶抑制剂广泛分布于自然界中,特别是植物的贮藏器官,如种子和块茎中,具有调节细胞凋亡并保护植物免受昆虫、线虫和微生物等病原体的侵害[17]。丝氨酸蛋白酶抑制剂是最多样化的蛋白酶抑制剂超家族,在许多生物过程中扮演着重要角色,例如血液凝固,纤维蛋白溶解、发育、炎症、组织损害、免疫防御、酚氧化酶原激活和脊椎动物、无脊椎动物的补体系统[18]。Kunitz型蛋白酶抑制剂属于丝氨酸家族,几乎所有生物中都存在,通过调节丝氨酸蛋白酶的蛋白水解活性,参与免疫反应预防血吸虫病[19]。α-淀粉酶/枯草杆菌蛋白酶抑制剂为双功能抑制剂,具有抑制蛋白酶和内源性α-淀粉酶的作用,大量存在于植物种子中,在水稻、大麦、小麦等多种植物中已有报道,具有参与针对微生物的植物防御系统[17]。该基因在大麦发育中的果皮中特异性表达表明该蛋白质主要与种子对病原体的防御有关。 该蛋白可能通过特异性的抑制大麦α-淀粉酶的作用使真菌无法获取种子的淀粉[20]。首次在中草药川芎根茎中发现α-淀粉酶/枯草杆菌蛋白酶抑制剂,并研究表明该基因对转基因工程有用,以提高植物对害虫和微生物的抗性[21]。
本研究表明Kunitz型丝氨酸蛋白酶抑制剂和α-淀粉酶/枯草杆菌蛋白酶抑制剂在接种根结线虫的油菜附加系EE中均上调,上调幅度最大的可达13.52倍。说明这2种蛋白酶抑制剂可能在油菜附加系EE抗根结线虫过程中起着重要作用。将蛋白酶抑制剂制成的生物农药或转基因植物用于防治根结线虫能有效减少化学杀线剂的使用,改善环境和维持生态平衡。
为了进一步验证蛋白酶抑制剂参与抗线虫机制,应在线虫感染到卵块发育的时间范围内更详细地测量它们的表达水平。 同时,应用细胞学方法研究进食位点的发育。
4 结 论
油菜附加系EE通过调节参与应激反应的蛋白酶抑制剂的表达量上调和表皮特异性分泌糖蛋白、微管蛋白等蛋白质表达量的下调作用抵抗根结线虫的侵染。
