医疗器械生产企业空气净化系统监管研究
2020-02-24唐剑袁文杰
唐剑,袁文杰
厦门市食品药品审评认证与不良反应监测中心,厦门市,361005
0 引言
关于药品、医疗器械空气净化系统方面的研究,近年来有过少量报道,例如鲍方名[1]通过对2014 年苏州地区 94 家医疗器械生产企业微生物实验室布局、生物安全设计等方面进行了数据分析,对医疗器械微生物实验室的设计现状进行了初步了解。刘洪伟等[2]曾报道深圳市医疗器械检测中心自 2006 年开展医疗器械洁净厂房的监测以来洁净室的设计施工、监测指标以及维护管理等方面存在的问题。甄辉等[3]介绍了医疗器械生产洁净区的送排风系统在监管过程中的检查要点。然而,当前从监管的角度对空气净化系统在整体水平上的系统关注和研究尚很缺乏。笔者通过对近年来医疗器械生产企业空调净化系统的不符合项案例进行收集汇总,结合法规标准的变化,从整体水平上系统地对不合格项、判定依据及检查要点进行分析总结,旨在给医疗器械生产企业从业人员及政府监管人员提供实用性的参考。
1 空气净化系统的组成及环境参数要求
1.1 洁净室(区)空气净化系统的组成
洁净室(区)空气净化系统通常包括处理空气的净化设备、输送空气的管路系统、用来生产的洁净环境(见图1)。
1.2 医疗器械洁净室(区)环境参数及检测要求
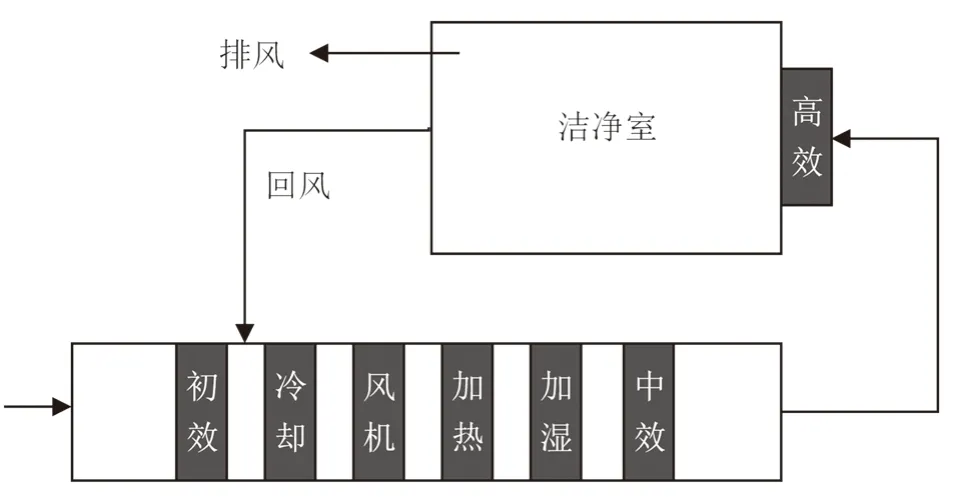
图1 常见医疗器械生产企业洁净室(区)空气净化系统组成示意图Fig.1 Diagram of a common air purification system in medical device manufacturer
医疗器械洁净室(区)环境检测涉及8个参数,分别是温度、相对湿度、风速(适用于百级区)、换气次数(适用于万级、十万级和三十万级区)、静压差、尘埃粒子数、浮游菌数、沉降菌数,具体要求见表1。
2 空气净化系统监管研究
2.1 空气净化系统常见不符合项特征及其判定依据
通过对近四年(2015—2018年)来笔者实际参与及从各地药监部门收集到的共计100余家次的现场检查(包括医疗器械产品注册核查、飞行检查、日常检查)结果进行汇总,调取其中与空气净化系统相关的常见检查不符合项,依据国家局发布的指导原则及相关法规标准[4-8],对各个不符合项按照特征类型及判定依据进行归类合并,最终形成了送风/回风系统、文件记录、验证和确认、系统维护保养、环境监测报告、洁净区压差、温湿度控制、过滤器压差监测、计量校验、微生物室净化系统、排风系统、检验设备、人员培训共13大方面的共性缺陷表(详见表2~表14)。从中不难看出,空气净化系统的常见共性缺陷分布广泛,基本涵盖了系统设计、安装、运行、维护的各个方面,反映出相关从业人员对于近年来国家局新发布的配套指导原则和指南的具体要求落实不到位。
2.2 共性缺陷类型占比分析
进一步统计可以看出,涉及空气净化系统的常见共性缺陷数量多达70个,其中以送风/回风系统、文件记录、验证和确认、系统维护保养、环境监测报告这5大方面的共性缺陷合计占比最高,分别占比为17.1%、12.9%、10%、10%和10%,合计占全部缺陷的60%(详见表15)。反映出空气净化系统在复杂程度高的设计安装、维护保养、日常监测等方面存在较为严重的培训缺失。
2.3 空气净化系统GMP现场检查要点归纳
针对以上常见共性缺陷的分析,结合笔者多年医疗器械行业从业经验及监管经历,现为医疗器械GMP检查员及生产企业归纳出以下20条检查要点(详见表16),力求较为全面地覆盖现场检查中监管人员的关注重点,同时也可作为企业自查自纠的针对性切入点。
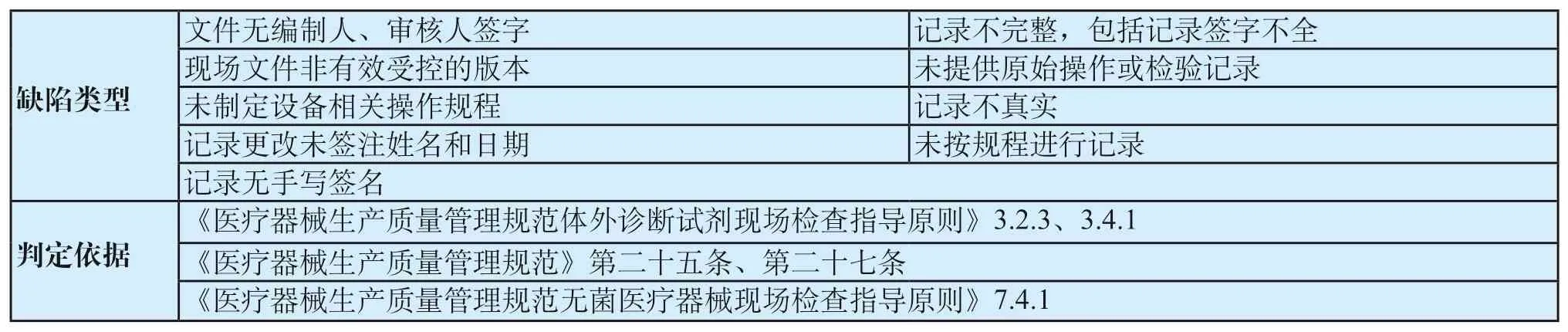
表3 文件记录共性缺陷表Tab.3 General defects of documents and records

表4 验证和确认共性缺陷表Tab.4 General defects of verification and validation
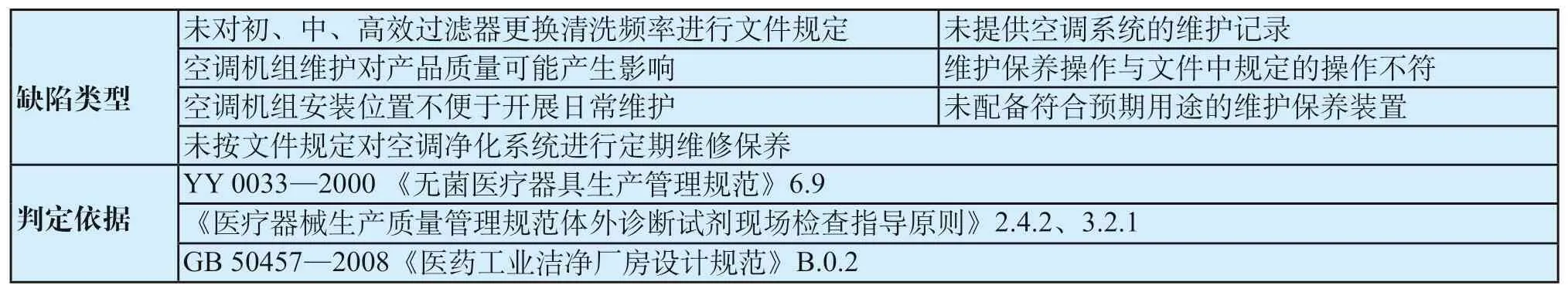
表5 系统维护保养共性缺陷表Tab.5 General defects of system maintenance

表6 环境监测报告共性缺陷表Tab.6 General defects of environmental monitoring report
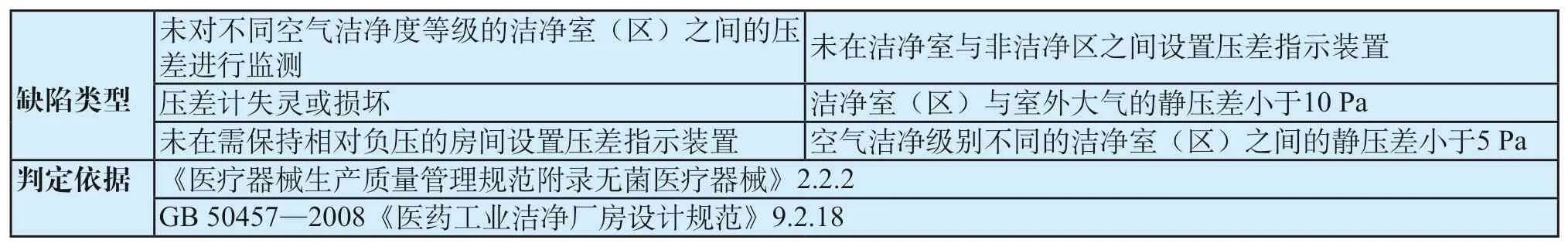
表7 洁净区压差共性缺陷表Tab.7 General defects of differential pressure in clean area
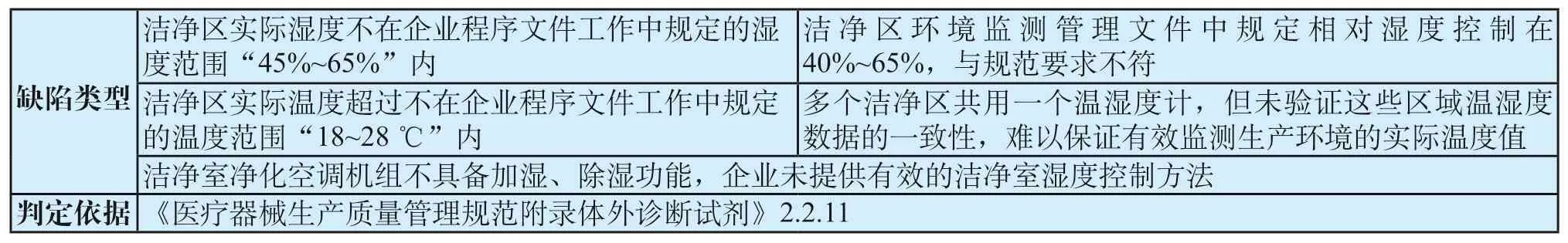
表8 温湿度控制共性缺陷表Tab.8 General defects of temperature and humidity control
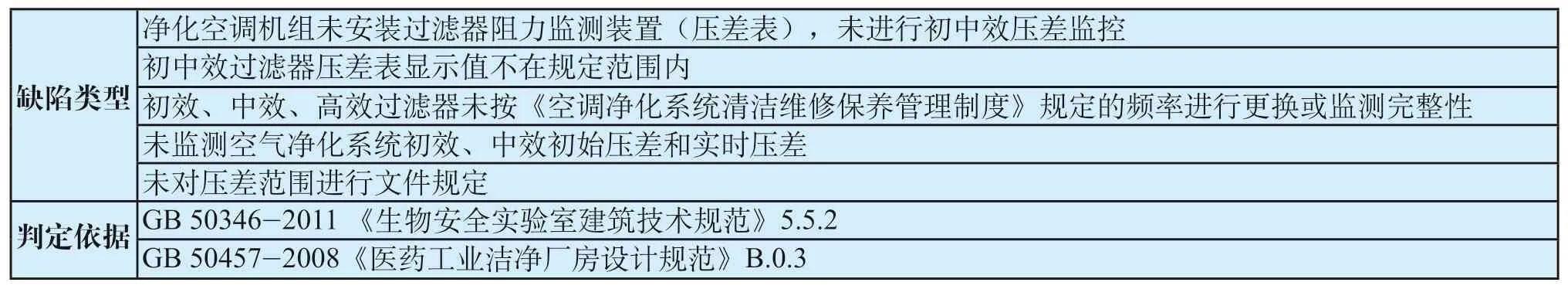
表9 过滤器压差监测共性缺陷表Tab.9 General defects of differential pressure of filter

表10 计量校验共性缺陷表Tab.10 General defects of metrological verification
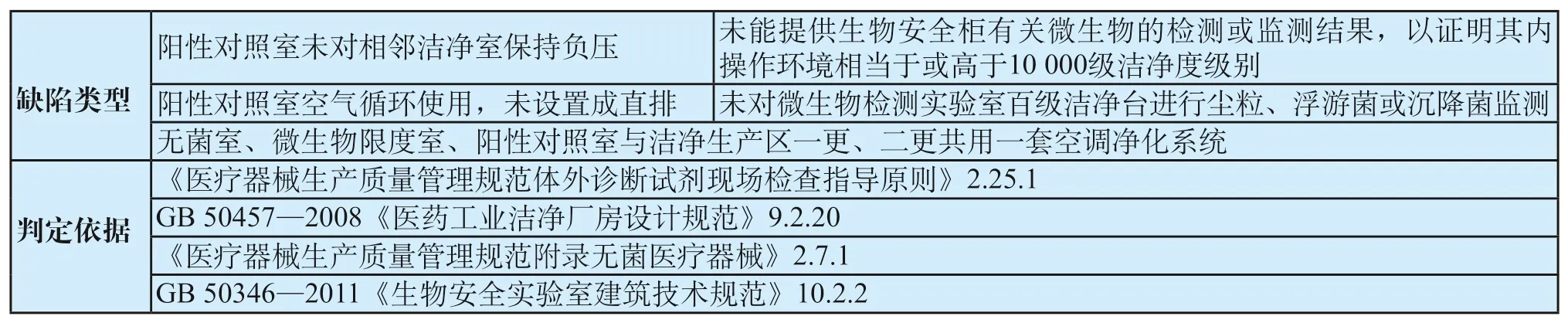
表11 微生物室净化系统共性缺陷表Tab.11 General defects of air purification system in microbiology room
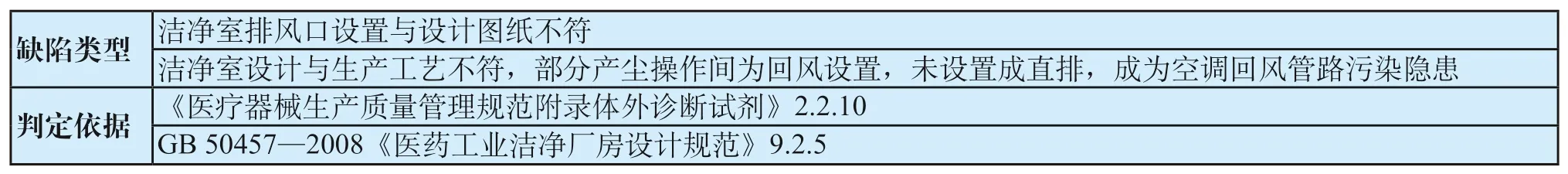
表12 排风系统共性缺陷表Tab.12 General defects of exhaust system

表13 检验设备配置共性缺陷表Tab.13 General defects of inspection devices configuration

表14 人员培训共性缺陷表Tab.14 General defects of personnel training
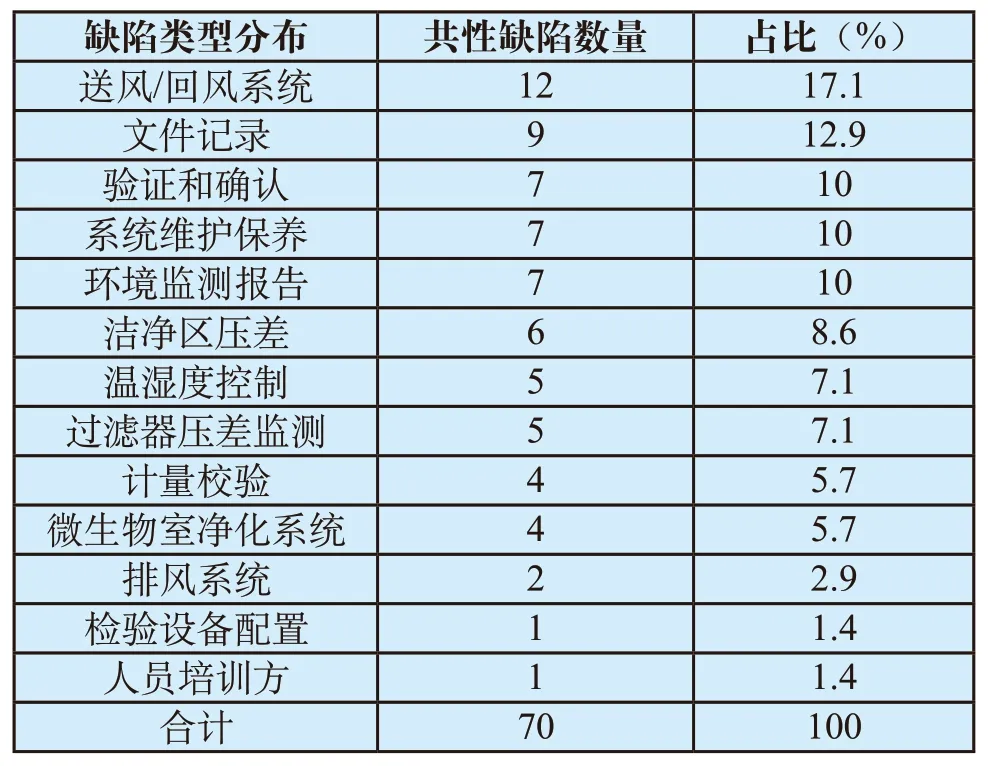
表15 空气净化系统相关缺陷类型分布Tab.15 Type distribution of general defects in air purification system
3 讨论
对于体外诊断试剂、无菌医疗器械、植入医疗器械等产品而言,洁净区是不可缺少生产环境,洁净区空气净化系统的设计及有效运行是保证洁净度的关键之一,也直接或间接地影响着医疗器械产品的质量。从本文的分析中可以看出,70种医疗器械GMP现场检查中与空气净化系统有关的典型缺陷按比例由高到低分布于送风/回风系统、文件记录、验证和确认等13大方面。其中,送风/回风系统、文件记录、验证和确认、系统维护保养及环境监测报告这5个方面的常见共性缺陷合计占比达到了60%。一方面反映出企业对在医药厂房设计之初,对于空气净化系统的规划就缺乏整体考虑;另一方面,也反映出企业对于空气净化系统运行过程中,往往只重视结果而不重视过程验证/确认、不重视记录的真实和可追溯性、不重视空调维护和管理。系统掌握空气净化系统相关现场检查要点,了解常见缺陷的典型特征及其判定依据,不仅可以有针对性地提升政府监管人员的专业理解能力,统一判定尺度,同时对于企业开展日常自查自咎、改进质量管理、新建或改造厂房的空气净化系统都具有参考价值。

表16 空气净化系统现场检查要点Tab.16 Key points of field inspection for air purification system
