芍药PlSPL3基因的克隆与表达分析
2020-02-22张佼蕊贺丹何松林谢栋博李朝梅王政刘艺平
张佼蕊 贺丹 何松林 谢栋博 李朝梅 王政 刘艺平

摘要:为了探究芍药属不同种间远缘杂交不亲和的分子作用机制,以粉玉奴芍药自交授粉后24 h、36 h和粉玉奴芍药×凤丹白牡丹杂交授粉后24 h、36 h的柱头为材料,根据柱头转录组差异基因序列,采用逆转录(RT)-PCR技术,克隆得到SPL3基因的cDNA序列,将其命名为PlSPL3(GenBank登录号:MN842720),随后对其进行生物信息学分析和表达特性分析。结果表明,PlSPL3基因的编码区(Coding sequence,CDS)全長1 305 bp,共编码434个氨基酸。分析结果显示,PlSPL3蛋白是一种带负电荷的不稳定的亲水性蛋白质,无跨膜结构。蛋白质进化树显示,芍药PlSPL3蛋白的氨基酸序列与拟南芥AtSPL7蛋白的氨基酸序列具有较高的同源性,同时芍药PlSPL3蛋白与木瓜、向日葵和无花果SPL3蛋白的氨基酸序列同源性也较高。实时荧光定量PCR(RT-qPCR)结果显示,在自交、杂交授粉后不同时期的柱头中,PlSPL3基因在杂交授粉后36 h的相对表达量最高。研究结果为进一步阐明PlSPL3基因在芍药与牡丹远缘杂交不亲和中的生物学功能提供了理论依据。
关键词:牡丹;芍药;PlSPL3基因;基因克隆;基因表达
中图分类号:S682.1+2文献标识码:A文章编号:1000-4440(2020)06-1537-06
Abstract:In order to explore the molecular mechanism of distant hybridization incompatibility in Paeonia, the stigmas from P. lactiflora Fenyunu × P. lactiflora Fenyunu and P. lactiflora Fenyunu × P. ostii Fengdanbai were harvested as the materials after 24 h and 36 h of pollination. The cDNA sequence of SPL3 gene was cloned by reverse transcription (RT)-PCR technique based on differential gene sequence of transcriptome in stigma, and was named as PlSPL3 (GenBank accession No: MN842720), the bioinformatics and expression characteristics of PlSPL3 were then analyzed. The results showed that 434 amino acids were encoded by the coding sequence of PlSPL3 gene with a length of 1 305 bp. Analysis results showed that PlSPL3 protein was a kind of unstable, hydrophilic protein with negative charges and without transmembrane structure. The results of phylogenetic tree indicated that the amino acid sequence of PlSPL3 protein from P. lactiflora had high homology with that of AtSPL7 protein from Arabidopsis thaliana, and the amino acid sequences of PlSPL3 protein in P. lactiflora were also highly homologous with those of SPL3 protein in Chaenomeles sinensis, Helianthus annuus and Ficus carica. Real-time quantitative PCR (RT-qPCR) results indicated that the relative expression level of PlSPL3 gene was the highest in stigmas at 36 h after hybridization. These results provide a theoretical basis in further elucidating the biological functions of PlSPL3 gene in distant hybridization incompatibility between P. lactiflora and P. ostii.
Key words:Paeonia lactiflora;Paeonia ostii;PlSPL3 gene;gene cloning;gene expression
牡丹(Paeonia ostii)与芍药(Paeonia lactiflora)同属于芍药科芍药属,具有很高的园林观赏价值和经济价值[1]。芍药花色艳丽、花型丰富、花期长,与牡丹并称为“花中二杰”[2]。芍药属的品种改良和育种工作一直是该领域科研和生产的主要内容,而杂交育种是芍药属育种工作采用的主要方法[3]。远缘杂交不仅可以丰富物种、提高植物的抗病性和抗逆性,还对花色等性状具有改良作用[4]。1948年,国际上首次成功获得了牡丹、芍药的组间杂种,并将其命名为Itoh杂种,具有观赏价值高、抗性强等特点[5-6]。目前国内的芍药属远缘杂交研究还处于初级阶段[7]。花粉管的不正常生长、受精过程失败是影响芍药属远缘杂交的主要障碍[8]。王文和等[9-10]在百合远缘杂交的过程中观察到花粉管形态异常现象,并且发现在花粉管生长过程中伴随着胼胝质反应;郝津藜等[11]在黄牡丹远缘杂交亲和性研究中同样发现,不亲和花粉会导致花粉管及柱头组织中胼胝质沉积,从而阻碍花粉管生长。牡丹与芍药远缘杂交的主要障碍是杂交不亲和,授粉后柱头对异源花粉的特异性排斥产生强烈的胼胝质反应,并且大部分花粉不能萌发,花粉管出现扭曲、肿胀等现象[3,12-13]。
SPL(SQUAMOSA promoter-binding protein-like)转录因子是花发育过程中一个重要的调控枢纽[14],它参与花的早期发育、成花转变等,并调控植物大小孢子的发生和雌雄配子体发育以及花粉囊发育、花药开裂等[15-18]。SPL家族基因广泛存在于玉米、番茄、葡萄、牡丹等植物中[19-22]。在拟南芥的SPL转录因子中,氨基酸序列最短的是AtSPL3蛋白,由131个氨基酸组成。AtSPL3基因参与调控下游基因的表达,从而促进拟南芥开花[17,23]。SPL3基因主要在花序中表达,在适当条件下过量表达会导致花和花序发育异常[24];在拟南芥中,SPL2基因可以影响花粉的产量及生育力[25-26];SPL8基因可以影响大小孢子的发生、雄蕊花丝的延长、小孢子囊壁的形成及花药开裂,SPL8基因功能缺失会影响花粉囊发育,导致植株花序缩短并且影响植株的生育力[16,27]。
笔者所在课题组前期对芍药属杂交育种进行了大量研究,发现粉玉奴芍药(P. lactiflora ‘Fenyunu)自交亲和,粉玉奴芍药与凤丹白牡丹(P. ostti ‘Fengdanbai)远缘杂交不亲和,并且发现远缘杂交不亲和的关键时期为杂交后24 h、36 h[3,12,28]。在前期试验中,笔者以芍药自交授粉亲和处理为对照,通过转录组研究,筛选了相关差异表达基因,得出显著上调表达的SPL基因。本研究以芍药柱头为材料,分析其PlSPL3基因的cDNA全长序列,并对其基因及编码蛋白质的序列特征进行分析,检测芍药属自交亲和与杂交不亲和在授粉后不同时期该基因表达情况,以期进一步探索芍药PlSPL3基因的功能与生物学信息,同时为进一步探究芍药属远缘杂交不亲和的分子机制提供理论依据。
1材料与方法
1.1试验材料
供试材料母本芍药品种粉玉奴、父本牡丹品种凤丹白均由河南省优质花卉蔬菜种苗工程研究中心提供。在母本松蕾期进行去雄、套袋处理,去雄2 d后连续3 d进行3次人工授粉。随后取粉玉奴自交授粉后24 h、36 h的柱头与粉玉奴×凤丹白杂交授粉后24 h、36 h的柱头。将柱头用液氮速冻后于-80 ℃冰箱中保存,随后进行RNA的提取。
1.2试验方法
1.2.1柱头总RNA的提取和cDNA的合成基于植物RNA提取的常规方法,使用天根生化科技(北京)有限公司的试剂盒进行柱头总RNA提取,用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa)將RNA反转录成cDNA第一链,然后将产物于-20 ℃贮存。
1.2.2PlSPL3基因的分离克隆根据转录组结果获得的PlSPL3基因片段,从美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)网站下载同源序列,进行基因比对分析,并在比对结果中寻找同源性较高的序列用于设计特异性引物。以cDNA第一链为模板,进行PCR扩增。使用20 μl反应体系,组成如下:10 μl 2×fast Pfu master mix,1 μl Primer F,1 μl Primer R,1 μl cDNA,加ddH2O至总体积为20 μl。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸90 s,33个循环;72 ℃延伸10 min。所用引物与用途见表1。PCR扩增产物经1%琼脂糖凝胶电泳检测后,用试剂盒(北京百泰克生物技术公司产品)回收目的条带,连接T载体后在感受态细胞中扩增,挑选阳性菌落进行测序,获得扩增的目的条带序列。
1.2.3生物信息学分析使用在线Nucleotide BLAST软件对PlSPL3基因的同源性关系进行分析。使用DNAMAN 8.0软件对PlSPL3基因编码蛋白质的氨基酸序列进行预测。用ProtParam、TMpred、SignalP 5.0 Server在线软件分析PlSPL3蛋白的理化性质、跨膜结构和信号肽信息。利用CDD在线软件分析PlSPL3基因编码蛋白质的结构域。利用GOR4软件预测PlSPL3蛋白的二级结构。使用MEGA 7.0构建系统发育树,Bootstrap值设置为1 000[29-30]。
1.2.4PlSPL3基因的表达分析分别以粉玉奴自交授粉后24 h、36 h和粉玉奴×凤丹白杂交授粉后24 h、36 h的柱头cDNA为模板,以β-Tubulin为内参基因(表1),使用SYBR Premix ExTaqTM试剂盒[宝日医生物技术(北京)有限公司产品],在ABI 7900 Real-Time PCR System仪(美国应用生物系统中国公司产品)上进行实时荧光定量PCR,引物序列见表1。实时定量反应体系及反应程序参照He等[12]的方法进行,每个反应包括3个生物学重复。用2-△△Ct法计算基因的相对表达量[31]。
2结果与分析
2.1PlSPL3基因全长序列的克隆与分析
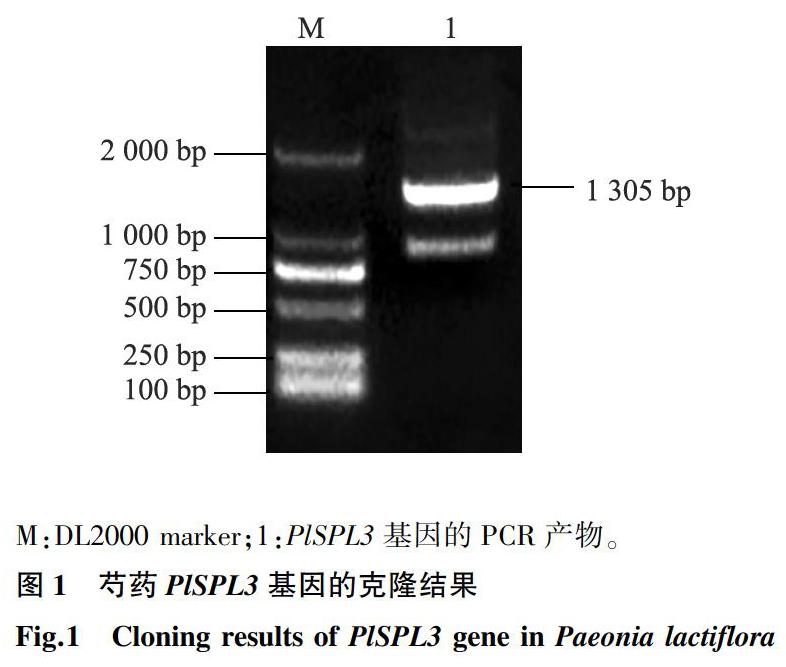
用转录组的差异基因片段设计的上下游引物进行扩增,测序结果表明,扩增得到了大小为1 305 bp的碱基片段,详见图1。
对芍药PlSPL3基因编码氨基酸序列进行BLAST比对分析,结果显示,其与向日葵、藜麦、葡萄、胡桃、木瓜等的SPL基因编码氨基酸序列的相似度达到72.0%~77.3%。随后,用DNAMAN 8.0软件推测芍药PlSPL3基因编码蛋白质的氨基酸序列。
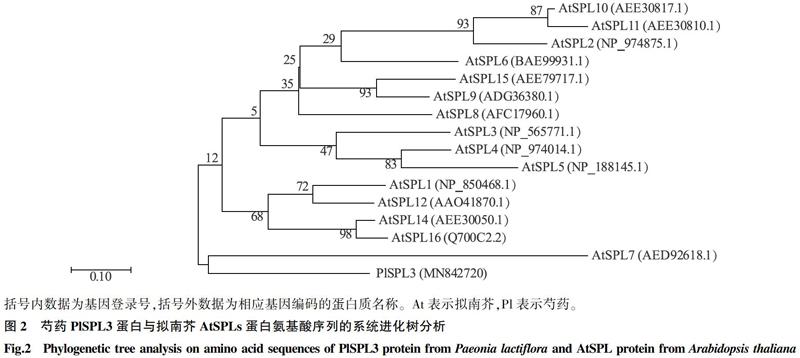
用MEGA 7.0将芍药PlSPL3基因编码蛋白质的氨基酸序列与拟南芥SPLs基因编码蛋白质的氨基酸序列进行对比。由图2可以看出,芍药PlSPL3基因编码蛋白质与拟南芥AtSPL7基因编码蛋白质聚类到一起,表明该片段对应的基因为芍药的SPL基因,GenBank登录号为MN842720。
2.2PlSPL3基因编码蛋白质理化性质与结构预测
通过在线软件ProtParam分析发现,PlSPL3基因编码434个氨基酸,其编码蛋白质的相对分子质量约为50 110.77,总原子数为13 266个,预测其分子式为C2 123H3 361N623O715S33,理论等电点(pI)为4.90,说明其为酸性蛋白。此外,PlSPL3基因编码蛋白质由20种氨基酸组成,其中谷氨酸(Glu)含量最丰富,占比为13.8%;其次为精氨酸(Arg),占比为8.3%;色氨酸(Trp)含量最低,占比为0.2%。PlSPL3基因编码蛋白质的带负电荷氨基酸残基(Asp+Glu)总电荷数为90个,带正电荷氨基酸残基(Arg + Lys)总电荷数为65个,该蛋白质的不稳定系数为70.94,半衰期为30 h,脂肪系数为57.90,平均亲水性系数为-0.949。根据以上数据可以推测,这是一种带负电荷的不稳定亲水性蛋白质。用TMpred进行预测可知,该蛋白质无跨膜螺旋区。将该蛋白质序列输入SignalP 5.0,结果显示,该蛋白质可能具有信号肽切割位点,位于第27位与第28位氨基酸之间的概率较高。
在NCBI上分析PlSPL3基因编码蛋白质的保守结构域发现,该蛋白质具有SBP-box保守结构域,该结果符合典型的SBP-box基因家族的结构特征,说明该基因属于其中一员。SBP结构域由SBP-box编码,所有陆生植物的SBP结构域均较相似[32]。用在线软件GOR4预测PlSPL3基因编码蛋白质的二级结构,结果显示,α-螺旋(Alpha helix, h)占32.72%,延伸链(Extended strand, e)占20.28%,而最大的结构元件是不规则卷曲(Random coil, c),占47.00%。
2.3PlSPL3同源基因编码蛋白质的氨基酸序列对比与进化树的构建
利用NCBI的BlastP对芍药SPL基因编码蛋白质的氨基酸序列进行比对,选取同源性排在前17位的植物,用MEGA 7.0软件构建系统发育树。由图3可以看出,芍药PlSPL3蛋白与其他物种SPL蛋白的系统进化树共分为2个大分支,其中芍药SPL蛋白(PlSPL3)、木瓜SPL蛋白(CpSPL3)、向日葵SPL蛋白(HaSPL3)、无花果SPL蛋白(LnSPL3)属于1个分支,其他14种植物的SPL蛋白属于另1个分支。
2.4PlSPL3基因的表达分析
对比粉玉奴×凤丹白杂交授粉后24 h、36 h与粉玉奴自交授粉后24 h、36 h PlSPL3基因的表達水平。荧光定量试验结果显示,PlSPL3基因的相对表达量在杂交授粉后24 h高于自交授粉后24 h;在杂交授粉后36 h高于自交授粉后36 h;自交授粉后36 h的相对表达量高于自交授粉后24 h的相对表达量,杂交授粉后36 h的相对表达量高于杂交授粉后24 h的相对表达量(图4)。对比杂交与自交结果可以看出,杂交柱头的相对表达量均高于同时期的自交柱头,对杂交处理不同时间的相对表达量进行对比发现,杂交授粉后36 h的相对表达量比杂交授粉后24 h更高,目的基因表达量明显上调。
3讨论
远缘杂交不亲和性主要表现为受精前障碍与胚败育,而牡丹、芍药远缘杂交不亲和的主要原因是受精前障碍[33-34]。SPL转录因子是花发育过程中一个重要的调控枢纽[14]。有研究结果已经明确,SPL基因会影响花粉囊发育及花药开裂[35-37]。SPL基因还可以通过调控植物大小孢子发生和雌雄配子体发育来维持植物的育性[16]。由此可见,SPL基因可能参与了杂交后的生殖发育过程。
自交和杂交后不同时期的荧光定量检测结果表明,杂交授粉后36 h,PlSPL3基因的相对表达量最高,并且在杂交授粉后的2个时段的相对表达量均高于自交,这与之前所测的转录组数据相符合。笔者在前期试验中观察发现,在自交授粉过程中粉玉奴的花粉管发育正常;在杂交授粉过程中,粉玉奴的花粉萌发较少,萌发的花粉管出现扭曲,胼胝质增多,并且在杂交授粉后36 h时表现得较明显[3]。由于杂交不亲和与胼胝质的积累关系密切[38],因此推测PlSPL3基因可能与杂交不亲和有关。曹雪等[39]研究发现,葡萄VvSPL9基因和VvSPL10基因可能参与葡萄营养器官与生殖器官的发育。Unte等[27]研究发现,拟南芥SPL8基因的突变体由于小孢子囊发育异常而生育力低下,敲除SPL8基因后则会影响大孢子发生及雄蕊花丝的延长。Xing等[16]研究发现,SPL基因影响小孢子囊壁的形成,SPL基因功能缺失突变形成了异常花粉囊,进而减少了每个花药内的花粉量,过量表达SPL8基因会引起花药不开裂,最终影响植物的生育力。在本研究中,花粉囊发育及花药开裂均正常,因此推测该基因可能与花粉的进一步发育有关。此外,有研究发现,SPL基因也会影响雌蕊的发育[16],因此推测,授粉后由于异源花粉的刺激,使得花的柱头发育受到影响,从而使花粉在柱头上无法正常萌发或者花粉管无法正常生长,导致牡丹与芍药出现远缘杂交不亲和现象。本试验通过克隆PlSPL3基因的cDNA序列全长,分析其生物信息学功能并检测芍药属自交亲和授粉与杂交不亲和授粉后不同时期PlSPL3基因表达情况,发现该基因在杂交授粉后上调明显,推测其在芍药属远缘杂交不亲和过程中发挥着重要作用,这为从分子水平上探究芍药属远缘杂交不亲和机制提供了理论基础。
参考文献:
[1]白金娟,沈瑞娟,吴月琴,等. 百合远缘杂交子房培养和胚珠培养[C]//中国园艺学会. 花卉优质、高产、高效标准化栽培技术交流会论文集. 昆明:中国园艺学会, 2014: 4-9.
[2]蒋昌华,叶康,高燕,等. 盐胁迫对13种芍药品种部分生理指标的影响研究[J]. 西北林学院学报, 2018, 33(2): 70-74.
[3]贺丹,解梦珺,吕博雅,等. 牡丹与芍药的授粉亲和性表现及其生理机制分析[J]. 西北农林科技大学学报(自然科学版), 2017, 45(10): 129-136.
[4]郝津藜,董晓晓,袁涛, 等. 四种药剂柱头处理对芍药属远缘杂交授粉结实率的影响[J]. 中国农业大学学报, 2019, 24(1): 40-45.
[5]侯祥云,郭先锋. 芍药属植物杂交育种研究进展[J]. 园艺学报, 2013, 40(9): 1805-1812.
[6]马翔龙,吴敬需,刘少华. 伊藤牡丹发展现状与展望[J]. 中国花卉园艺, 2018(16): 28-31.
[7]郝青,刘政安,舒庆艳,等. 中国首例芍药牡丹远缘杂交种的发现及鉴定[J]. 园艺学报, 2008, 35(6): 853-858.
[8]HAO Q, AOKI N, KATAYAMA J, et al. Crossability of American tree peony ‘High Noon′ as seed parent with Japanese cultivars to breed superior cultivars[J]. Euphytica, 2013, 191: 35-44.
[9]王文和,王树栋,赵祥云,等. 百合远缘杂交花粉萌发及花粉管生长过程观察[J]. 西北植物学报, 2007, 27(9): 1790-1794.
[10]郭朋辉,吴景芝,王玉英,等. 紫斑百合远缘杂交亲和性分析及杂交障碍克服[J]. 南方农业学报, 2019, 50(9): 1903-1912.
[11]郝津藜,趙娜,石颜通,等. 黄牡丹远缘杂交亲和性及杂交后代形态分析[J]. 园艺学报, 2014, 41(8): 1651-1662.
[12]HE D, LOU X Y, HE S L, et al. Isobaric tags for relative and absolute quantitation-based quantitative proteomics analysis provides novel insights into the mechanism of cross-incompatibility between tree peony and herbaceous peony[J]. Functional Plant Biology, 2019, 46(5): 417-427.
[13]KERHOAS C, KNOX R B, DUMAS C. Specificity of the callose response in stigmas of Brassica[J]. Annals of Botany, 1983, 52(4): 597-602.
[14]田晶,赵雪媛,谢隆聖,等. SPL转录因子调控植物花发育及其分子机制研究进展[J]. 南京林业大学学报(自然科学版), 2018, 42(3): 159-166.
[15]KLEIN J, SAEDLER H, HUIJSER P. A new family of DNA binding proteins includes putative transcriptional regulators of the Antirrhinum majus floral meristem identity gene SQUAMOSA[J]. Molecular and General Genetics, 1996, 250(1): 7-16.
[16]XING S P, SALINAS M, GARCIA-MOLINA A, et al. SPL8 and miR156-targeted SPL genes redundantly regulate Arabidopsis gynoecium differential patterning[J]. The Plant Journal, 2013, 75(4): 566-577.
[17]YAMAGUCHI A, WU M F, YANG L, et al. The MicroRNA-regulated SBP-box transcription factor SPL3 is a direct upstream activator of LEAFY, FRUITFULL, and APETALA1[J]. Developmental Cell, 2009, 17(2): 268-278.
[18]李明,李长生,赵传志,等. 植物SPL转录因子研究进展[J]. 植物学报, 2013, 48(1): 107-116.
[19]HULTQUIST J F, DORWEILER J E. Feminized tassels of maize mop1 and ts1 mutants exhibit altered levels of miR156 and specific SBP-box genes[J]. Planta, 2008, 229(1): 99-113.
[20]FERREIRA G F, SILVA E M, AZEVEDO M S, et al. microR-NA156-targeted SPL/SBP box transcription factors regulate tomato ovary and fruit development[J]. The Plant Journal, 2014, 78(4): 604-618.
[21]HOU H M, LI J, GAO M, et al. Genomic organization,phylogenetic comparison and differential expression of the SBP-box family genes in grape[J]. PLoS One, 2013, 8(3): e59358.
[22]战新梅,管世铭,张玉喜. 牡丹PsSPL3基因的克隆和表达特性分析[J]. 华北农学报, 2017, 32(4): 13-18.
[23]JUNG J H, LEE H J, RYU J Y, et al. SPL3/4/5 integrate development aging and photoperiod signals into the FT-FD module in Arabidopsis flowering[J]. Molecular Plant, 2016, 9(12): 1647-1659.
[24]GANDIKOTA M, BIRKENBIHL R P, HHMANN S, et al. The miRNA156/157 recognition element in the 3' UTR of the Arabidopsis SBP box gene SPL3 prevents early flowering by translational inhibition in seedlings[J]. The Plant Journal, 2007, 49(4): 683-693.
[25]WANG Z S, WANG Y,KOHALMI S E, et al. SQUAMOSA PROMOTER BINDING PROTEIN-LIKE 2 controls floral organ development and plant fertility by activating ASYMMETRIC LEAVES 2 in Arabidopsis thaliana[J]. Plant Molecular Biology, 2016, 92(6): 661-674.
[26]WEIGEL D, NILSSON O. A developmental switch sufficient for flower initiation in diverse plants[J]. Nature, 1995, 377: 495-500.
[27]UNTE U S, SORENSEN A M, PESARESI P, et al. SPL8, an SBP-box gene that affects pollen sac development in Arabidopsis[J]. The Plant Cell, 2003, 15(4): 1009-1019.
[28]賀丹,王雪玲,高晓峰,等. 牡丹芍药远缘杂交亲和性[J]. 东北林业大学学报, 2014, 2(7): 65-68.
[29]林榕燕,樊荣辉,陈裕德,等. 鸡爪槭ApPSY和ApPDS基因克隆及其表达分析[J].核农学报,2019, 33(12): 2338-2346.
[30]赖呈纯,潘红,黄贤贵,等. 刺葡萄愈伤组织UFGT基因克隆及表达分析[J].核农学报,2019, 33(9): 1677-1685.
[31]THOMAS D S, KENNETH J L. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108.
[32]GUO J,SONG J,WANG F, et al. Genome-wide identification and expression analysis of rice cell cycle genes[J]. Plant Molecular Biology, 2007, 64(4): 349-360.
[33]贺丹,高小峰,吕博雅,等. 牡丹、芍药花芽分化的形态学研究[J]. 河南农业科学, 2014, 43(12): 117- 120.
[34]律春燕,王雁,朱向涛,等. 黄牡丹花粉生活力测定方法的比较研究[J]. 林业科学研究, 2010, 23(2): 272-277.
[35]NODINE M D, BARTEL D P. MicroRNAs prevent precocious gene expression and enable pattern formation during plant embryogenesis[J]. Genes and Development, 2010, 24(23): 2678-2692.
[36]LIU N, TU L L, WANG L C, et al. MicroRNA 157-targeted SPL genes regulate floral organ size and ovule production in cotton[J]. BMC Plant Biology, 2017, 17(1): 7.
[37]SHIKATA M, KOYAMA T, MITSUDA N, et al. Arabidopsis SBP-box genes SPL10,SPL11 and SPL2 control morphological change in association with shoot maturation in the reproductive phase[J]. Plant and Cell Physiology, 2009, 50(12): 2133-2145.
[38]张姣,朱启迪,巨岚,等. 小麦生理型雄性不育系微丝骨架和胼胝质的变化与其相关基因的表达分析[J]. 中国农业科学, 2015, 48(14): 2687-2696.
[39]曹雪,王晨,房经贵,等. 葡萄SPL9和SPL10基因全长cDNA克隆、亚细胞定位和表达分析[J]. 园艺学报, 2011, 38(2): 240-250.
(责任编辑:徐艳)
