番木瓜干旱胁迫相关CpDHN基因的克隆与原核表达
2020-02-22郭静远邹智孔华郭运玲郭安平
郭静远 邹智 孔华 郭运玲 郭安平

摘 要:本研究基于转录组获得的CpDHN转录本序列,以番木瓜‘台农二号组培苗叶片为材料,采用RT-PCR技术克隆了该基因包含完整ORF在内的425 bp cDNA序列。序列分析表明,CpDHN预测编码93个氨基酸,其理论分子量为10.50 kDa、等电点为6.62、总平均疏水指数为?1.984、核定位。除保守的K片段外,蛋白还含有1个S片段,可归为KS型脱水素。在拟南芥中的10个脱水素中,CpDHN与AtLEA8的亲缘关系最近,相似性为53.3%。值得注意的是,虽然CpDHN的编码区不存在内含子,但其3UTR含有1个与AtLEA8类似的内含子。表达谱分析显示,该基因在根和叶片中均受干旱胁迫诱导。此外,还构建了CpDHN的原核表达载体,SDS-PAGE分析显示,该蛋白在大肠杆菌中可高效表达。这些结果为下一步的功能鉴定奠定了坚实的基础。
关键词:番木瓜;脱水素;基因克隆;表达分析;原核表达
中图分类号:S59;S813.3 文献标识码:A
Abstract: Based on de novo assembled transcript sequences, a 425-bp cDNA of CpDHN, which includes the complete coding sequence, was isolated from the leaf tissue of papaya (Carica papaya L.) cultivar Tainong No.2 by using RT-PCR. Sequence analysis revealed CpDHN putatively encodes 93 amino acids, which was predicted to target the nuclear, harboring a theoretical molecular weight of 10.50 kDa, an isoelectric point value of 6.62, and a GRAVY value of ?1.984. CpDHN belongs to the KS-type dehydrin, which includes one conserved K-segment as well as one S-segment. Among ten family members present in Arabidopsis, CpDHN exhibits the highest sequence similarity of 53.3% with AtLEA8. Similar to AtLEA8, CpDHN contains no intron in the coding region but harbor one in the 3UTR. Transcriptional profiling revealed that this gene was significantly regulated by drought stress in two of three tissues examined in this study, i.e., root and leaf. Moreover, the prokaryotic expression vector of CpDHN was also successfully constructed, and SDS-PAGE showed that the protein could accumulate at considerably high level in Escherichia coli. Results obtained from this study provide a basis for further functional analysis.
Keywords: papaya (Carica papaya L.); dehydrin; gene clone; expression analysis; prokaryotic expression
DOI: 10.3969/j.issn.1000-2561.2020.12.006
脫水素(dehydrin),又名第二类胚胎发育晚期丰富蛋白(late embryogenesis abundant protein, LEA)[1],是一类广泛存在于种子植物、苔藓、藻类、酵母和蓝细菌等中的亲水型蛋白,在低温、干旱、高盐等非生物逆境胁迫下可维持植物细胞的正常代谢以及细胞膜结构的稳定性[2]。脱水素的分子量在9~200 kDa不等[3],结构上常包含3类保守的基序,即K、S和Y片段,K片段是一个高度保守的富含Lys的基序,存在于所有家族成员中;S片段主要由丝氨酸残基组成,包含磷酸化位点,与蛋白的核定位有关;Y片段位于N端,存在于部分家族成员中,但其功能目前还不是很清楚。根据这3类基序的存在与分布顺序,脱水素可以分为YnSK2、Kn、SKn、KnS和Y2Kn等5种类型[4]。
番木瓜(Carica papaya L.),隶属于双子叶植物纲番木瓜科番木瓜属(Carica),与模式植物拟南芥(Arabidopsis thaliana)同属十字花目。番木瓜原产于美洲南部和中部,目前广泛种植于热带和亚热带地区。在我国,番木瓜主要分布于华南地区如海南、广东、广西和福建等省(区),此外,在云南和四川也有少量种植。作为典型的热带作物,番木瓜可全年开花和持续结果,在我国种植区易受低温和干旱胁迫的影响[5-6],严重影响产量和品质。因此,开展番木瓜抗逆生物学研究具有重要的理论意义和应用价值。
本研究重点报道一个干旱胁迫相关的CpDHN基因,包括其基因结构、序列特征、表达特性以及原核表达情况,以期为进一步的功能鉴定奠定基础。
1 材料与方法
1.1 材料
供试材料为‘台农二号番木瓜组培苗。番木瓜的基因组数据下载于Phytozome v12(https://phytozome.jgi.doe.gov/pz/portal.html),转录组数据下载于NCBI SRA数据库(https://www. ncbi.nlm.nih.gov/sra/)。
1.2 方法
1.2.1 总RNA提取和cDNA合成 取番木瓜组培苗叶片50 mg,参照RNAprep pure植物总RNA提取试剂盒(天根生物公司)说明书提取总RNA,然后采用DNase I酶(Promega公司)清除RNA样本中可能残留的DNA。双链cDNA的合成参照TaKaRa公司Prime ScriptTMRT reagent Kit进行。
1.2.2 番木瓜CpDHN基因的克隆 CpDHN的转录本来源于本研究团队从头(de novo)组装的转录组,为实验克隆该基因,在基因的5和3UTR设计引物对(CpDHNF: 5-ATTGATCTTCGTTCGGAGTTT-3和CpDHNR: 5-ATCCCACAAGGAAGGAAACAG-3),参照文献[7]中的方法进行第1轮PCR,PCR产物采用1%的琼脂糖凝胶电泳进行检测。为将目标片段克隆到pET-32a(+)载体,同时在开放读码框(ORF)的两侧设计引物对(CpDHNHF: 5-ACCGACGACGACGACAAGATGGCTGAACACCACGAGAGC-3和CpDHNHR: 5-GCAGCCGGATCTCAGTGGTTAATCTGACGTCTCTTTCTT-3),该引物的两侧包含可以与pET-32a(+)载体进行同源重组的同源臂。通过以第1轮PCR产物作为模板,进行第2轮PCR,其反应体系和反应程序与第1轮PCR一致。PCR产物经1%琼脂糖凝胶电泳检测后,将目的条带进行切胶回收。
用BamHⅠ和NcoⅠ对pET-32a(+)质粒进行酶切(37 ℃,12 h),酶切产物经1%琼脂糖凝胶电泳检测后回收目的条带。然后,参照诺唯赞公司ClonExpress II One Step Cloning Kit (C112-02)试剂盒说明书,将线性化载体和第2轮PCR胶回收产物按比例混合,在ExnaseⅡ催化下,37 ℃、30 min,完成两线性化DNA的体外环化,构建pET-32a(+)-CpDHN原核表達载体。将重组产物转化大肠杆菌菌株DH5α,挑取菌落PCR正确的单克隆进行测序确认,然后选取测序结果正确的单菌落进行扩大培养并提取质粒备用。
1.2.3 CpDHN的序列分析 利用序列处理在线工具包(SMS)(http://www.bio-soft.net/sms/)对ORF进行分析并翻译成蛋白质,利用(http://web. expasy.org/protparam/)对CpDHN编码蛋白的理化性质进行分析预测,利用Protscale(http://cn. expasy.org/tools/protscale.html)分析亲水性/疏水性,利用TMHMM软件(http://www.cbs.dtu.dk/ services/TMHMM/)预测蛋白的跨膜结构,利用(http://npsa-pbil.ibcp.fr/)进行二级结构的预测,利用MEGA6.0软件将CpDHN蛋白与已报道的部分脱水素进行多序列比对并构建进化树。
1.2.4 基因的表达特性分析 参照文献[7]的方法,利用转录组数据(SAMN09096786)[8]分析基因在根、叶片和韧皮部树液中的表达模式及其对干旱胁迫的响应模式:植株为3月龄的种子苗,以正常浇水的作为对照,断水10 d和20 d分别定义为轻度和重度干旱胁迫,每个处理设置2次生物学重复。
1.2.5 CpDHN基因在大肠杆菌E. coli BL21中的表达 将重组质粒pET-32a(+)-CpDHN和对照质粒pET-32a(+)分别转化大肠杆菌菌株BL21,分别命名为BL-CpDHN和BL-pET32a。挑取菌落PCR正确的单克隆于含卡那霉素(50 mg/L)的LB液体培养基中,37 ℃振荡培养过夜,次日按1%体积比接种,37 ℃、200 r/min培养至OD=0.6,经IPTG(终浓度0.8 mmol/L,37 ℃,200 r/min)诱导4 h后,细胞裂解后离心,取上清进行SDS- PAGE分析。
2 结果与分析
2.1 番木瓜CpDHN基因克隆
在前期的研究中,本研究团队采用从头组装的方法构建了番木瓜不同组织的转录组文库。搜索该文库发现存在2条长度分别为1309 bp和750 bp的转录本,二者的ORF均为282 bp,其差别在于前者的3UTR可能存在1个559 bp的内含子。为证实该结果,将这2条转录本比对到番木瓜的基因组,发现它们确实属于同一基因座(命名为CpDHN)的2种可变剪接形式,基因的编码区无内含子,而3UTR存在1个内含子(图1A),该内含子在长的转录本中被保留了下来。为进一步证实该基因的转录模式,进一步搜索了NCBI中番木瓜的表达序列标签(EST)数据库,在获得的59条EST中,绝大多数支持3UTR内含子的存在,而另外3条则支持该内含子存在滞留,这与转录组数据结果是一致的(图1B)。
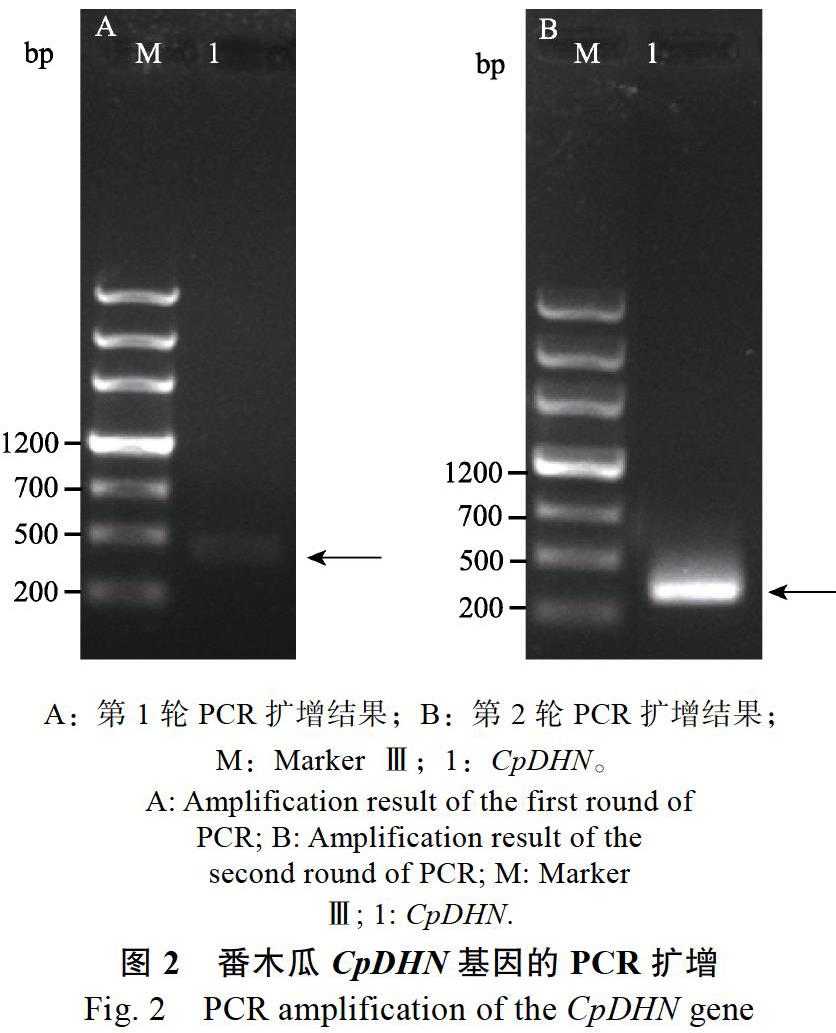
随后,以番木瓜叶片组织反转录的cDNA为模板,以CpDHNF/R为引物对该基因进行实验克隆。首轮PCR成功扩增到一条近500 bp的特异条带(图2A)。然后,研究以第1轮PCR产物作为模板、以CpDHNHF/R作为引物进行第2轮PCR,成功扩增到约300 bp的特异条带(图2B)。目标片段切胶回收后采用同源重组的方法克隆到pET-32a(+),筛选单克隆进行测序分析。
2.2 CpDHN基因的生物信息学分析
2.2.1 CpDHN基因的序列分析 测序结果表明,分离到的cDNA与基因和转录本的对应区域完全一致。CpDHN预测编码93个氨基酸(图2A),蛋白含有1个K片段和1个S片段,属于KS型脱水素。
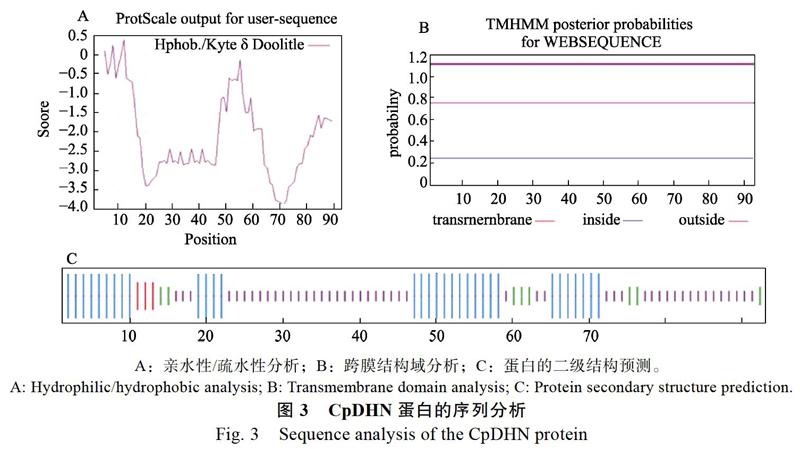
2.2.2 CpDHN基因及其编码蛋白的一级结构 Protparam分析表明,CpDHN的理论分子量为10.50 kDa,等电点为6.62;主要氨基酸组成依次为赖氨酸(20.4%)、组氨酸(19.9%)、谷氨酸(17.2%)和甘氨酸(16.1%);负电荷氨基酸总数(Asp+Glu)为23,正电荷氨基酸总数(Arg+Lys)为20;不稳定系数为39.07;总平均疏水指数(GRAVY)为?1.984。Protscale分析进一步证实CpDHN主要表现为疏水性(图3A)。这表明CpDHN是一个高度亲水的稳定蛋白。
2.2.3 蛋白的亚细胞定位和跨膜结构域分析 Wolf PSORT分析表明,CpDHN蛋白主要定位在细胞核。TMHMM分析表明该蛋白无跨膜结构(图3B)。
2.2.4 蛋白的二级结构预测 通过在线软件http://npsa-pbil.ibcp.fr/对CpDHN蛋白进行二级结构预测,结果表明,CpDHN的二级结构主要以α-螺旋(图3C中蓝色竖线)为主,占整个氨基酸序列的36.56%,8.6%为β-转角(图3C中绿色竖线),3.23%为伸展链(图3C中红色竖线),其他为无规则卷曲(图3C)。
2.2.5 多序列比对与进化分析 将CpDHN编码的氨基酸序列与已报道的10个拟南芥脱水素基因[13]推导的氨基酸序列进行多序列比对,同源分析表明,CpDHN与AtLEA8(AT1G54410.1)序列相似性最高,为53.3%,而与其余9个脱水素的相似性介于13.5%~19.2%之间(图4)。进一步的进化分析表明,CpDHN与AtLEA8聚在同一支,二者含有序列完全一致的K片段,同属KS型脱水素(图5)。
2.3 CpDHN基因的表达特性分析
表达分析显示,CpDHN在根、叶片和韧皮部树液中均有表达,其丰度依次为树液、根和叶片。干旱胁迫处理10 d和20 d后,除树液外,该基因K片段用阴影标识,S片段用方框标识,Y片段用下划线标识。
在根和叶片中的表达水平均随处理时间的延长而逐步上升,干旱处理10 d后,该基因在叶片中存在2.3倍的上调表达;干旱处理20 d后,该基因在根和叶片中分别存在2.1倍和3.7倍的上调表达(图6)。
2.4 CpDHN在原核细胞中的表达
为探讨CpDHN能否在原核细胞中进行高效表达,将重组质粒pET-32a(+)-CpDHN和对照质粒pET-32a(+)分别转化大肠杆菌BL21,取1%过夜培养的菌液在37 ℃、200 r/min条件下培养至OD=0.6后,用0.8 mmol/L IPTG诱导4 h,取裂解上清进行SDS-PAGE分析。结果显示,在对照BL-pET32a细胞的上清中检测到1条约20 kDa的特异性条带(TrxA-intein融合蛋白的理论分子量为20.4 kDa),而在BL-CpDHN的细胞上清中检测到1条约30 kDa的特异条带(TrxA-CpDHN融合蛋白的理论分子量为28.07 kDa)(图7),这表明,CpDHN可在原核细胞中高效表达,且为可溶性蛋白。
3 讨论
植物的自然生长环境是由一系列复杂的非生物胁迫和生物胁迫组成的。随着全球水资源短缺、土地盐渍化加剧以及荒漠化土地面积的增加,非生物胁迫已经成为影响植物分布和生长发育的重要限制因子[9]。据不完全统计,全球只有不到10%的耕地免受严重非生物胁迫的影响[10],而受到干旱影响的耕地高达45%[11]。因此,积极筛选和鉴定相关的抗性基因变得刻不容缓。
脱水素是植物生长发育过程中的关键蛋白,在提高植物对非生物胁迫的抗性方面发挥着重要作用。研究表明,棉花脱水素基因GhDHN03和GhDHN04被敲除后,其渗透胁迫和盐胁迫的耐受能力显著降低[12];沙冬青脱水素基因AmDHN132在拟南芥中的过表达改善了拟南芥的耐盐性、渗透性和耐寒性[13];辣椒脱水素基因CaDHN4在拟南芥中过表达可提高转基因植株对低温和盐胁迫的耐受能力[14]。然而,至今尚无有关番木瓜脱水素的报道。
本研究首次报道了番木瓜脱水素基因CpDHN,该基因的编码区不存在内含子,预测编码93个氨基酸,属于稳定的(不稳定系数<40)、高度亲水(GRAVY
根据蛋白中K、S和Y等3类保守基序的存在模式,拟南芥的10个脱水素分为5种类型,即SKn(AtLEA4、AtLEA5、AtLE10、AtLEA34和AtLEA44)、Kn(AtLEA33)、YnSK2(AtLEA51和AtLEA14)、Y2Kn(AtLEA45)和KnS(AtLEA8)[4]。CpDHN包含1个K片段和1个S片段,与AtLEA8同属KS型脱水素,其K片段序列与AtLEA8的K片段序列完全一致,为HKEGIVDKIKDKIHG,这有别于大部分脱水素K片段序列组成(EKKGIMDKIKEKLPG)。K片段存在于所有脱水素中,能形成脱水素的重要功能结构——双亲性α-螺旋[20],α-螺旋横向插入膜中通过与膜脂结合,对生物膜和蛋白质的结构起到稳定作用,从而阻止细胞内水分的过多流失[19]。不同脱水素的K片段序列存在一些单氨基酸替换和结构修饰,其他研究中报道过同样的情况,Allagulova等[21]对花旗松脱水素cDNA片段的测序和相应氨基酸序列分析结果表明,其K片段由以下氨基酸组成(Q/E)K(P/A)G(M/L)LDKIK(A/Q)(K/M)(I/L)PG。除AtLEA33和AtLEA45外,其他脱水素均含有S片段,S片段主要由丝氨酸残基组成,研究表明S片段的磷酸化有助于脱水素在信号肽的引导下进入细胞核[22]。此外,AtLEA14、AtLEA45和AtLEA51中还含有Y片段,其确切功能还有待深入研究。
研究進一步表明CpDHN在根、叶和树液中均有表达,且在前2种组织中均受干旱胁迫诱导。事实上,其他物种中的研究结果表明脱水素基因广泛受低温、干旱、高盐等非生物逆境胁迫诱导[23]。此外,本研究还成功构建了CpDHN的原核表达载体,并证实其蛋白可在大肠杆菌中高水平积累,这为在原核生物和植物体内中进一步研究其生物学功能奠定了坚实的基础。
参考文献
Bray E A. Molecular responses to water deficit[J]. Plant Physiology, 1993, 103(4): 1035-1040.
Close T J. Dehydrins: A commonalty in the response of plants to dehydration and low temperature[J]. Physiologia Plantarum, 1997, 100(2): 291-296.
翟大勇, 沈黎明. 脱水蛋白研究进展[J]. 生物化学与生物物理进展, 1998(2): 3-5.
Close T J. Dehydrins: Emergence of a biochemical role of a family of plant dehydration proteins[J]. Physiologia Plantarum, 1996, 97(4): 795-803.
Beniwal V S, Sarina Laura J. Drought and salt tolerance screening of papaya (Carica papaya L.) cultivars using in vitro techniques[J]. Acta Horticulturae, 2010(851): 209-212.
Allan P. Carica papaya responses under cool subtropical growth condition[J]. Acta Horticulturae, 2002(575): 757- 763.
邹 智, 杨礼富, 安 锋, 等. 橡胶树AtCAB1同源基因的克隆及其在稳定与衰老期叶片中的差异分析[J]. 热带农业科学, 2013, 33(4): 30-35.
Gamboa-Tuz S D, Pereira-Santana A, Zamora-Brise?o J A, et al. Transcriptomics and co-expression networks reveal tissue-specific responses and regulatory hubs under mild and severe drought in papaya (Carica papaya L.)[J]. Scientific Reports, 2018, 8(1): 14539.
Vinocur B, Altman A. Recent advances in engineering plant tolerance to abiotic stress: Achievements and limitations[J]. Current Opinion in Biotechnology, 2005, 16(2): 123-132.
Ashraf M, Wu L. Breeding for salinity tolerance in plants[J]. Critical Reviews in Plant Sciences, 1994, 13(1): 17-42.
Ashraf M, Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2005, 59(2): 206-216.
Kirungu J N, Magwanga R O, Pu L, et al. Knockdown of Gh_A05G1554 (GhDHN_03) and Gh_D05G1729 (GhDHN_ 04) dehydrin genes, reveals their potential role in enhancing osmotic and salt tolerance in cotton[J]. Genomics, 2020, 112(2): 1902-1915.
Nguyen P N, Tossounian M A, Kovacs D S, et al. Dehydrin ERD14 activates glutathione transferase Phi9 in Arabidopsis thaliana under osmotic stress[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2019, 1864(3): 129506.
Zhang H F, Liu S Y, Ma J H, et al. CaDHN4, a salt and cold stress-responsive dehydrin gene from pepper decreases abscisic acid sensitivity in Arabidopsis[J]. International journal of molecular sciences, 2019, 21(1): 26.
Laloum T, Guiomar Martín, Duque P. Alternative splicing control of abiotic stress responses[J]. Trends in Plant Science, 2018, 23(2): 140-150.
Ner-Gaon H, Halachmi R, Savaldi-Goldstein S, et al. Intron retention is a major phenomenon in alternative splicing in Arabidopsis[J]. The Plant Journal, 2004, 39(6): 877-885.
Haas B J, Delcher A L, Mount S M, et al. Improving the Arabidopsis genome annotation using maximal transcript alignment assemblies[J]. Nucleic Acids Research, 2003, 31(19): 5654-5666.
Zhu W, Brendel S V. Refined annotation of the Arabidopsis genome by complete expressed sequence tag mapping[J]. Plant Physiology, 2003, 132(2): 469-484.
Candat A, Paszkiewicz G, Neveu M, et al. The ubiquitous distribution of late embryogenesis abundant proteins across cell compartments in Arabidopsis offers tailored protection against abiotic stress[J]. The Plant Cell, 2014, 26(7): 3148- 3166.
Baker J, Dennsteele C V, Dure L. Sequence and characterization of 6 Lea proteins and their genes from cotton[J]. Plant Molecular Biology, 1988, 11(3): 277-291.
Allagulova C R, Gimalov F R, Shakirova F M, et al. The plant dehydrins: Structure and putative functions[J]. Biochemistry Biokhimiia, 2003, 68(9): 945-951.
Jensen A B, Goday A, Mercè F, et al. Phosphorylation mediates the nuclear targeting of the maize Rab17 protein[J]. The Plant Journal, 1998, 13(5): 691-697.
孫 歆, 雷 韬, 袁 澍, 等. 脱水素研究进展[J]. 武汉植物学研究, 2005, 23(3): 299-304.
