白藜芦醇通过诱导自噬减少肥胖小鼠骨骼肌组织GDF8表达的研究
2020-02-18费云飞徐冬梅曹琼琼徐结苟鲁云霞
费云飞,陈 莉,徐冬梅,曹琼琼,徐结苟,鲁云霞
(1. 安徽医科大学生物化学教研室,安徽 合肥 230032; 2.中国科技大学附属第一医院检验科,安徽 合肥 230001;3.安徽医科大学免疫学教研室,安徽 合肥 230032)
骨骼肌是糖脂代谢的重要组织,肥胖可造成脂肪组织在肌组织中的积累以及肌肉萎缩,有氧代谢的Ⅰ型纤维减少和酵解代谢的Ⅱ型纤维增加[1]。 白藜芦醇(resveratrol, RES)具有抗炎、抗氧化、抗肿瘤和延缓衰老等功效,代谢组学研究揭示RES在腹部肌肉组织中通过调节多条代谢途径和代谢物的水平来降低饮食诱导的代谢风险[2]。
自噬-溶酶体系统负责肌肉,特别是肌肉萎缩时蛋白质的降解,越来越多的证据表明,自噬为维持肌肉质量和肌肉干细胞的再生功能所必需[3]。已知由白藜芦醇介导的自噬流恢复可防止骨骼肌细胞衰老和改善胰岛素抵抗[4],但白藜芦醇是否影响肥胖小鼠骨骼肌组织中的自噬尚未见文献报道。
GDF8(growth differentiation factor 8)基因是转化生长因子TGFβ 家族的一员,其表达产物myostatin是体内重要的肌肉生长抑制因子[5]。肥胖可通过增加GDF8的表达来退行性地减少肌肉的质量和功能[6]。已有研究表明GDF8的失活可导致AMPK水平和活性升高,造成骨骼肌的胰岛素敏感性增加[7]。我们推测白藜芦醇可能通过激活骨骼肌组织中的自噬水平来减少GDF8的表达。白藜芦醇是天然无毒化合物,但作用较缓慢,因此参照文献选取单一剂量白藜芦醇(400 mg·kg-1·d-1)灌胃治疗20周[8]。
1 材料与方法
1.1 实验材料
1.1.1实验动物 C57 BL/6雄性(♂)清洁级小鼠24只,7 weeks,由安徽医科大学实验动物中心提供(合格证编号SCXK(皖)2011-001),12 h日/夜交替,自由进食,相对湿度40%~60%,适应性喂养1周后随机分组进行实验。
1.1.2药物与试剂 高脂饲料购自北京峁思倍科生物技术有限公司,HD001,蛋白质19.6%,碳水化合物46.4%,脂肪34.0%。白藜芦醇(阿拉丁公司,R107315);RNAStore样品保存液、TRIzol试剂和逆转录试剂盒RevertTMFirst Strand cDNA Synthesis Kit(Clontech TaKaRa);LC3、p62、GDF8引物购自通用生物系统(安徽)有限公司,GAPDH、SIRT1引物购自上海生工生物有限公司。Rabbit Anti-myostatin一抗购于Bioss公司(货号:bs-1288R);SIRT1 Mouse mAb、LC3 Rabbit mAb购买于CST公司(货号:#8459、#4445),Anti-p62一抗购买于Millipore公司(货号:#MABC32);羊抗兔或羊抗鼠酶标二抗购自Affinity公司。
1.1.3仪器 罗氏7600 d全自动生化分析仪;TG1650-WS高速离心机(上海卢湘仪有限公司); 德国莱卡 RM2235型石蜡切片机;TECHNE TC-512 PCR仪(英国公司);041BR型电泳仪和电转移、电泳槽(BIO-RAD);Western blot曝光仪(上海勤翔3600型),凝胶成像仪(上海勤翔GenoSens1580型)。
1.2 方法
1.2.1分组及模型制备 将C57 BL/6小鼠随机分为标准饮食组(SCD)、标准饮食+胃饲白藜芦醇组(SCD+RES)、高脂组(HFD)和高脂+胃饲白藜芦醇组(HFD+RES)。后两组均为HFD喂养,HFD+RES组和SCD+RES组在HFD和SCD的同时用白藜芦醇(400 mg·kg-1·d-1)灌胃,治疗20周。操作均遵守安徽医科大学实验动物伦理委员会要求。
1.2.2血清学指标检测 所有小鼠于前日禁食12小时,称取体质量,2%戊巴比妥腹腔麻醉,腹主动脉负压采血,颠倒混匀含有分离胶的真空采血管后静置,5 000 r·min-1离心10 min,留取血清样本,分析每只小鼠血清的TG、TC、HDL-C、LDL-C水平。完全剥离小鼠的肌肉组织,1/3的肌肉组织于4%多聚甲醛固定液中固定,1/3的肌肉组织于DEPC水清洗后置于RNA保护液中暂存,转存于-80 ℃冰箱中备用,剩余1/3的肌肉组织于液氮中暂存过夜,转入-80 ℃冰箱保存备用。
1.2.3HE染色 制备4%的中性多聚甲醛,取每只小鼠的部分骨骼肌组织,PBS清洗,于固定液中固定,1周内更换固定液2~3次,制备组织切片,常规Hematoxylin-eosin染色,光镜下观察,拍照并分析。
1.2.4免疫组化分析 多聚甲醛固定骨骼肌组织,行组织脱水处理,制备包埋块,连续厚4 μm切片,脱蜡、脱水处理,免疫组化制片,随后进行Myostain、SIRT1、LC3、p62的一抗4~8 ℃过夜孵育,二抗室温孵育,待完成制片,染色后光镜下观察,拍照并软件分析各组积分光密度值(IOD)。
1.2.5RT-PCR 电子天平称取0.1 g骨骼肌组织,提取Total RNA,测量总RNA浓度,根据所测浓度调节RNA上样量,逆转录合成cDNA,在PCR仪上进行扩增,产物经电泳分离后,拍照并分析灰度值,以目的基因灰度值/GAPDH灰度值来表示mRNA水平。目的基因及引物序列见Tab 1。

Tab 1 Primer sequences for target genes
1.2.6Western blot 每组选取3只小鼠称取100 mg骨骼肌组织,裂解提取各组骨骼肌组织的Protein,测量各组protein浓度,根据测量浓度调节上样量,12% SDS-PAGE电泳分离,转膜,于β-actin(1 ∶2 500)、LC3(1 ∶1 000)、p62(1 ∶2 000)、myostatin(1 ∶500)、SIRT1(1 ∶1 000)一抗中,4~8 ℃摇床孵育过夜,漂洗,二抗(1 ∶10 000)室温2 h,漂洗,显色成像,Western blot软件分析灰度值,以目的蛋白 /β-actin来表示目的蛋白水平,实验重复3次。

2 结果
2.1 白藜芦醇对肥胖小鼠血脂指标的影响结果如Tab 2所示,与SCD组比较,标准饮食的小鼠给予白藜芦醇胃饲,两组间小鼠体质量和血脂各项指标略有变化。然后与SCD组小鼠相比,高脂饮食导致小鼠过度肥胖,其血脂指标中HDL-C降低(P<0.05或P<0.01),同时TC、TG、LDL-C均明显高于SCD组,对于高脂饮食所致的肥胖小鼠给予白藜芦醇治疗,其血脂指标中TC、TG、LDL-C均低于HFD组(P<0.05),而HDL-C与HFD组比较明显升高(P<0.05)。
2.2 白藜芦醇对肥胖小鼠骨骼肌病理学的影响HE结果显示,标准饮食(SCD)小鼠与标准饮食胃饲白藜芦醇(SCD+RES)小鼠的形态学差异无显著性(P>0.05)。与SCD组相比,高脂饮食所致肥胖小鼠的骨骼肌组织中肌纤维间有明显的脂质沉积。而给予白藜芦醇治疗的小鼠骨骼肌组织的脂质沉积消失(Fig 1)。
2.3 白藜芦醇对肥胖小鼠免疫组化的影响标准饮食和标准饮食胃饲白藜芦醇两组小鼠的GDF8、LC3、p62、SIRT1均表达于胞质中,且差异无统计学意义(P>0.05)。与SCD组相比,HFD所致的肥胖小鼠骨骼肌中GDF8和p62的表达呈增高趋势(P<0.05,P<0.001),LC3和SIRT1表达水平相对较低(P<0.05,P<0.01);而白藜芦醇治疗的肥胖小鼠骨骼肌中GDF8和p62表达明显下降(P<0.05,P<0.01),而LC3和SIRT1的表达水平呈增高趋势(P<0.05)(Fig 2)。
Tab 2 Effects of RES on body mass and serum lipids in hyperlipidemic
*P<0.05,**P<0.01vsSCD;#P<0.05,##P<0.01vsHFD
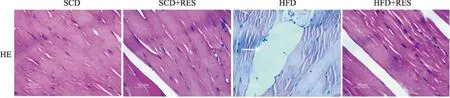
Fig 1 Morphology of skeletal muscle tissues of mice(HE staining,×400)
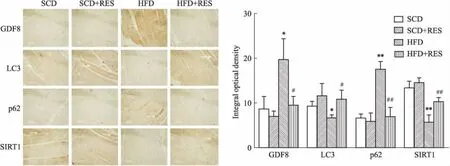
Fig 2 Immunohistochemical results of GDF8, LC3, p62, SIRT1 in skeletal muscle tissues of
*P<0.05,**P<0.01vsSCD;#P<0.05,##P<0.01vsHFD. White arrows show positive areas in the skeletal muscle tissues.
2.4 白藜芦醇对高脂血症小鼠mRNA表达的影响与SCD组相比,HFD导致小鼠肥胖,进而使骨骼肌中SIRT1、LC3的mRNA 表达降低(P<0.05),而p62、GDF8的mRNA表达明显升高(P<0.05);与HFD组相比,白藜芦醇治疗组骨骼肌中SIRT1、LC3的目的基因表达明显升高(P<0.05),p62、GDF8 目的基因表达量降低(P<0.05)(Fig 3)。
2.5 白藜芦醇对高脂血症小鼠蛋白质表达的作用与标准饮食的小鼠相比,高脂饮食所致的小鼠骨骼肌中SIRT1、LC3 protein相对含量较低(P<0.05),同时,p62、GDF8 水平相对较高,且差异有统计学意义(P<0.05);与HFD组相比,白藜芦醇治疗的肥胖小鼠(HFD+RES)骨骼肌中SIRT1、LC3 蛋白质表达升高(P<0.05),p62、GDF8 蛋白质表达明显降低(P<0.05)(Fig 4)。
3 讨论
骨骼肌是参与脂代谢的重要组织,脂类的分解代谢提供了静息肌肉能量利用的很大比例,但长期的高脂饮食反而会造成骨骼肌的代谢障碍。本实验结果显示,高脂饮食可导致脂肪组织在骨骼肌组织中的积累p62和GDF8的表达升高、伴随着SIRT1、LC3的表达降低,白藜芦醇则通过激活骨骼肌组织中SIRT1的表达来促进以LC3II表达升高、p62表达降低为代表的自噬体的形成,以降解高脂饮食时诱导生成的过多的myostatin。
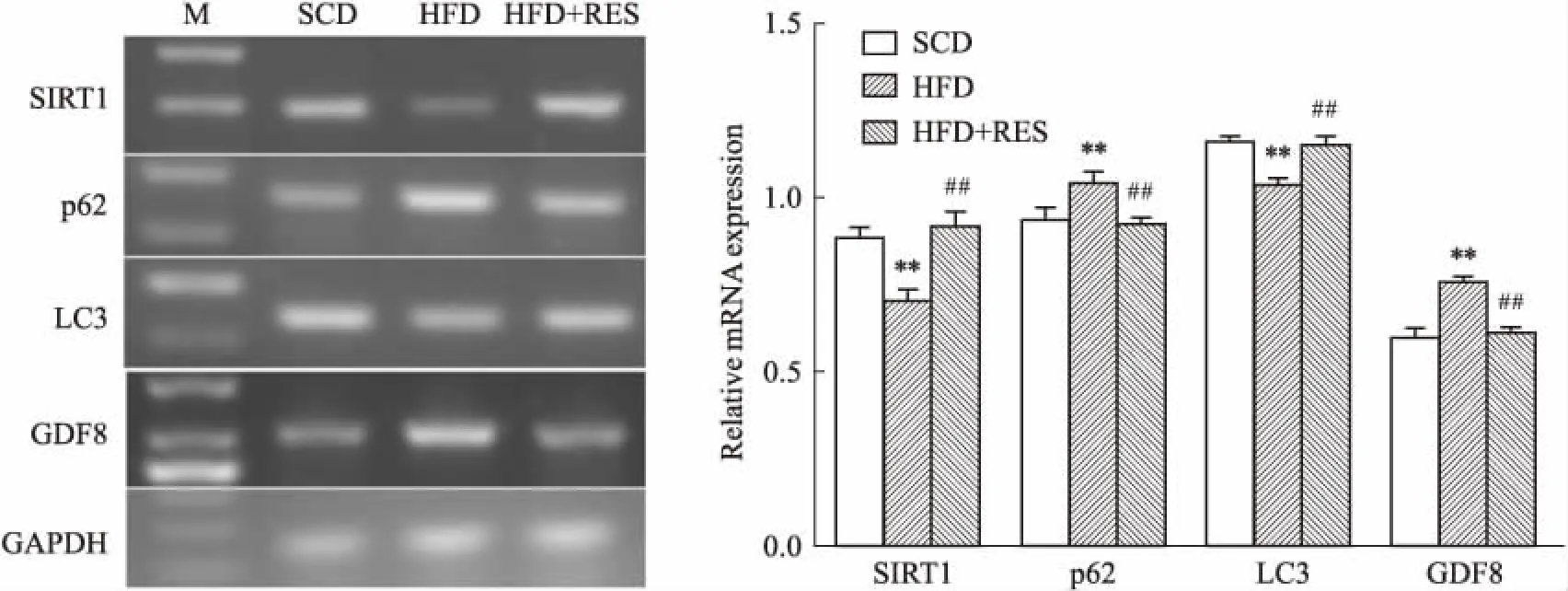
Fig 3 RT-PCR results of GDF8, LC3, p62, SIRT1 in skeletal muscle tissues of
**P<0.01vsSCD;##P<0.01vsHFD
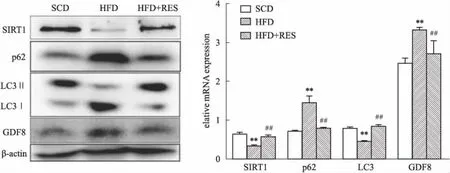
Fig 4 Western blot results of GDF8, LC3, p62, SIRT1 in skeletal muscle tissues of
**P<0.01vsSCD,##P<0.01vsHFD
过度的脂肪摄入通过细胞损伤和炎症引起代谢性疾病的进展,此即为“脂毒性”。已有研究表明,高脂饮食可引起肾近曲小管细胞内溶酶体功能的异常,造成自噬流的受损[9]。骨骼肌作为高代谢器官,对高脂饮食中的饱和脂肪酸特别敏感,棕榈酸可诱导自噬活性降低,表现为减少自噬体形成的标志物LC3II的表达[10],白藜芦醇作为SIRT1 的强激活剂可诱导自噬[11],与本研究的结果一致。另有文献报道白藜芦醇可通过不同的机制激活AMPK和SIRT1,上调Atg5和Atg12的基因表达,增加LC3脂化来调节自噬[12-13]。
myostatin是1997年由美国John Hopkins 大学医学部研究人员在小鼠骨骼肌中发现的新型生长因子。GDF8 基因缺失可诱导肌肉量增加,降低脂肪含量,抑制饮食引起的肥胖[14]。另一方面,23周的高脂高蔗糖饮食可诱导微型猪的体质量增加,脂类在骨骼肌中的异位沉积和肌萎缩,伴随着GDF8的表达增加[6]。本研究的高脂饮食一共持续20周,也观察到类似的现象,提示GDF8可能是治疗高脂饮食诱导的骨骼肌代谢障碍的新靶点。
SIRT1在成肌细胞的增殖和分化中起关键的作用,myostatin则是成肌细胞的关键调节因子。研究表明myostatin缺失小鼠的骨骼肌中除AMPK的表达和活性增加外,也显著增加了AMPK下游SIRT1和PGC1α的表达[7]。SIRT1的抑制剂尼克酰胺可通过SIRT1依赖的方式抑制C2C12细胞的增殖和促进myostatin的表达,myostatin信号通路的抑制剂SB431542则可逆转尼克酰胺的增殖抑制效应,并促进SIRT1的表达[15]。本研究结果表明,SIRT1激活剂白藜芦醇可能通过增加SIRT1的表达,改善高脂饮食导致的自噬流受损,进而促进myostatin的降解;经数据库检索,此研究尚未见文献报道。
SIRT1是AMPK信号通路下游的一个靶基因, 本研究未能探究白藜芦醇治疗的肥胖小鼠骨骼肌中AMPK的表达和活性的变化,并进一步探索GDF8与AMPK信号通路的关系,这将是本实验后期的主要研究内容。
综上所述,白藜芦醇对高脂饮食诱导肥胖的骨骼肌组织有保护作用,其机制可能与促进SIRT1的表达,诱导自噬活性升高,进而减少GDF8的表达有关。本实验结果可为白藜芦醇的临床应用于肥胖状态下的骨骼肌萎缩等疾病治疗提供科学依据,同时也为白藜芦醇预防高脂饮食下骨骼肌萎缩的具体作用机制研究奠定基础。