慢性间歇性低压低氧对发育大鼠主动脉舒张的影响
2020-02-18李宏伟宋丽莉董泽飞
李宏伟,宋丽莉,张 翼,董泽飞
(1.邢台医学高等专科学校生理教研室,河北 邢台 054000;2.河北医科大学生理教研室,河北 石家庄 050017)
大量研究表明[1],慢性间歇性低压低氧(chronic intermittent hypobaric hypoxia,CIHH)具有明显的心血管保护效应。我们以往的研究显示[2],CIHH 对于缺血/再灌注引起的大鼠心肌损伤具有明显的对抗作用。例如,CIHH 具有抗心律失常作用,并可促进心脏缺血/再灌注后心功能的恢复。CIHH 这种心脏保护作用可维持两周左右时间,其机制可能与心肌抗氧化能力增强[3]、KATP通道的开放[4]、热休克蛋白表达增强[5]、线粒体通透转换孔开放抑制有关。此外,在自发性高血压、肾血管性高血压或代谢综合征大鼠模型,CIHH 处理可明显降低升高的动脉血压。CIHH 这种抗高血压作用可能与动脉血管的舒张增强,以及压力感受性反射的易化有关。但 CIHH 对心血管功能的保护作用机制远未完全阐明。
众所周知,发育的幼年动物与成年动物在形态与功能各方面均表现出明显差异,并且随着动物年龄的增加,动物的大部分生理、生化指标都会发生改变[6],例如动物功能、神经可塑性、对低氧的反应性等方面[7]。我们以往研究显示,相同程度的 CIHH 处理对不同年龄大鼠可引起完全不同的作用。在成年大鼠,应用 4~6 周、每日 6 h、模拟 5 km 高原的 CIHH 处理可产生心脏保护效应,但对幼年大鼠则引起心脏损伤,而 4~6 周、每日 5 h、模拟 3 km 高原的 CIHH 可使幼年大鼠出现心脏保护作用[8]。这说明发育大鼠与成年大鼠对 CIHH 处理的反应性是不同的。同样,在成年大鼠和成年肾血管性高血压大鼠,我们发现 CIHH 可增强胸主动脉环舒张,但不知 CIHH 对发育幼年大鼠胸主动脉舒张作用如何。本研究旨在探讨 CIHH 处理对发育大鼠胸主动脉舒张功能的影响及其机制。
1 材料
1.1 试剂苯肾上腺素(phenylephrine, PE)(货号:P0398),乙酰胆碱(acetylcholine, ACh)(货号:A2661),吲哚美辛(indomethacin, Indo)(货号:I7378),格列苯脲(glibenclamide, Gli)(货号:G0639),以上药物购自Sigma公司;四甲基哌啶氧化物(tetramethylpiperidinooxy, Tempo)(货号:ALX-430-081-G001),购自Alexis公司。药物保存在 -20 ℃,使用药物时,用二甲基亚砜配制 Gli,用蒸馏水配制其余药物,用 K-H 液稀释成浴槽所需浓度,所有药物及液体都现用现配。
1.2 溶液K-H 液(mmol·L-1):NaCl 118.0、KCl 4.7、CaCl22.5、MgSO41.2、NaHCO325.0、KH2PO41.2、glucose 11.0,pH 7.4。
2 方法
2.1 动物分组和间歇性低氧处理本研究中对动物的处置均参照《实验动物护理和使用指南》进行,符合动物伦理学要求。实验动物的使用、操作流程均经河北医科大学实验动物使用伦理委员会审查和批准。
实验所用 Sprague-Dawlay 大鼠购自河北医科大学实验动物中心,♂,体质量(150~360) g,合格证号:708068,许可证号:SCXK(冀)2003-1-003。新生 Sprague-Dawlay ♂大鼠随机分为 8 组:CIHH 处理组(CIHH)、CIHH 后1周组(CIHH-p1)、CIHH 后2周组(CIHH-p2)、CIHH 后3周组(CIHH-p3)、对照组(Con)、对照一周组(Con-1)、对照两周组(Con-2)与对照三周组(Con-3)。CIHH 各组动物从出生前 1~3 d开始,随母鼠一起置于低压氧舱内,接受每天5 h,模拟海拔 3 km 的低压低氧处理,共 42 d。对照组动物除不接受低压低氧处理外,其余与 CIHH 处理组动物相同。每周定时记录动物体质量及一般状况。
2.2 离体动脉环制备动物麻醉使用戊巴比妥钠,腹腔注射法(50 mg·kg-1)。麻醉后,取出胸主动脉,置于 K-H 液中,剪成动脉环(长约 3 mm)。将动脉环用细不锈钢丝(0.1 mm)穿起,浸泡在恒温浴槽内(成都仪器厂,浴槽内有 5 mL K-H 液,温度保持在 37 ℃,持续通入 95% O2和 5% CO2混合气),将动脉环一端和张力换能器相连,利用 BL-420E+ 生物机能实验系统(成都泰盟科技有限公司),记录标本的张力变化。
2.3 离体动脉环舒张描记
2.3.1动脉环活性判定 将动脉环的初始张力调节为 1 g,每 20 min更换一次浴槽内的 K-H 液。初次平衡 40 min后,检测标本活性。先使用 PE(10-6mol·L-1),诱发动脉环收缩,然后给予 ACh (10-5mol·L-1),使血管环舒张,若舒张反应大于 70%,则被判定为动脉环内皮完整。
2.3.2常氧条件下的动脉环舒张 内皮完整的动脉环,冲洗换液后再平衡 40 min,通过累加给药观察血管环反应。先用 PE(10-6mol·L-1)使动脉环再次收缩,其收缩反应的最大值被记录为 Emax,然后依次累加给予 ACh(10-9~10-5mol·L-1),观察血管环舒张效应,记录下各浓度 ACh 诱发的动脉环舒张值,和 Emax相比较,计算出舒张反应的相对值(%Emax),并绘制量-效曲线图。
另外,对部分 CIHH 组大鼠内皮完整的动脉环,记录最大收缩值 Emax后,直接冲洗换液后平衡 40 min,分别给予 Indo(10-5mol·L-1)、Gli(10-5mol·L-1)或者 Tempo(10-6mol·L-1),30 min 后,给予 PE(10-6mol·L-1)使动脉环收缩后,同样以累加给药法给予 ACh(10-9~10-5mol·L-1),观察常氧条件下 PE 收缩后 ACh诱发的血管舒张情况受前列环素、KATP通道和氧自由基的影响。
2.3.3急性低氧条件下的动脉环舒张 常规处理动脉环后,记录 PE(10-6mol·L-1)使动脉环收缩的最大值,冲洗换液平衡 40 min,再次给予 PE(10-6mol·L-1)使动脉环收缩,以累加给药法给予 ACh(10-7~10-5mol·L-1)诱发舒张。在此次给予 PE 前 20 min 改为持续通入 95% N2和 5% CO2混合气导致 K-H 液中氧浓度降低,观察急性低氧对动脉环舒张的影响。
同样,对部分 CIHH 组大鼠内皮完整的动脉环,记录最大收缩值 Emax后,平衡 40 min,观察急性低氧条件下 PE 收缩后 ACh 诱发的血管舒张情况受前列环素、KATP通道和氧自由基的影响。

3 结果
3.1 CIHH对发育大鼠胸主动脉舒张的影响常氧条件下,由 ACh(10-7mol·L-1浓度以上)诱发的胸主动脉环内皮依赖性舒张反应在 CIHH 处理组大鼠较对照组大鼠明显增强,且呈浓度依赖性,随着 ACh 浓度的增加,增强作用更加明显。CIHH 处理大鼠的量-效曲线较对照大鼠明显向左下移位(P<0.05)。结果表明,CIHH处理对发育大鼠胸主动脉舒张具有明显增强效应。
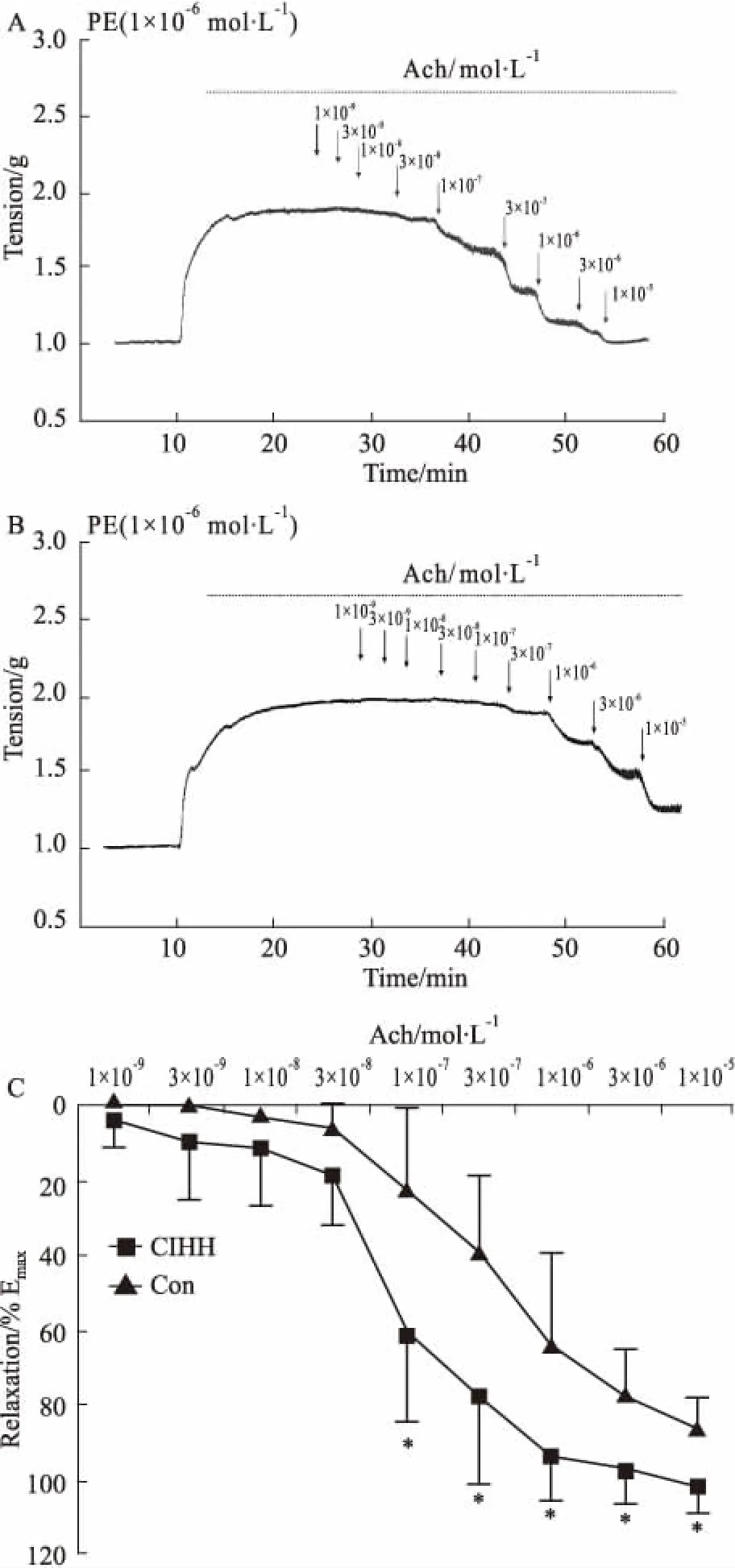
Fig 1 Relaxation in isolated aorta ring induced by ACh (10-9~10-5 mol·L-1) under normoxia n=6)
Representative tension curve from CIHH (A) and CON (B). Comparison of ACh-induced thoracic aorta relaxation between CIHH and control groups (C). All data were expressed as a percentage of the contraction caused by PE (10-6mol/L).*P<0.05vsCon
3.2 CIHH动脉舒张增强效应的维持时间CIHH 处理后各组大鼠胸主动脉环舒张均明显大于各自对照组大鼠,显示 CIHH 对动脉舒张的增强效应在 CIHH 处理后3周依然存在。结果表明,CIHH 对发育大鼠动脉舒张增强效应至少可维持3周时间(P<0.05)。
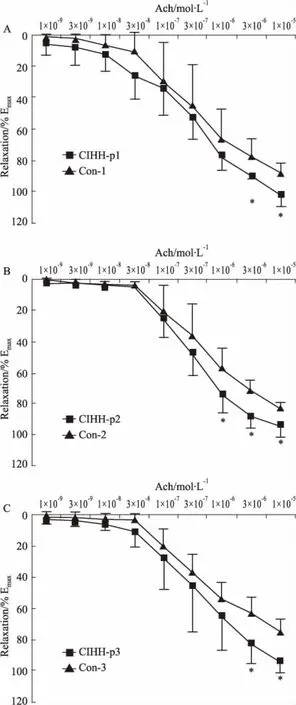
Fig 2 Duration of ACh-induced (10-9~10-5 mol·L-1) thoracic aorta relaxation post CIHH groups
ACh-induced (10-9~10-5mol·L-1) thoracic aorta relaxation of one-week (A), two-week (B) and three-week (C) post CIHH groups under normoxia. All data were expressed as a percentage of the contraction caused by PE (10-6mol·L-1).*P<0.05vsCon
3.3 吲哚美辛,格列本脲和Tempo对CIHH动脉舒张增强效应的影响为探讨 CIHH对发育大鼠胸主动脉舒张增强效应的产生机制,我们在累加给予 ACh 前分别给予 Indo(10-5mol·L-1)、Gli (10-5mol·L-1)和 Tempo(10-6mol·L-1)30 min 预处理。结果表明,CIHH 对发育大鼠胸主动脉舒张增强效应可被 Indo、Gli 和 Tempo 完全阻断(P<0.05)。
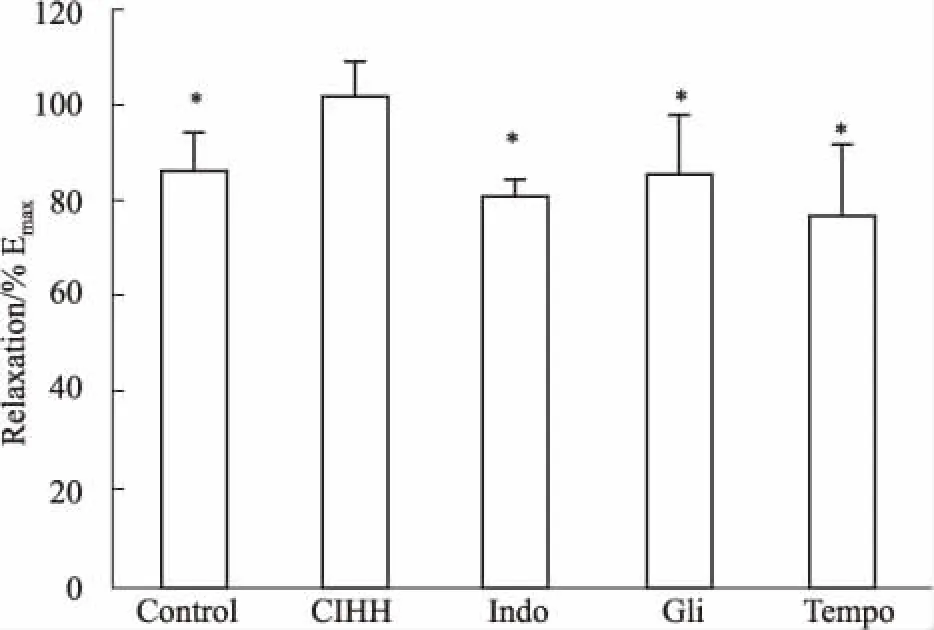
Fig 3 Effect of Indo, Gli and Tempo pre-treatment on ACh-induced (10-7~10-5 mol·L-1) thoracic aorta relaxation of CIHH and control groups under normoxia n=6)
All data were expressed as a percentage of the contraction caused by PE (10-6mol·L-1).*P<0.05vsCIHH
3.4 急性低氧对CIHH动脉舒张增强效应的影响急性低氧条件下,由 ACh 诱发的大鼠胸主动脉环内皮依赖性舒张反应明显减弱,其量-效曲线明显向左下移位(P<0.05)。CIHH 处理组与 Con 组大鼠相比较,CIHH 处理大鼠动脉环舒张减弱的程度明显小于 Con 组大鼠(P<0.05),此作用可被 Indo 和 Tempo 所消除(P<0.05)。结果表明, CIHH 处理减轻急性低氧对动脉舒张功能的抑制,抑制作用与前列环素和氧自由基有关。
4 讨论
本研究应用离体动脉环张力描记方法,首次观察 CIHH 处理对发育大鼠离体主动脉环 ACh 诱发的内皮依赖性舒张的影响及其机制。结果显示,CIHH 可明显增强发育大鼠胸主动脉 ACh 诱发的内皮依赖性舒张,此效应可维持至少 3 周时间,并可被 Indo、Gli 和 Tempo 所阻断。结果提示,CIHH 对血管内皮依赖性舒张增强作用与前列环素、ATP 敏感钾通道(KATP)和氧自由基有关。此外,研究结果亦显示,CIHH处理可对抗急性低氧对血管舒张的抑制,从而进一步证实 CIHH 对血管功能的保护作用。
血管内皮细胞覆盖于血管内表面,在维持血管的收缩舒张之间的平衡等方面具有十分重要的意义。ACh 可通过血管内皮细胞产生 NO,通过 NO-cGMP 途径,导致血管舒张[9]。通常以 ACh 诱发的血管舒张衡量 NO 所介导的血管内皮依赖性舒张功能。有研究报道,CIHH 可通过增加 NO 发挥心血管保护作用[10]。本研究结果显示,CIHH 对 ACh 诱发的主动脉舒张具有明显的增强效应,提示 CIHH的增强血管舒张作用可能通过增加血管内皮 NO 产生所实现。
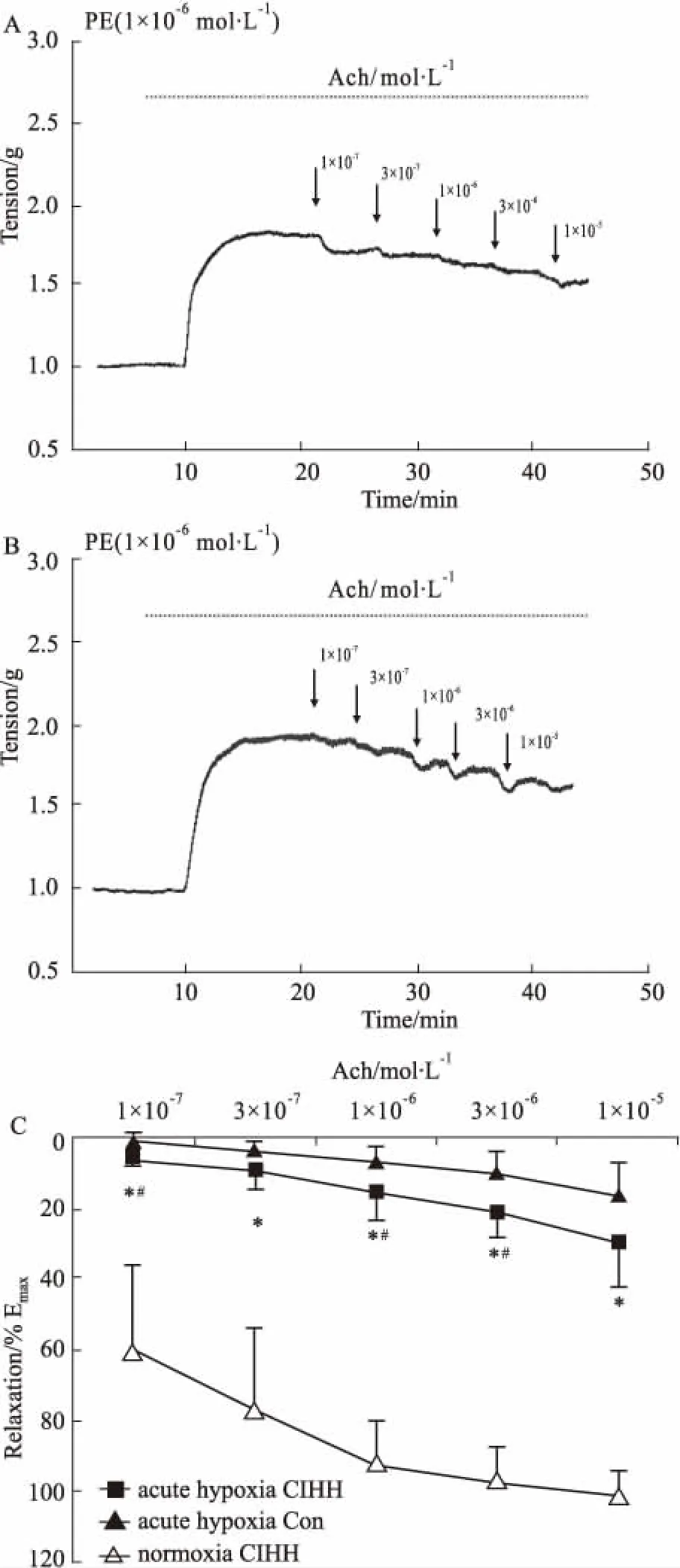
Fig 4 Relaxation in isolated aorta ring induced by ACh (10-7~10-5 mol·L-1) under acute hypoxia n=6)
Representative tension curve of relaxation in isolated aorta ring induced by ACh (10-7~10-5mol·L-1) from CIHH (A) and CON (B) under acute hypoxia. Comparison of ACh-induced thoracic aorta relaxation between acute hypoxia CIHH and acute hypoxia control/normoxia CIHH groups (C). All data were expressed as a percentage of the contraction caused by PE (10-6mol·L-1).*P<0.05 CIHH under acute hypoxiavsCIHH under normoxia,#P<0.05 CIHH under acute hypoxiavsCon under acute hypoxia
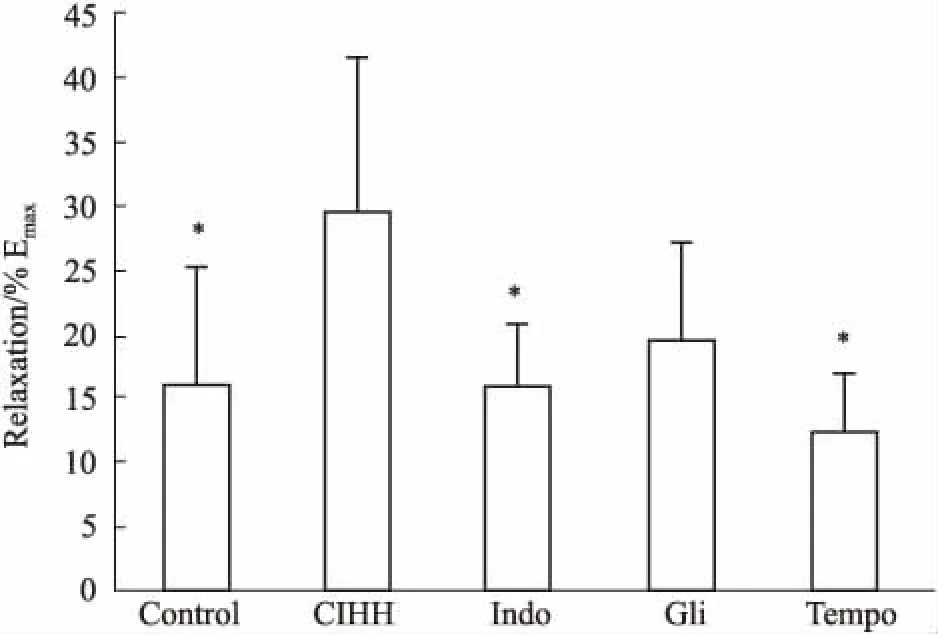
Fig 5 Effect of Indo, Gli and Tempo pre-treatment on ACh-induced (10-7~10-5 mol·L-1) thoracic aorta relaxation of CIHH and control groups under acute hypoxia n=6)
All data were expressed as a percentage of the contraction caused by PE (10-6mol·L-1).*P<0.05vsCIHH
前列环素(prostaglandin,PG)是一种舒血管物质,在环氧合酶等的作用下,会形成前列环素(PGI2)。PGI2可通过刺激腺苷酸环化酶(AC),使血小板中 cAMP增加而抑制血管平滑肌收缩,导致血管舒张[11]。本研究结果显示,应用环氧合酶的非特异性抑制剂吲哚美辛预孵育动脉环,可以阻断 CIHH 处理对 ACh 诱发的主动脉内皮依赖性舒张增强效应,提示 CIHH 的增强主动脉舒张作用可能与血管内皮环氧合酶作用增强、或者 PG 合成与释放增多有关。
K+通道可调节血管平滑肌收缩,在调节血管张力中发挥重要作用[12]。本研究结果显示,应用 KATP非特异性抑制剂格列苯脲预孵育动脉环可以阻断 CIHH 处理对ACh 诱发的血管内皮依赖性舒张增强效应,提示 CIHH 对主动脉舒张的增强效应可能与促进 KATP通道开放有关。我们以往的研究也已证实,CIHH 增强成年大鼠血管舒张作用可通过激活阿片受体,从而促进 KATP通道开放所引起[13]。
本研究结果显示,对大鼠主动脉的舒张增强效应可被氧自由基清除剂 Tempo 所取消,表明 CIHH 对主动脉舒张增强效应与体内自由基产生有关。有研究报道[14],自由基参与在缺血预处理等心脏保护作用的信号转导通路,通过自由基清除剂清除自由基后可消除心脏保护作用。联系本研究结果,可以推测 CIHH 作为一种应激刺激,可导致体内一定程度的氧自由基增加,通过自由基参与的信号转导通路,引起 NO产生增加,从而增强血管的舒张反应,以及对抗急性低氧对血管舒张的抑制。
综上所述,CIHH 处理具有增强发育大鼠胸主动脉舒张并对抗急性低氧对动脉舒张的抑制,CIHH 对动脉舒张的保护作用可能与前列腺素生成增多、KATP通道开放及氧自由基作用有关。