原发性免疫性血小板减少症(ITP)患者CD5+B细胞对CD4+T细胞Th1/Th2型细胞因子分泌的影响
2020-02-10于慧辉詹延霞季丽莉孙丽华程韵枫化范例
于慧辉 詹延霞 季丽莉 李 炀 孙丽华 程韵枫, 化范例△
(1复旦大学附属金山医院血液科 上海 201508;2复旦大学附属中山医院青浦分院血液科 上海 201700;3复旦大学附属中山医院血液科 上海 200032)
原发性免疫性血小板减少症(immune thrombocytopenia,ITP)是临床常见的获得性自身免疫性出血性疾病,由于免疫紊乱导致血小板及巨核细胞破坏增加和/或生成减少。原发性ITP患者体内存在多种免疫细胞亚群数量和功能异常[1],Th1/Th2显著失衡,目前公认原发性ITP为Th1优势自身免疫性疾病[2]。部分B细胞可以通过分泌IL-10而影响T细胞亚群(如Th1、Th17等)的分化和功能,其中CD5+B细胞是产生IL-10的重 要B细胞 亚群[3-4],多种具有免疫调节功能的B细胞亚群都表达CD5分子标志物[5-7]。我们发现原发性ITP患者CD5+B细胞存在数量及分泌IL-10能力的异常[8-9],提示在原发性ITP患者中CD5+B细胞对T细胞亚群的免疫调节功能可能存在缺陷。原发性ITP的一线治疗药物为糖皮质激素,首选大剂量地塞米松(highdose dexamethasone,HD-DXM)冲击治疗[10]。本研究通过观察原发性ITP患者CD5+B细胞对CD4+T细胞分泌Th1和Th2型代表性细胞因子IFN-γ 和IL-4的调节作用,以及经过HD-DXM治疗后CD5+B细胞免疫调节功能的变化,探讨CD5+B细胞在原发性ITP患者Th1/Th2失衡中的作用。
资料和方法
研究对象所有研究对象均符合《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》[11]的诊断标准。收集2018年2月至6月复旦大学附属中山医院青浦分院血液科病房ITP患者共5例(男1例、女4例),中位年龄49(35~62)岁。招募健康对照者5例(男2例、女3例),中位年龄35(28~46)岁。本研究经复旦大学附属中山医院青浦分院医学伦理委员会批准,所有研究对象均签署知情同意书。
HD-DXM冲击治疗方案患者起始血小板计数<30×109/L和/或有出血表现,接受HD-DXM冲击治疗:口服地塞米松40 mg/d×4天,重症患者同时给予静脉注射丙种球蛋白0.4 g·kg−1·d−1×5天和/或血小板输注和/或重组人血小板生成素;4天后停药,若血小板稳定,则不再用药;若血小板下降至<50×109/L,则重复给药1次,然后以泼尼松15 mg/d维持。疗效评估参照文献[11]。
淋巴细胞分选ITP患者接受HD-DXM治疗前、后均采集外周静脉血20 mL,EDTA-K2抗凝;健康对照者采集外周静脉血20 mL。采用Ficoll密度梯度离心法获得外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。分选CD4+T细胞:1×107PBMC重悬于80 μL分选缓冲液中,加入20 μL CD4磁珠,置于4 ℃冰箱孵育15 min;洗涤重悬后过柱,获得阳性细胞(纯度>99%)。分选CD19+CD5+B细胞和CD19+CD5-B细胞:1×107PBMC重悬于80 μL分选缓冲液中,加入20 μL CD19磁珠,置于4 ℃冰箱孵育15 min,后10 min加入CD5-Biotin抗体10 μL;洗涤后过柱,分选获得CD19+B细胞;1 mL CD19+细胞中加入20 μL酶切试剂,4 ℃孵育10 min,洗涤后重悬于50 μL缓冲液;加入30 μL终止液;加入20 μL Biotin磁珠,4 ℃孵育15 min;洗涤重悬后过柱,分选获得CD19+CD5+B细胞(纯度>90%),其余为CD19+CD5-B细胞(纯度>98%)。
淋巴细胞共培养CD4+T细胞(2×105/mL)与完全RPMI 1640培养基混合,接种于预包被CD3 mAb的96孔培养板,在2.5 μg/mL CD28 mAb和10 ng/mL IL-2的条件下,磁珠纯化出的CD19+CD5+B细胞或CD19+CD5−B细胞与CD4+T细胞按1∶9、1∶5、1∶3、1∶1,混合培养72 h或144 h。
ELISA检测IFN-γ 和IL-4水平取上述细胞共培养上清,按ELISA试剂盒说明书检测IFN-γ 和IL-4水平,每个样本和标准品均设3个复孔,酶标仪读取波长450 nm处的吸光度(D)值,绘制标准曲线,计算IFN-γ 和IL-4含 量。所用ELISA试剂盒IFN-γ 和IL-4的最低检测浓度分别为5 pg/mL和0.5 pg/mL。
统计学分析运用SPSS 16.0和GraphPad Prism 7统计软件进行数据分析。计量资料以表示,多组间计量资料比较采用双因素ANOVA检验。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
结 果
健康对照组CD5+B细胞对CD4+T细胞分泌IFN-γ的影响共培养72 h,健康对照组CD5+B细胞与CD4+T细胞比例在1∶3时,CD4+T细胞分泌IFN-γ浓度明显下降,与T细胞单独培养相比差异有统计学意义[(2 427.99±632.62)pg/mLvs.(1 109.25±338.10)pg/mL,P=0.001 2]。CD5+B细胞与CD4+T细 胞比例增加至1∶1时,CD4+T细胞分泌IFN-γ 浓度下降至(395.22±136.54)pg/mL(P<0.001)。共培养144 h得到相似的结果,但培养上清液中IFN-γ 浓度较共培养72 h高出数倍。
共培养72 h,各浓度梯度下CD5CD5−BB细胞对CD4+T细胞培养上清液中IFN-γ 浓度均未见明显影响(P均>0.05);当CD5-B细胞与CD4+T细胞比例增加至1∶1时,IFN-γ 浓度有下降趋势,但差异无统计学意义。共培养144 h,CD5−B细胞与CD4+T细胞比例为1∶9时表现为促进IFN-γ的 分泌,而B与T细胞比例增加至1∶3时对IFN-γ的分泌才产生抑制作用,较T细胞单独培养时IFN-γ浓度显著下降(P均<0.01,图1、表1)。
表1 健康对照组CD5+/CD5-B细胞与CD4+T细胞共培养上清液中IFN-γ 浓度Tab1 The concentration of IFN-γ in supernatant of CD4+T cells cocultured with CD5+/CD5-B cells in healthy control group [(),pg/mL]

表1 健康对照组CD5+/CD5-B细胞与CD4+T细胞共培养上清液中IFN-γ 浓度Tab1 The concentration of IFN-γ in supernatant of CD4+T cells cocultured with CD5+/CD5-B cells in healthy control group [(),pg/mL]
(1)vs.T cell culture alone,P<0.01.T:T cell;B:B cell.
ITP患者CD5+B细胞对CD4+T细胞分泌IFN-γ的影响共培养72 h,ITP患者CD5+B细胞与CD4+T细胞比例增至3∶1时,较T细胞单独培养时IFN-γ的分泌显著下降[(3 060.02±493.98)pg/mLvs.(1 769.45±634.73)pg/mL,P=0.000 3]。共培养144 h,ITP患者CD5+B细胞有轻度抑制CD4+T细胞分泌IFN-γ的趋势,但差异无统计学意义。
共培养72 h,ITP患者CD5−B细胞与CD4+T细胞比例为1∶1时,CD5-B细胞促进CD4+T细胞分泌IFN-γ,与T细胞单独培养相比差异有统计学意义(P=0.029 1)。共培养144 h,ITP患者CD5−B细胞对CD4+T细胞分泌IFN-γ几乎没有影响(P均>0.05,图1、表2)。
表2 原发性ITP患者HD-DXM治疗前CD5+和CD5-B细胞与CD4+T细胞共培养上清液中IFN-γ 浓度Tab 2 The concentration of IFN-γ in supernatant of CD4+T cells cocultured with CD5+/CD5-B cellsof primary ITP patients before HD-DXM treatment [(),pg/mL]
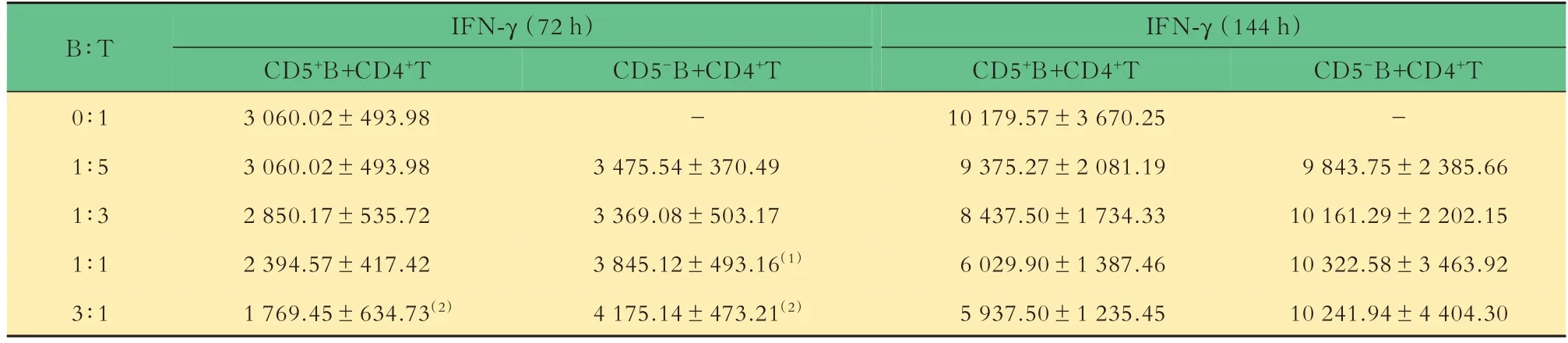
表2 原发性ITP患者HD-DXM治疗前CD5+和CD5-B细胞与CD4+T细胞共培养上清液中IFN-γ 浓度Tab 2 The concentration of IFN-γ in supernatant of CD4+T cells cocultured with CD5+/CD5-B cellsof primary ITP patients before HD-DXM treatment [(),pg/mL]
(1)vs.T cell culture alone,(1)P<0.05;(2)P<0.01.T cell;B:B cell.
ITP患者HD-DXM治疗后CD5+B细胞对CD4+T细胞分泌IFN-γ的影响经HD-DXM治疗后ITP患者均获得完全或部分反应。共培养72 h,CD5+B细胞与CD4+T细胞比例为1∶1时,即表现出对CD4+T细胞分泌IFN-γ的抑制作用[(3 600.02±838.00)pg/mLvs.(1 157.97±383.20)pg/mL,P<0.000 1];当比例增加至3∶1时,CD4+T细胞分泌IFN-γ 浓度进一步下降至(829.67±314.25)pg/mL(P<0.000 1)。共培养144 h的结果同样显示,经过HD-DXM有效治疗后,CD5+B细胞与CD4+T细胞比例 为1∶3时,表 现出对CD4+T细胞 分泌IFN-γ的抑制作用[(11 543.53±3 541.90)pg/mLvs.(5 102.81±1 734.33)pg/mL,P=0.002 9];当比例增至1∶1和3∶1时,CD4+T细胞分泌IFN-γ的浓度随着B∶T细胞比例的增加进一步下降(P均<0.000 1,表3)。
表3 原发性ITP患者HD-DXM治疗后CD5+B细胞对CD4+T细胞分泌IFN-γ的影响Tab 3 The concentration of IFN-γ in supernatant of CD4+Tcells cocultured with CD5+B cells of primary ITP patients after HD-DXM treatment [(),pg/mL]

表3 原发性ITP患者HD-DXM治疗后CD5+B细胞对CD4+T细胞分泌IFN-γ的影响Tab 3 The concentration of IFN-γ in supernatant of CD4+Tcells cocultured with CD5+B cells of primary ITP patients after HD-DXM treatment [(),pg/mL]
(1)vs.T cell culture alone,P<0.01.T:T cell;B:B cell.
健康对照者及ITP患者的CD5+B细胞对CD4+T细胞分泌IL-4的影响在健康对照者和ITP患者中,CD5+B细胞以不同比例与CD4+T细胞共培养,无论72 h还是144 h,培养上清中IL-4的浓度变化与T细胞单独培养时比较,差异均无统计学意义。CD5-B细胞以不同比例与CD4+T细胞共培养,同样对IL-4的浓度无明显影响。
讨 论
CD5+B细胞具有分泌IL-10的能力,其免疫调节作用已经在动物实验中得到证实:体外诱导扩增的CD5+B细胞回输小鼠体内可以缓解实验性变态反应性脑脊髓炎疾病,而CD5-B细胞则不具备这种免疫调节功能[12]。本研究证实,健康对照组共培养72 h时CD5+B细胞具有抑制CD4+T细胞分泌IFN-γ的作用,提示CD5+B细胞影响Th1细胞亚群的细胞因子分泌,并在维持Th1/Th2平衡中起到重要作用。
我们发现在原发性ITP患者中CD5+B细胞存在数量及分泌IL-10能力的异常[8-9],这提示在ITP患者中CD5+B细胞免疫调节功能可能存在缺陷。本研究发现,相较于健康对照组,CD5+B细胞对CD4+T细胞分泌IFN-γ(Th1型代表性细胞因子)有显著抑制作用,ITP患者中CD5+B细胞抑制IFN-γ分泌的能力明显受损,CD5+B细胞在更高的比例下才表现出对CD4+T细胞分泌IFN-γ的抑制作用,而且在相同的B:T细胞比例下,IFN-γ 分泌受抑制的程度远低于健康对照组。说明在ITP患者中CD5+B细胞调节CD4+T细胞分泌IFN-γ的功能存在缺陷。CD5+B细胞主要通过分泌IL-10发挥免疫抑制功能,本研究结果也与我们之前发现的ITP患者CD5+B细胞存在分泌IL-10能力异常相一致。B细胞分泌IL-10主要由Toll样受体及其下游的MyD88通路所介导,针对ITP患者CD5+B细胞,我们运用PCR Array方法对TLRs/MyD88信号传导通路中的相关分子进行初步探索,筛选出一些重要的差异表达分子,如FOS、JUN、IRF3等[13],为后续机制研究提供了方向。
另一方面,健康对照者和原发性ITP患者的CD5+B细胞对Th2型代表性细胞因子IL-4的分泌均无明显影响。CD5+B细胞可以下调Th1/Th2型细胞因子的比例,但在ITP患者中由于CD5+B细胞抑制IFN-γ 分泌的能力明显受损,可能造成Th1/Th2失衡和Th1型细胞因子优势。ITP是一种典型的Th1优势的自身免疫性疾病,Th1/Th2失衡在ITP的发病机制中起到重要作用[14-16]。本研究结果提示,CD5+B细胞的免疫调节功能缺陷参与了ITP患者形成Th1优势和Th1/Th2失衡的过程。
HD-DXM治疗疗效好、疗程短、不良反应小,故推荐作为ITP的一线治疗[10],但其作用机制尚不完全清楚。与治疗前相比,在HD-DXM治疗有效的ITP患者中观察到Th1/Th2失衡可被纠正[17]及Treg数量增加[18]等免疫细胞和细胞因子的变化。本课题组前期研究发现ITP患者CD5+B细胞的IL-10分泌障碍可以被HD-DXM修复[8]。本研究进一步发现,患者接受HD-DXM治疗后,CD5+B细胞抑制IFN-γ 分泌的能力部分恢复,提示CD5+B细胞免疫调节功能的恢复可能也是HD-DXM的作用机制之一。功能部分恢复的CD5+B细胞对IFN-γ 分泌的抑制程度仍显著低于健康对照者,这说明经过HD-DXM治疗,患者的血小板计数升高到相对安全的范围,但其CD5+B细胞对CD4+T细胞的免疫调节功能尚未完全恢复,患者仍处于免疫失衡状态,这可能是导致疾病复发的原因之一。本研究中有2例患者同时使用具有免疫调节功能的丙种球蛋白,其对T细胞分泌IFN-γ的影响尚无明确定论,丙种球蛋白联合地塞米松对T细胞分泌细胞因子方式的影响及其临床意义值得进一步探讨。
本研究还比较了CD5-B细胞与CD5+B细胞在免疫调节功能上的差异。无论是在健康对照者还是ITP患者中,共培养72 h,CD5-B细胞均不能抑制CD4+T细胞分泌IFN-γ,在ITP患者中随着CD5-B细胞比例的增加,反而有促进CD4+T细胞分泌IFN-γ的趋势。共培养时间延长至144 h,健康对照组中随着CD5-B细胞比例的增加,表现出对IFN-γ的分泌有一定的抑制作用,而ITP患者中CD5-B细胞对IFN-γ的分泌几乎不产生影响。Lemoine等[19]研究认为,在T细胞与B细胞相互作用的过程中,B细胞可上调CD5的表达并获得抑制T细胞免疫反应的能力。ITP患者中B细胞的异常表现提示其获得免疫抑制功能的通路受阻,但具体机制有待深入研究。
总之,本研究发现原发性ITP患者CD5+B细胞抑制CD4+T细胞分泌Th1型代表性细胞因子IFNγ的能力明显受损,但是对Th2型代表性细胞因子IL-4的分泌无明显影响。HD-DXM治疗有效的ITP患者中,CD5+B细胞抑制IFN-γ 分 泌的能力可部分恢复。本研究一方面揭示了CD5+B细胞在ITP疾病发生发展尤其是Th1/Th2失衡中可能发挥的作用,另一方面也为ITP患者B细胞免疫调节功能缺陷制定相应的治疗策略提供了实验基础。
