不同胚性愈伤率小麦胚发育过程生化和显微结构特征研究
2020-02-02赵彦峰贾冬冬
赵彦峰 贾冬冬
摘要 为探究不同胚性愈伤率小麦成熟胚的胚发育过程中的生化和显微结构特征,以不同胚性愈伤率的小麦基因型为材料,测定花后16、30 d小麦胚中的糖类、激素和活性氧的含量。结果显示,较高胚性愈伤率基因型小麦花后30 d麦胚的赤霉素含量显著大于低胚性愈伤率型,而其他生化指标在2个发育阶段差异不显著。相关性分析发现,30 d胚的赤霉素含量与胚性愈伤率呈极显著正相关,说明高胚性愈伤率的小麦胚可能在发育晚期具有较高的赤霉素含量。在对胚内部结构观察中,并未发现2个发育阶段不同小麦胚之间存在明显差异。
关键词 普通小麦;胚;胚性愈伤;胚发育;组织培养
中图分类号 S 512.1文献标识码 A文章编号 0517-6611(2020)01-0007-05
doi:10.3969/j.issn.0517-6611.2020.01.002
开放科学(资源服务)标识码(OSID):
Study on Biochemical and Microstructure Characteristics of Wheat Embryos Development with Different Embryonic Callus Capacity
ZHAO Yan feng1, JIA Dong dong2
( 1.Seed Management Center of Shaanxi Province, Xian, Shaanxi 710018; 2.College of Agronomy, Northwest A&F University/Key Laboratory of Wheat Biology and Genetic Improvement on Northwestern China, Ministry of Agriculture and Rural Affairs,Yangling, Shaanxi 712100)
Abstract In order to investigate the biochemical and microstructure characteristics of wheat mature embryos with different embryonic callus capacity, the contents of carbohydrates, hormones and reactive oxygen species in wheat embryos at 16 and 30 days after anthesis were determined by using wheat genotypes with different embryogenic callus capacity as materials. The results showed that the content of gibberellin in wheat germ of high embryonic callus capacity genotype was significantly higher than that of low embryonic callus capacity genotypes at 30 days after anthesis, while there were no significant differences in other biochemical indicators between the two developmental stages. Correlation analysis showed that there was a significantly positive correlation between the gibberellin content in the 30 day embryos and the embryonic callus rate.Therefore, wheat embryos with high embryonic callus capacity may have a high gibberellin content in the late stage of development. In the observation of the internal structure of the embryos, there was no significant difference between the two developmental stages of different wheat embryos.
Key words Triticum aestivum;Embryo;Embryonic callus;Embryo development;Tissue culture
小麥是我国第三大粮食作物,与水稻、玉米、大豆等主要农作物相比,小麦转基因育种进度明显滞后。普通小麦具异源六倍体特性,拥有庞大基因组,再者生产上缺乏高再生能力的小麦基因型、组织培养技术有待改善,严重限制了基因枪法及农杆菌介导法等常规遗传转化方法在小麦转基因中的运用[1-2]。现阶段转基因小麦植株大多来自一些春性小麦如Bobwhite、Veery、Fielder及半冬性小麦如科农199等。日本烟草公司开发的基于农杆菌介导的遗传转化 “PureWheat”专利技术在模式基因型小麦Fielder、Bobwhite中表现较高的遗传转化效率,而在其他小麦基因型中表现一般[3-4]。但Fielder和Bobwhite等基因型小麦农艺性状较差,以其为受体获得的转基因材料很难直接生产应用[5]。长期对小麦组织培养体系的广泛研究发现,小麦不同外植体的再生能力差异显著,幼胚再生能力相对最强,其次是花药及幼穗,成熟胚再生能力较低。虽然小麦幼胚再生能力较强,但取材受到时间和空间上的局限,并且幼胚适宜转化的生理状态对组织培养条件要求较高,因而其应用受到了较大限制。相对幼胚而言,成熟胚取材简易,不受生长季节限制,是理想的组织培养及遗传转化对象,也是其他作物最常用的转化受体材料。值得注意的是,研究证明基因型是幼胚愈伤组织器官发育建成的重要制约因子[6],而成熟胚的诱导和分化与其基因型也关系密切[7]。前人虽对小麦高频再生基因型及成熟胚组织培养再生体系进行了筛选和优化,但整体成熟胚再生能力迄今仍较为低下[8-11]。因此,开展以成熟胚为外植体的小麦组织培养体系研究依然具有必要性。
在小麦离体胚组织培养过程中,不同基因型小麦的成熟胚的胚性愈伤率差异显著,多数基因型小麦利用成熟胚进行组培虽然都能诱导出愈伤组织,乃至出愈率高达100%,但几乎不会形成胚性愈伤组织或胚性愈伤组织非常低。而单子叶植物成熟胚发育经过幼胚(包括球形期、梨形期、盾片期、子叶期)和成熟胚等阶段。目前关于小麦胚在不同发育阶段的生化特性和形态结构特征与成熟胚诱导的胚性愈伤率是否具有相关性的研究鲜见报道。笔者对17份成熟胚诱导胚性愈伤率不同的小麦基因型开花后16、30 d这2个发育阶段的胚生化指标进行测定和对细胞学形态进行观察,探索不同胚性愈伤率小麦胚的生化特点及形态结构差异,以期为筛选小麦高效再生的基因型及优化其组织培养体系提供借鉴。
1 材料与方法
1.1 材料
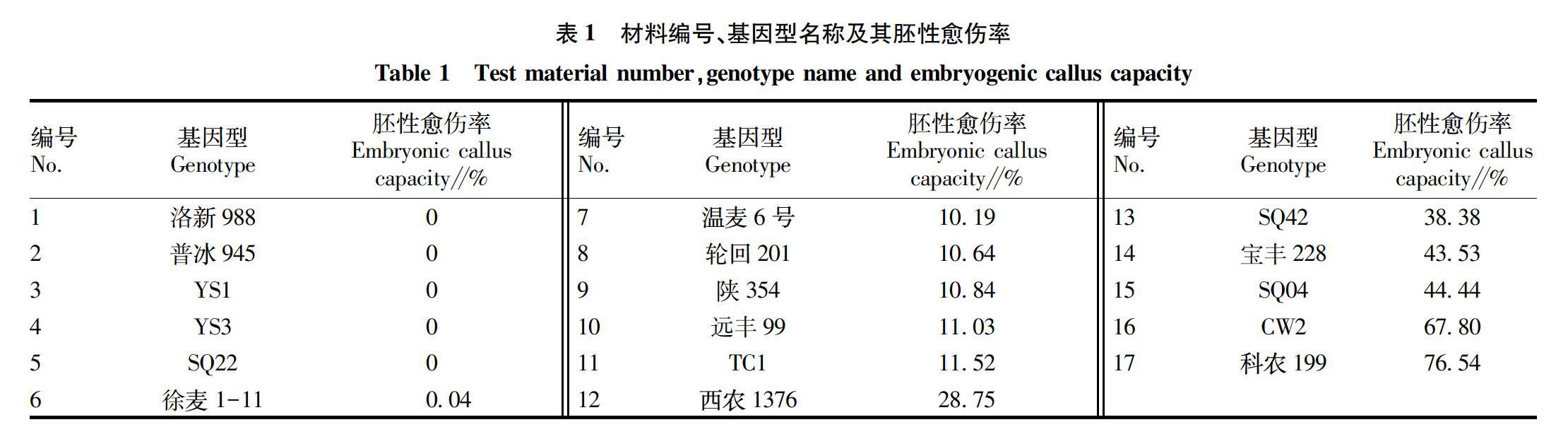
根据汤益等[12-13]研究结果,选取17种小麦基因型作为参试材料,材料均由西北农林科技大学农业农村部西北地区小麦生物学与遗传育种重点实验室提供。材料名称、编号及胚性愈伤率见表1。
1.2 方法
1.2.1 小麦胚的采集。
试验于2017年4—6月在陕西杨凌(试验地坐标108°04′26″E,34°17′49″N)进行。对小麦中部小穗的开花授粉时期进行挂牌标记,在花后16、30 d(杨凌地区小麦一般在花后35 d左右进入完熟期,30 d处于蜡熟期,易于剥取胚)采集麦穗,用解剖针迅速并完整地剥取小麦胚,将一部分胚置于-80 ℃冰箱保存,用于生化指标测量;另一部分置于FAA固定液中,用于胚的内部显微结构观测。
1.2.2 小麦胚生化指标的测定。
参照逯平杰等[14]方法,采用高效液相色谱(HPLC)-蒸发光散射检测器法测定小麦胚葡萄糖和蔗糖含量。制备样品时将冻存的小麦胚在液氮中磨成粉末状,精确称取样品粉末0.20 g,盛入10 mL EP管中,加入5 mL 80%乙醇,置于80 ℃水浴锅加热30 min,然后12 000 r/min离心20 min,取上清液95 ℃水浴加热,待乙醇完全蒸发后,真空冷冻干燥浓缩。然后用HPLC级双蒸水重溶样品,12 000 r/min离心20 min,上清液冻存于-20 ℃冰箱中,经0.22 μm无机相滤膜过滤后上机。将80%乙醇设置为对照组,每个样品重复3次。
内源细胞分裂素和赤霉素含量测定参考杨途熙等[15]的方法。用液氮将冻存的麦胚研磨成粉末状,精确称取样品粉末0.20 g,盛入10 mL EP管中,加入8 mL预冷的80%甲醇,超声10 min,置于4 ℃过夜浸提。然后4 ℃条件下15 000 r/min离心20 min,吸取的上清液在真空冷冻干燥器浓缩后,用0.1 mol/L乙酸调节pH至2.9,用乙酸乙酯萃取2次,合并酯相并浓缩,用流动相溶解定容至200 μL,保存于-20 ℃冰箱,上机前用0.22 μm有机相滤膜过滤,每个样品重复3次。
过氧化氢、超氧阴离子含量测定参照Jiao等[16]的方法。测定过氧化氢时用液氮研磨冻存的小麦胚成粉末状,精确称取样品粉末0.20 g,加入1.8 mL 5%三氯乙酸,振荡混匀,4 ℃条件下14 000 r/min离心20 min,上清液用17 mol/L氨水调节pH至8.4,将上清液均分两部分,其中一部分作为空白对照,加入8 μg过氧化氢酶,室温放置10 min。分别向两部分加入1 mL反應液(将20 mg 4-氨基安替比林,20 mg苯酚,5 mg过氧化物酶(150 U/mg)溶解在100 mL 100 mmol/L醋酸缓冲液(pH 5.6)),37 ℃水浴10 min,在505 nm条件下比色测定,每个样品重复6次。测定超氧阴离子时准确称取样品粉末0.20 g,加入1 mL 10 mmol/L的盐酸羟胺、3 mL 65 mmol/L磷酸缓冲液(pH 7.8)和1 mL 0.1 mol/L的EDTA-Na(pH 8.0),4 ℃条件下14 000 r/min离心15 min,向1 mL上清液中加入1 mL 7 mmol/L 1-萘胺和1 mL 17 mmol/L 4-对氨基苯磺酸,25 ℃水浴10 min。以磷酸缓冲液作为对照,在530 nm条件下比色测定,每个样品重复3次。
1.2.3 小麦胚内部显微结构观察。
将保存在固定液的小麦胚经过冲洗、染色、脱水、透明、浸蜡、包埋、切片(切片厚度定为8 μm)、贴片、烘片、脱蜡、固封过程,利用连续变倍实体显微镜SMZ1500观察小麦胚的内部结构[17]。
1.3 数据分析与处理
使用Microsoft Office 2013(Microsoft Corp.,Redmond,WA,USA)和IBM SPSS Statistics 22.0(IBM,Corp.,Armonk,NY,USA)软件进行数据处理和差异显著性分析、相关性分析。
2 结果与分析
2.1 不同基因型小麦胚发育过程中葡萄糖和蔗糖与成熟胚胚性愈伤率的关系分析
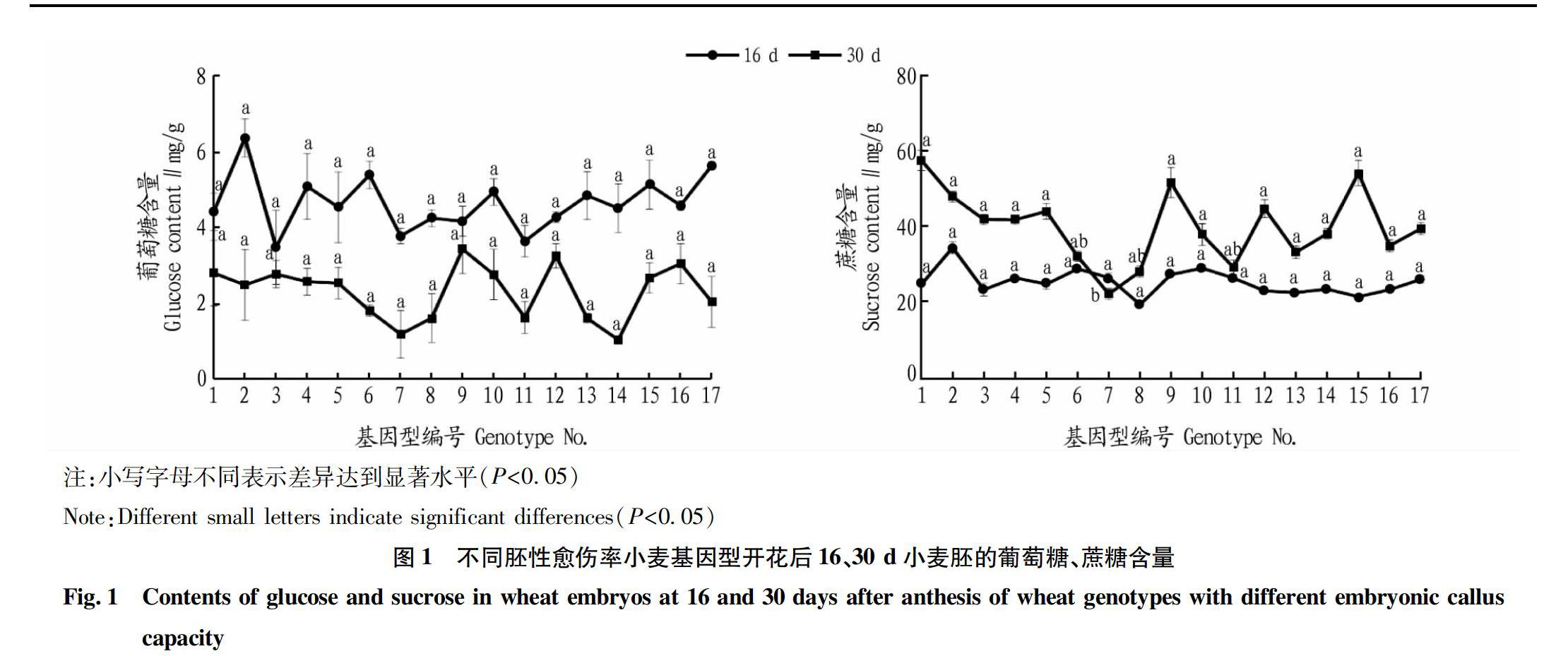
由图1可知,不同胚性愈伤率基因型开花后16、30 d小麦胚的葡萄糖含量平均值分别为4.65、2.33 mg/g,变异系数为15.83%和30.75%,相应同时期蔗糖含量平均值分别为25.66、40.23 mg/g,变异系数为13.45%和23.76%。小麦胚内葡萄糖含量随着胚的发育而降低,而蔗糖随之增加。但不同胚性愈伤率小麦胚葡萄糖和蔗糖含量在2个时期均未表现出显著差异。
2.2 不同基因型小麦胚发育过程中内源细胞分裂素和赤霉素与成熟胚胚性愈伤率的关系分析
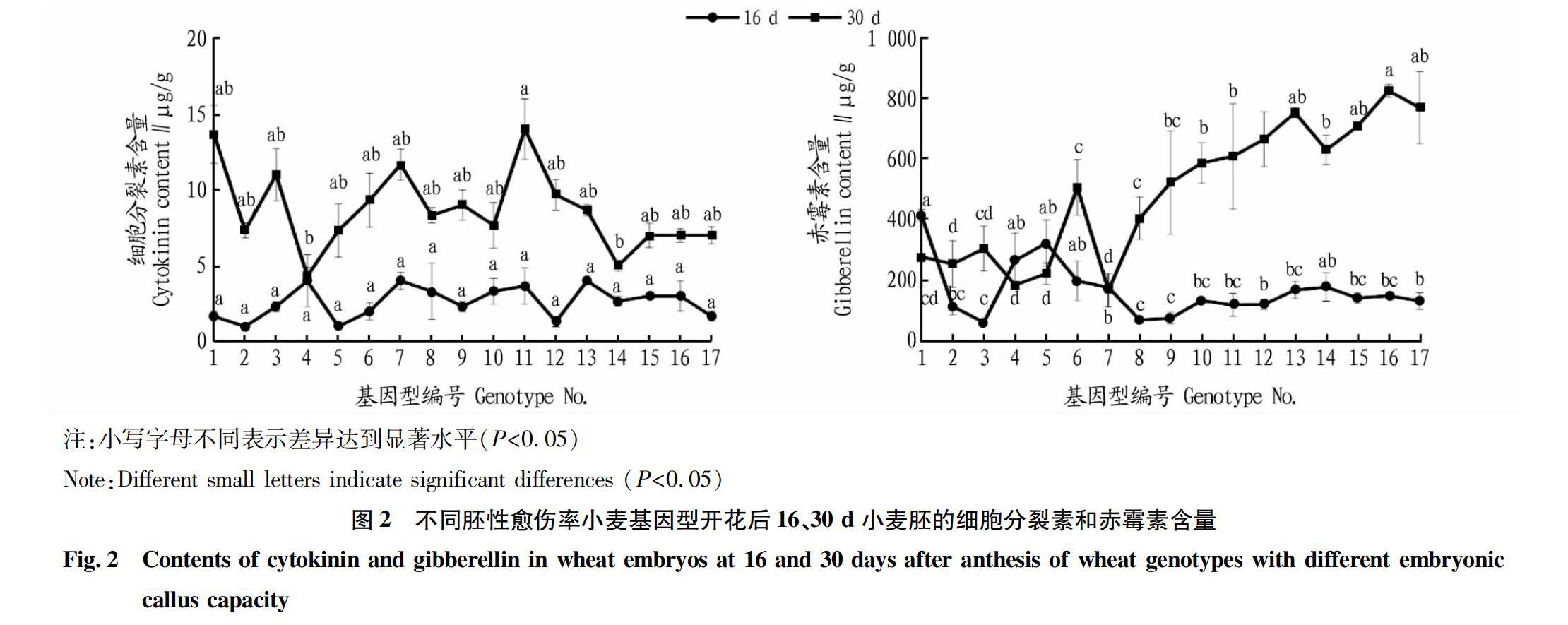
由图2可知,不同胚性愈伤率基因型开花后16、30 d小麦胚的细胞分裂素含量平均值分别为2.61、8.71 μg/g,变异系数达39.97%和30.75%,相应同时期赤霉素含量平均值分别为168.27、495.18 μg/g,变异系数为54.78%和44.98%。不同基因型小麦花后30 d胚内源细胞分裂素和赤霉素含量波动较大,其中赤霉素含量随着胚性愈伤率的提高而增加,且较高胚性愈伤率型小麦胚赤霉素含量显著大于低水平胚性愈伤率型。
48卷1期赵彦峰等 不同胚性愈伤率小麦胚发育过程生化和显微结构特征研究
2.3 不同基因型小麦胚发育过程中内源活性氧(ROS)与成熟胚胚性愈伤率的关系分析
由图3可知,不同胚性愈伤率基因型开花后16、30 d小麦胚的过氧化氢含量平均值分别为65.58、125.52 μg/g,变异系数为30.47%和39.73%;相应同时期超氧阴离子含量平均值分别为25.60、18.31 μg/g,变异系数达12.30%和83.00%,说明不同基因型小麦花后16 d胚内源活性氧含量表现稳定,而在花后30 d表现出较大波动。
2.4 不同基因型小麦胚发育过程中胚的生化指标与成熟胚胚性愈伤率的相关性分析
将各生化指标测定结果与胚性愈伤率作Pearson相关性分析,根据表2及图4发现小麦花后30 d小麦胚的赤霉素含量与胚性愈伤率呈极显著正相关(P<0.01),其他生化指标与胚性愈伤率的相关性均未达到显著水平。
2.5 不同胚性愈伤率的小麦胚内部显微结构分析
小麦胚的发育在授粉后6~7 d进入分化阶段,最初由原胚分化出胚芽,然后出现胚芽鞘,同时胚根开始分化。分化大约在开花授粉后15 d结束。成熟胚包括有盾片(即子叶)、胚芽鞘、茎生长点、胚根、胚根鞘等部分。从每类胚性愈伤率小麦基因型中选取3个基因型,分别对开花后16、30 d的小麦胚内部显微结构进行观察,从图5、6可以看出,3种类型小麦胚在2个发育阶段分别表现出细胞致密均匀且排列有序,盾片、胚芽鞘、胚根等均无明显差异。
3 讨论
为了提高小麦组织培养的再生率,人们通常关注的是如何改善培养基成分以及外源激素的种类和浓度比例[18],而对小麦胚的发育特性及其与成熟胚胚性愈伤率的相关性研究鲜见报道。该研究对具有不同成熟胚胚性愈伤率的小麦胚在2个发育阶段的部分生化指标进行测定,以探求不同胚性愈伤率材料之间胚发育过程的差异。
单子叶植物小麦的合子胚分化发育过程中胚内核酸、蛋白质、淀粉等持续增加,同时种子体内干物质也发生积累、贮藏和脱水等一系列生理变化,一直到小麦胚的成熟[19]。淀粉作为植物细胞内重要生物大分子能源物质,经淀粉酶水解成葡萄糖、蔗糖后,参与细胞内各种生理、生化反应,以直接或间接的方式影响胚状体发生。陈金慧等[20]在对杂交鹅掌楸体细胞体外诱导时发现,以蔗糖为渗透剂,提高渗透压有利于体细胞胚胎发生,推测蔗糖等糖类的积累有利于胚性细胞组织的形成发育。该研究测量了不同胚性愈伤率的麦胚在2个发育阶段的葡萄糖和蔗糖含量,但不同胚性愈伤率的麦胚中并未发现显著差异,说明小麦胚作为外植体在组织培养过程中,不同胚性愈伤率小麦胚发育过程中的葡萄糖、蔗糖含量对再生影响并不显著,再生所需的大部分碳源更可能是由培养基提供的[21]。
小麦体细胞发育过程受到多种信号级联机制的激活调控,生长素在植物胚胎发育过程中有着重要的调控作用,在胚胎的发育早期,生长素已经开始对茎尖分生组织的形成发挥作用[22],王义等[23]研究也表明生长素在人参体细胞胚胎发育早期达到最大值,在成熟胚阶段下降。此外,细胞分裂素在胚胎发育过程中也起着重要作用,刘玉博[24]认为合子胚干细胞和根尖干细胞的形成及分生组织的分化需要生长素的调控,而根尖干細胞的形成则需要细胞分裂素的参与。该研究中不同胚性愈伤率的小麦胚在2个发育阶段的生长素和细胞分裂素并未有显著差异,可能与取材时间有关。Hu等[25]研究发现,在拟南芥胚胎发育过程中,活性赤霉素的合成呈现出先升高后降低的时空特异性变化,并在晚期胚胎膨大阶段达到顶峰。该研究也发现较高胚性愈伤率型小麦的麦胚赤霉素含量显著高于较低胚性愈伤率型,这和Hu在拟南芥中的研究相吻合,推测小麦胚性愈伤形成与自身赤霉素含量可能存在重要联系。
除了激素作为细胞间信号分子调控小麦胚的发育外,细胞内部的胞质氧化还原状态也参与胚的发育调控。在拟南芥中,茎尖分生组织维持较高水平的O2·-和较低水平的H2O2有利于分生组织中干细胞的分化[26-28]。该研究中小麦胚的活性氧含量在胚性愈伤率不同的小麦基因型和小麦胚的不同发育阶段均未表现出显著差异,这说明小麦胚发育过程中活性氧的活动对成熟胚的再生能力并没有显著影响,但值得注意的是,在枸杞体细胞胚发生过程中,在培养基中加入低浓度的H2O2对体细胞胚的发生有促进作用[29],说明低浓度的H2O2可能有利于体外胚胎的发生。
在考察不同发育阶段小麦胚的生化特征与小麦成熟胚再生能力的关系时,考虑到小麦幼胚取材困难等因素,选取成熟胚胚性愈伤率作为衡量小麦再生能力的指标,但是成熟胚胚性愈伤率不能代表所有发育阶段小麦胚的再生能力,因此在以后的试验中应分析不同发育阶段小麦胚的再生能力与其对应的生化特性。此外,考虑到外界条件诸如天气、土壤肥力、病虫害等因素对小麦胚发育的影响,小麦胚的生化差异也可能是由其他因素引起的,今后应选用更多的小麦基因型进行重复试验。
4 结论
该研究对2个发育阶段不同胚性愈伤率小麦成熟胚的胚发育过程中生化指标进行测定,表明较高胚性愈伤率的小麦胚在发育晚期赤霉素含量较多。此结果在一定程度上可为探索筛选高效再生小麦基因型及优化其组织培养体系提供参考依据,同时为探究和挖掘小麦再生性状基因提供借鉴。
参考文献
[1] 赵佩.小麦中几个与农杆菌转化与组织培养再生相关基因的克隆和功能分析[D].北京:中国农业科学院,2015.
[2] 叶兴国,佘茂云,王轲,等.植物组织培养再生相关基因鉴定、克隆和应用研究进展[J].作物学报,2012,38(2):191-201.
[3] ISHIDA Y,TSUNASHIMA M,HIEI Y,et al.Wheat(Triticum aestivum L.)transformation using immature embryos[M].New York:Springer,2015:189-194.
[4] WANG K,LIU H Y,DU L P,et al.Generation of marker free transgenic hexaploid wheat via an Agrobacterium mediated co transformation strategy in commercial Chinese wheat varieties[J].Plant biotechnology journal,2017,15(5):614-623.
[5] 陶丽莉,殷桂香,叶兴国.小麦成熟胚组织培养及遗传转化研究进展[J].麦类作物学报,2008,28(4):713-718.
[6] 伍碧华,郑有良,骆建明.小麦组织培养体细胞胚胎的次生胚状体发生研究[J].西南农业学报,2005,18(4)373-377.
[7] 陈俊男,高润红,邓志英,等.小麦成熟胚组织培养体系优化及优良转化受体基因型的筛选[J].山东农业科学,2010(11):1-5.
[8] 刘芳,周翠红,李丽雅,等.不同遗传背景小麦成熟胚再生体系的初步研究[J].麦类作物学报,2010,30(1):39-42.
[9] 张东武,刘辉,赵惠贤.小麦成熟胚组织培养再生体系的优化及高再生率基因型的筛选[J].麦类作物学报,2011,31(5):847-852.
[10] 彭琳,张小红,闵东红,等.小麦成熟胚高频再生基因型筛选及再生体系研究[J].西北农业学报,2012,21(9):37-44.
[11] 栗聪,雒景吾,张磊,等.小麦成熟胚再生体系优化及优良受体基因型筛选[J].麦类作物学报,2014,34(5):583-590.
[12] 汤益,王志成,崔桂宾,等.小麦成熟胚高效再生基因型筛选及愈伤组织生理特性评价[J].麦类作物学报,2016,36(10):1307-1314.
[13] 汤益,徐开杰,孙风丽,等.黄淮麦区部分普通小麦品种(系)高频再生基因型的筛选[J].麦类作物学报,2014,23(6):73-80.
[14] 逯平杰,代容春,叶冰莹,等.高效液相色谱法测定甘蔗节间果糖、葡萄糖和蔗糖的含量[J].食品科学,2011,32(2):198-200.
[15] 杨途熙,魏安智,郑元,等.高效液相色谱法同时分离测定仁用杏花芽中8种植物激素[J].分析化学,2007,35(9):1359-1361.
[16] JIAO C J,JIANG J L,LI C,et al.β ODAP accumulation could be related to low levels of superoxide anion and hydrogen peroxide in Lathyrus sativus L.[J].Food Chem Toxicol,2011,49(3):556-562.
[17] 雒盼妮,王志成,王勇锋,等.胚性愈伤率不同的普通小麦成熟胚生化及形态特性的差异[J].麦类作物学报,2016,36(6):728-735.
[18] 黄学林,李筱菊.高等植物组织离体培养的形态建成及其调控[M].北京:科学出版社,1995:179-184.
[19] 崔凯荣,戴若兰.植物体细胞胚发生的分子生物学[M].北京:科学出版社,2000:96-101.
[20] 陈金慧,施季森,诸葛强,等.杂交鹅掌楸体细胞胚胎发生研究[J].林业科学,2003,39(4):49-53.
[21] 邢莉萍,王华忠,蒋正宁,等.小麦幼胚再生培养体系优化及优良转化受体基因型的筛选[J].麦类作物学报,2008,28(2):187-192.
[22] 许智宏,种康.植物细胞分化与器官发生[M].北京:科学出版社,2015:210.
[23] 王义,赵文君,孙春玉,等.人参体细胞胚胎发生过程中内源激素变化和基因表达研究[J].中草药,2008,39(7):1084-1089.
[24] 刘玉博.细胞分裂素和生长素调控拟南芥体细胞胚根端分生组织建立的分子基础[D].泰安:山东农业大学,2011.
[25] HU Y L,ZHOU L M,HUANG M K,et al.Gibberellins play an essential role in late embryogenesis of Arabidopsis[J].Nat Plants,2018,4(5):289-298.
[26] ZENG J,DONG Z,WU H,et al.Redox regulation of plant stem cell fate[J].The EMBO Journal,2017,36(19):2844-2855.
[27] CONSIDINE M J,FOYER C H.Redox regulation of plant development[J].Antioxid Redox Signal,2014,21(9):1305-1326.
[28] LUDIN A,GUR COHEN S,GOLAN K,et al.Reactive oxygen species regulate hematopoietic stem cell self renewal,migration and development,as well as their bone marrow microenvironment[J].Antioxid Redox Signal,2014,21:1605-1619.
[29] 崔凱荣,任红旭,邢更妹,等.枸杞组织培养中抗氧化酶活性与体细胞胚发生相关性的研究[J].兰州大学学报(自然科学版),1998,34(3):93-99.
