用中国仓鼠卵巢细胞构建内切-β-N-乙酰氨基葡糖苷酶筛选系统
2020-01-19喜多岛敏彦高晓冬
薛 威, 喜多岛敏彦, 高晓冬
(江南大学 生物工程学院,江苏 无锡214122)
蛋白质天冬酰胺连接的糖基化(N-糖基化)是高等真核生物中重要的蛋白质翻译后修饰途径。 天冬酰胺连接的糖链(N-糖链)可以帮助蛋白质在内质网中正确折叠[1];在高尔基体中,糖链末端的甘露糖会被水解掉,然后N-乙酰氨基葡萄糖转移酶I 在糖链末端加上一个N-乙酰葡糖胺(GlcNAc)[2],接下来一系列糖基转移酶进一步修饰糖链结构。 各酶的底物特异性和相对活性的差异导致同一糖蛋白在细胞内也可能携带不同的糖链结构。 这种糖链结构上的异质性不仅会影响蛋白质的纯化和生产可重复性,还可能影响药用蛋白质的药物动力学特性和生物活性[3-4]。 通过基因组编辑改变细胞N-糖链修饰途径可以优化糖链结构,然而蛋白质的糖链依然存在一定异质性[5]。
内切-β-N-乙酰氨基葡糖苷酶(ENGase)是一类水解N-糖链中核心壳二糖之间β-1,4-糖苷键的酶类。 它具有两大家族, 即糖苷水解酶85 家族(GH85)和糖苷水解酶18 家族(GH18)。 GH18,如Endo-H, 具有水解糖苷键的功能。 而Endo-M 和Endo-Om 等GH85 除具有水解酶功能外,还可以将整个寡糖转移到含一个GlcNAc 的受体上[6-9]。 化学酶合成法合成均一糖蛋白就是利用该类酶的转糖基功能。 该方法的应用潜力受到糖苷酶的底物选择性及活性的限制,如何开发出高活性和低底物选择性的ENGase 仍然是一个很大的挑战。
绿色荧光蛋白(GFP)由238 个氨基酸组成,其11 个β 折叠和4 个α 螺旋构成圆筒形结构, 通常情况下会形成二聚体。 将第221 位亮氨酸突变成赖氨酸(L221K)可得到单体绿色荧光蛋白(mGFP);第65 位丝氨酸突变成苏氨酸(S65T)后蛋白质荧光增强(EGFP)[10]。 自被发现以来,绿色荧光蛋白及其各种突变体在基因表达水平研究、 蛋白质定位分析、蛋白质糖基化研究、膜蛋白拓扑结构分析等方面具有广泛应用[11-15]。研究表明,将GFP 的147 位天冬酰胺突变成苏氨酸(N147T),使其含有一个N-糖基化位点(N-glycosylatable GFP,Ng-GFP),该突变体荧光强度对N-糖基化敏感[14]。本研究中作者使用的是荧光增强的单体绿色荧光蛋白(mEGFP) 及其147糖基化突变体Ng-mEGFP。 在与人N-乙酰氨基葡萄糖转移酶(hGnTI)跨膜区域(1~99 aa)融合表达后, 成功将Ng-mEGFP 定位到中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO K1) 高尔基体中,并筛选出表达融合蛋白hGnTI- mEGFP (GE)和hGnTI- Ng-mEGFP (GN) 的 单 细 胞 株K1GE 和K1GN。用衣霉素处理后,K1GN 细胞荧光强度降低,同时细胞糖基化被抑制,二者呈现很好的相关性。
1 材料与方法
1.1 质粒、菌株和细胞株
酵母表达载体pRS-424-TEF-αfactor-mEGFPHDEL、 动物细胞表达载体pME18sf-PGKpPuro 和pME-Zeo-hGnTI-EGFP-Flag、 大 肠 杆 菌E. coliDH5α、中国仓鼠卵巢细胞:均为作者所在实验室保存; 质 粒pRS-424-TEF-αfactor-Ng-mEGFPHDEL:为作者所在实验室柳艺石构建。
1.2 主要试剂
DNA 聚合酶PrimeSTAR、DNA 限制性内切酶、T4DNA 连接酶: 大连TaKaRa 公司; 氨苄青霉素、goat serum 、SanPrep 柱式质粒DNA 小量抽提试剂盒、SanPrep 柱式DNA 胶回收试剂盒、SanPrep 柱式PCR 产物纯化试剂盒: 上海Sangon Biotech;Triton X-100、多聚甲醛:SIGMA;Endo Hf、PNGaseF:NEB;DNA ladder Marker、Mouse Anti-GFP、Goat Anti-Mouse HRP:北京全式金生物;Rabbit Anti-GPP130:BioLegend;BSA、磷酸盐缓冲液(PBS)、嘌呤霉素、Lipofectamine2000、Alexa Fluor® 488 chicken antimouse IgG (H +L) conjugate、Alexa Fluor ® 555 donkey anti-rabbit IgG (H+L):Invitrogen。 氯化铵、SDS、NaCl、Tris、HCl:国药集团化学试剂有限公司。
封闭缓冲液A:含1% BSA,0.1% NaN3和0.1%Triton X-100 的PBS 溶液。
封闭缓冲液B:含2.5% goat serum,0.05% NaN3和0.1% Triton X-100 的PBS 溶液。
细胞裂解液:含20 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,1% Triton X-100,0.1% SDS 的PBS 溶液。
1.3 引物设计与合成
以mEGFP 为模板设计扩增引物, 在末端加10个组氨酸作为标签(华大基因合成):
上游引物 (mEGFP-F):5’-gcgcACGCGTATGG TGAGCAAGGGCGAGGAGCTG-3’,含MluI 位点;
下游引物(mEGFP-10His-TAA):5’- aaaaGCG GCCGCTTAGTGGTGGTGGTGATGGTGATGATGATG ATGCTTGTACAGCTCGTCCATGCCGAGAG -3’, 含NotI 位点。
1.4 质粒构建
用1.3 中 引 物, 以pRS-424-TEF-αfactormEGFP -HDEL 或 pRS -424 -TEF -αfactor -Ng -mEGFP-HDEL 为模板PCR 扩增得到mEGFP 和Ng-mEGFP 的DNA 片段。PCR 条件如下:94 ℃预变性2 min;98 ℃变性30 s;50 ℃退火30 s;68 ℃延伸80 s,35 个循环。 以上PCR 产物经纯化后双酶切(MluI 和NotI); 质粒pME-Zeo-hGnTI-EGFP-Flag双酶切 (XhoI 和MluI) 得到高尔基体定位序列hGnTI; 质粒pME18sf-PGKpPuro 双酶切 (XhoI 和NotI)得到整合质粒空载体。以上双酶切(37 ℃、3 h)产物用1 g/dL 琼脂糖凝胶做胶回收,得到的产物按照2∶2∶1(V∶V∶V)比例加入10 μL 体系连接(16 ℃、3 h)。 取5 μL 连接产物转化大肠杆菌感受态E. coliDH5α,氨苄青霉素平板筛选阳性克隆子,得到整合质 粒 pME18sf -PGKpPuro -hGnTI -mEGFP 和pME18sf-PGKpPuro-hGnTI-Ng-mEGFP。 所有质粒均送上海Sangon Biotech 测序。
1.5 整合质粒线性化
按以下操作顺序将整合质粒pME18sf-PGKpPuro-hGnTI-mEGFP 和pME18sf-PGKpPurohGnTI-Ng-mEGFP 线性化: 取10 μg 质粒单酶切(FspI,37 ℃,3 h); 向酶切体系中加入1/10 体积的醋酸钠和2.5 倍体积无水乙醇(-20 ℃,20 min);离心(15 000 r/min、5 min), 去上清液; 加入500 μL 70% 乙醇,振荡混匀;离心(15 000 r/min、5 min),去上清液;室温干燥;将DNA 沉淀溶于20 μL TE 用于线性化转染。
1.6 细胞培养和线性化转染
CHO K1 细胞用含10%胎牛血清(BI)的DMEM(Gibco)培养基在37 ℃、5% CO2条件下于10 cm 培养皿贴壁生长。 转染前,胰酶(Gibco)消化细胞接种于6 cm 培养皿(接种密度40%)。 培养24 h 后换4 mL 新培养基, 同时加入线性化质粒(Lipofectamine2000 操作手)。培养12 h 后换新培养基。
1.7 单克隆细胞株筛选和细胞药物处理
线性化转染3 d 后,消化细胞,用含6 μg/mL 嘌呤霉素的DMEM 培养基传代培养3 周获得稳定表达嘌呤霉素抗性基因的混合细胞株,利用有限稀释法筛选单细胞株。
对于衣霉素(Tunicamycin)处理实验,细胞接种于6 孔板 (接种密度30%), 用不同浓度衣霉素的DMEM 培养基培养48 h,胰酶消化收集细胞用于分析。
1.8 流式细胞仪荧光分析
胰酶消化收集细胞于1.5 mL 离心管,用500 μL磷 酸 盐 缓 冲 液 (phosphate buffered saline,PBS,Sangon)洗涤并重悬。 用BD Accuri C6(BD)流式细胞分析仪检测细胞绿色荧光蛋白质信号。
1.9 激光共聚焦荧光定位分析
细胞经4 ℃PBS 洗两次后, 用4% 多聚甲醛PBS 溶液孵育20 min 使其固定。 PBS 清洗两次,然后用50 mmol/L 氯化铵PBS 溶液孵育10 min。 吸去氯化铵溶液, 用封闭缓冲液A 透化细胞60 min,然后 用 含 一 抗 (Mouse Anti-GFP 或Rabbit Anti-GPP130;1∶400)的封闭缓冲液B 孵育60 min。 用封闭缓冲液A 清洗两次除去一抗, 然后加入含二抗(Alexa Fluor® 488 chicken anti-mouse IgG (H+L)conjugate 或Alexa Fluor® 555 donkey anti-rabbit IgG(H+L),1∶800)的封闭缓冲液A 孵育60 min。 用Nikon C2si 共聚焦显微镜收集细胞荧光信号数据,NIS-Elements AR analysis4.20.00 处理输出图片,Photoshop 调整图片对比度。
1.10 Endo Hf、PNGaseF 处理和蛋白质免疫印迹
6 孔板长满后收集细胞于1.5 mL 离心管,用500 μL 4 ℃PBS 洗一次,离心除去PBS。 用100 μL细胞裂解液裂冰上解细胞30 min,离心(1 500 r/min、10 min)收集上清液蛋白质。在蛋白质溶液中加入变性剂,使其终浓度为0.5% SDS 和0.5 mmol/L DTT,然后于95 ℃加热5 min,使蛋白质彻底变性。 每30微升蛋白质中加入1 μL Endo Hf 或PNGaseF 于37℃孵育3 h。 用10%聚丙烯酰胺凝胶跑蛋白质电泳,用Mouse Anti-GFP (1∶5 000) 和Goat Anti- Mouse HRP(1∶6 000)检测目标蛋白质。
2 结果与讨论
2.1 mEGFP 和Ng-mEGFP 整合质粒的构建
按照1.4 中的方法, 成功构建整合质粒pME18sf-PGKpPuro-hGnTI-mEGFP 和pME18sf-PGKpPuro-hGnTI-Ng-mEGFP。 双酶切经1 g/dL 琼脂糖凝胶电泳检测,在1 066 bp 处为目标基因片段hGnTI- mEGFP(图1 泳道1)和hGnTI- Ng-mEGFP(图1 泳道2),5 124 bp 处为空载体。
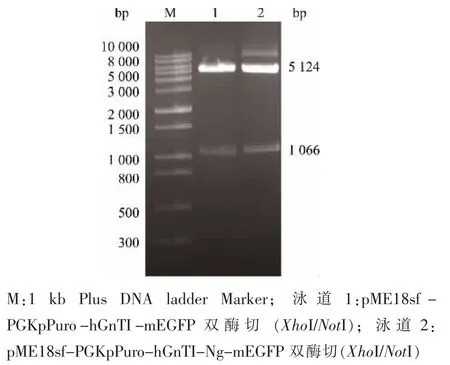
图1 整合质粒双酶切验证Fig. 1 Confirmation of the plasmids expressing GE and GN
2.2 mEGFP 和Ng-mEGFP 在CHO K1 细 胞 中的表达
利用1.6 中的方法将2.1 中质粒线性化后转染CHO K1 细胞,线性化转染的整合效率较低,作者用嘌呤霉素筛选整合成功的基因。 转染pME18sf-PGKpPuro-hGnTI-mEGFP 后,有39.9%的存活细胞获得了GN (图2 红色峰图); 转染pME18sf-PGKpPuro-hGnTI-Ng-mEGFP 后, 有58.0%存活细胞获得了GE(图2 绿色峰图)。 结果显示,融合了N-乙酰氨基葡萄糖转移酶的跨膜区域后,蛋白质仍然可以发出荧光, 且整合了GN 的细胞荧光明显弱于GE 的细胞荧光。 可以用此混合细胞株筛选出单细胞株用于进一步研究。
2.3 K1GN 和K1GE 单细胞株的筛选及绿色荧光蛋白质定位分析
得到稳定表达GN 和GE 的混合细胞株后,作者用有限稀释法筛选出单细胞株K1GN 和K1GE。单细胞株K1GN 细胞荧光强度约为K1GE 细胞的1/10(图3(a))。
GPP130 是一个定位在高尔基体的膜蛋白[16],被广泛用于高尔基体定位研究[17]。 作者用GPP130 作为高尔基体定位参照,图3(b)中间一列红色荧光定位图给出了结合抗GPP130 抗体的二抗发出的荧光,显示高尔基体的位置信息。 左侧一列绿色图给出了结合抗GFP 抗体的二抗发出的荧光, 显示GN在细胞中的位置。 可以看出GN 与GPP130 定位在相同位置。 结果表明,作者构建的融合蛋白质成功定位到了高尔基体。
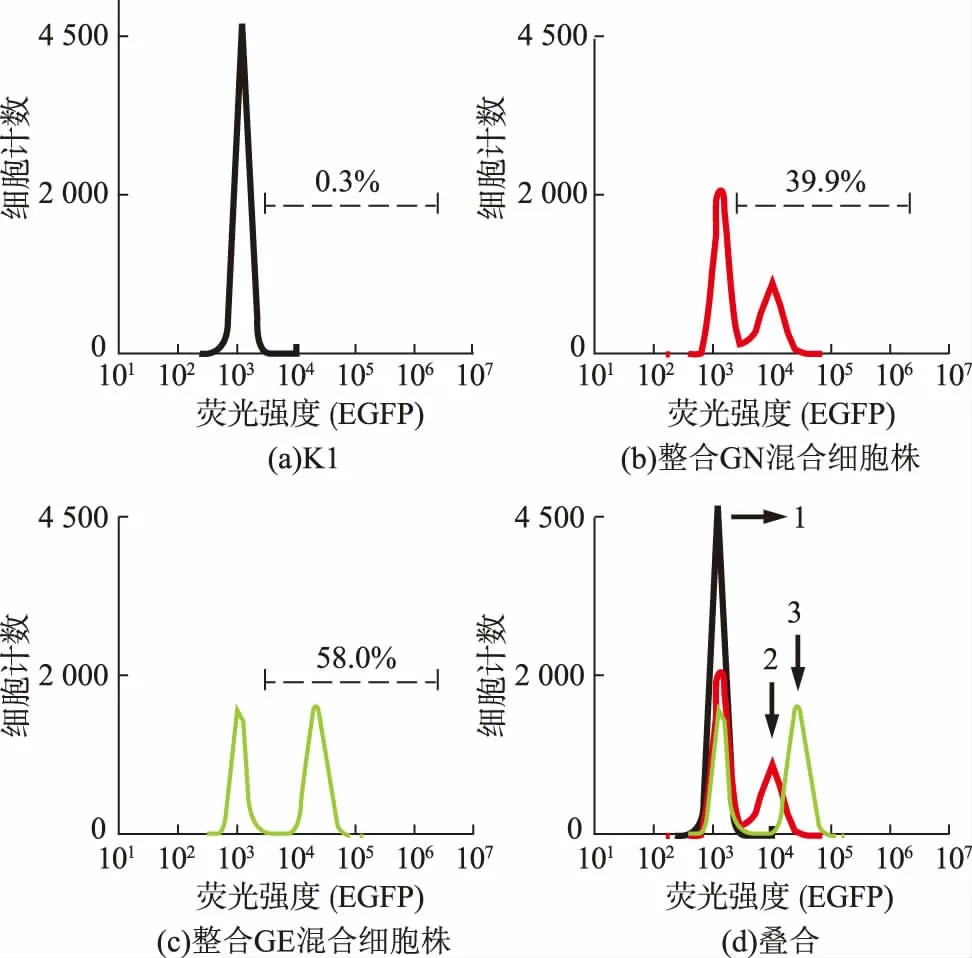
图2 线性化转染后混和细胞株荧光分析Fig. 2 Fluorescence of bulk population after liner transfection
2.4 N-糖链对K1GN 细胞荧光的影响
衣霉素(Tunicamycin)是一种类核苷酸抗生素,可以抑制阻断细胞N-糖链合成途径[18]。使用含有不同质量浓度衣霉素的DMEM 培养基培养细胞,2 d后收集细胞做流式细胞仪分析。 用DMSO 作为对照处理细胞,K1GN 的荧光信号强度约为1.4×104。 当衣霉素质量浓度大于0.5 μg/mL 时, 细胞荧光信号开始有明显降低(图4(b))。当衣霉素质量浓度大于1 μg/mL 时, 细胞EGFP 荧光信号峰出现明显偏移(图4(a)),此时细胞荧光强度约降低30%(图4(b)(c))。
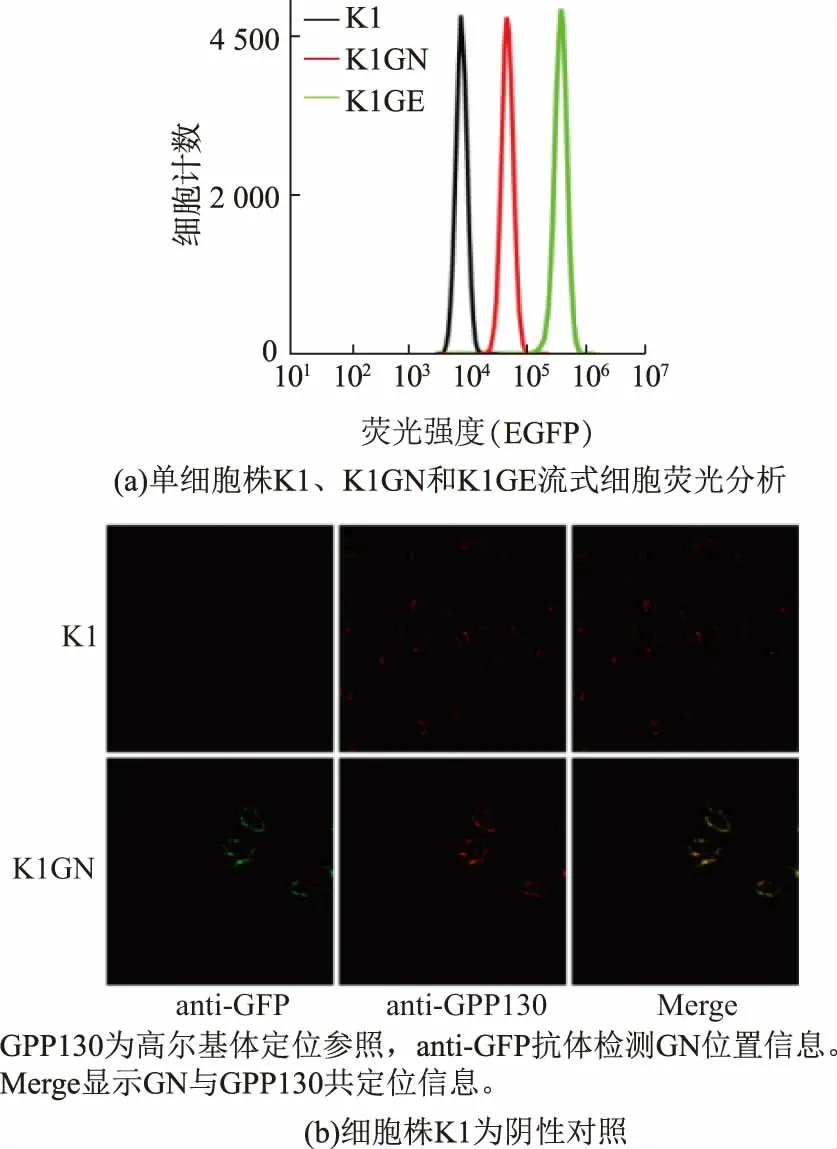

图3 单细胞株荧光分析及GN 定位分析Fig. 3 Fluorescence microscopy of single cell line expressing GN
为确定细胞荧光强度降低与绿色荧光蛋白的糖基化程度是否有关系, 作者提取图4A 中流式细胞仪分析所剩细胞的蛋白质,做蛋白质免疫印迹分析。当衣霉素质量浓度大于0.5 μg/mL 时,蛋白质糖基化水平明显降低,且随着衣霉素质量浓度逐渐提高,蛋白质糖基化水平会进一步降低,与细胞荧光强度变化有很好的相关性(图4(b)和图4(c))。 这一表型在该细胞株中稳定存在。 另外,被糖基化的蛋白质条带1 程弥散状态, 用PNGaseF 切除糖链后该条带消失(图4(c)),表明该蛋白质上糖链结构不均一,可以通过基因组编辑敲除高尔基体中蛋白质N-糖基化途径中下游特定基因,如St8sia IV、Fut4 等[19-20],在高尔基体中积累特定糖链结构的Ng-mEGFP。
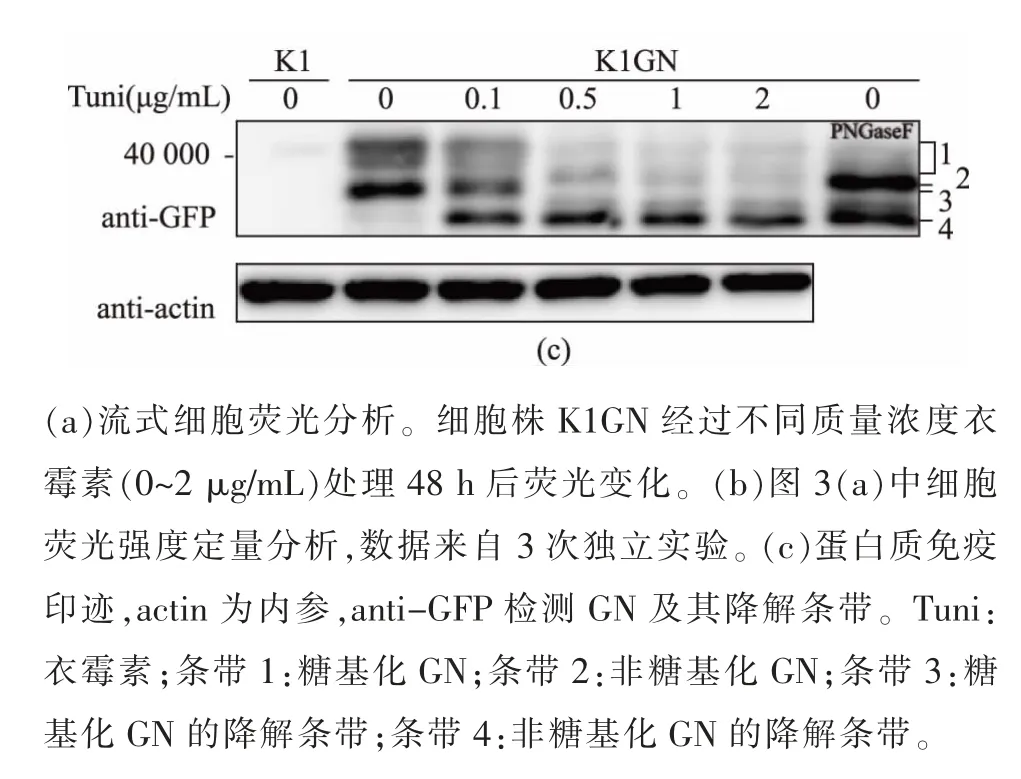
图4 N-糖基化对K1GN 细胞荧光的影响Fig. 4 Effect of N-glycasylation on mEGFP fluorescence
3 结 语
将N-乙酰氨基葡萄糖转移酶的跨膜定位区域与绿色荧光蛋白质融合表达,成功把带有天冬酰胺连接糖基化位点的单体增强绿色荧光蛋白质定位到中国仓鼠卵巢细胞的高尔基体中,并筛选得到单细胞株K1GN。流式细胞仪分析显示,融合了定位区域后的绿色荧光蛋白质仍可以发出荧光,在引入糖基化位点后,其荧光强度约降低10 倍。 用含不同质量浓度衣霉素的培养基培养细胞,蛋白质糖基化被抑制,同时细胞荧光信号强度相应减弱。 当衣霉素质量浓度大于1 μg/mL 时, 细胞EGFP 荧光信号峰出现明显偏移,此时细胞荧光强度约降低30%。 本研究证明了该细胞株荧光强度对N-糖基化敏感,可以在其高尔基体中表达ENGase, 检测细胞荧光强度及蛋白质糖基化水平以判定ENGase 的糖苷水解酶活性。
本研究所用mEGFP 第147 位糖基化突变体,内源表达该突变体的CHO 细胞在有无糖链情况下表现出一定荧光差异。 可以在mEGFP 不同位置引入糖基化位点,以筛选出在有无糖链下荧光差异更明显的突变体。
值得注意的是, 细胞荧光强度不仅与GN 的糖基化程度有关,还与该蛋白质在细胞中的表达量有关[11]。因此,该细胞株还可以用于蛋白质表达相关功能基因的高通量筛选研究。
