4-(2-吡啶基偶氮)-间苯二胺的合成及光谱分析
2020-01-16杨成希张萍萍颛孙凯莉陈兴政
吴 平,杨成希,张萍萍,颛孙凯莉,陈兴政
(吉林化工学院 化学与制药工程学院,吉林 132022)
偶氮化合物分子结构特征是由偶氮基团(-N=N-)连接芳环,偶氮化合物是经典染料[1],同时兼具光异构化性质,在光信息材料、生物分子的光调控和分子开关等方面引起研究者的广泛关注[2-3]。此外,邻对位含氨基的偶氮化合物在酸性条件下会接受质子发生互变异构,如甲基红、甲基橙和刚果红等,是良好的酸碱指示剂[4]。此外,当氨基和偶氮基处于邻位时,偶氮化合物还会在铜离子的作用下发生成环聚合或配位反应,在离子检测方面具有可观的应用前景[5-6]。
重氮偶合反应是合成偶氮苯类染料的传统方法,早在1861年,化学家曼恩就是利用重氮偶合反应获得了第一个芳香族偶氮化合物[7]。在前期工作基础上[8-9],我们以2-氨基吡啶、间苯二胺为原料通过重氮-偶合法合成4-(2-吡啶基偶氮)-间苯二胺(化合物1),考察影响合成反应的各个因素并对化合物进行结构表征,对化合物1进行紫外光谱分析。
1 实验部分
1.1 试剂与仪器
合成装置:JJ-1大功率电动搅拌器,FA104A电子天平,磁力加热搅拌器,XMT数显调节仪,循环水式多用真空泵,电热鼓风干燥箱,旋转蒸发器等;分析仪器:Nicolet 410红外光谱仪(KBr压片),Cary 60紫外可见分光光度计(Agilent有限公司)。
实验药品:2-氨基吡啶,间苯二胺,正丁醇,氢氧化钠,金属钠,乙醇,亚硝酸钠,盐酸,乙酸钠等,所有药品均为分析纯。水为蒸馏水。
1.2 化合物1的合成
亚硝酸正丁酯制备:在100mL烧杯中加入7.9 g正丁醇,7.36 g亚硝酸钠,8 mL水溶液,冰浴控温0~5℃,滴加浓盐酸8.3 mL,滴加完毕后,保持0~5℃,搅拌反应1h。反应结束后,分离得上层有机相,为浅黄色油状液体,含有亚硝酸正丁酯。
重氮化反应:称取0.75 g金属钠切成小块,分次加入12.5 mL干燥纯化后的无水乙醇中。钠块在液面游动并产生气泡,同时放热,待金属钠完全溶解,将醇钠溶液加入到溶有2.6 g 2-氨基吡啶的50 mL无水乙醇溶液中,再加入上步实验分液得到的亚硝酸正丁酯溶液,在磁力搅拌锅中加热搅拌黄褐色溶液回流8h。
偶合反应:在冰浴条件下,将3.0 g间苯二胺的乙醇溶液缓慢滴加到上述重氮盐溶液中,调节pH值至8~9,直到深红色出现。静置过夜,过滤得红色滤饼,再通过硅胶柱层析提纯即为产物。
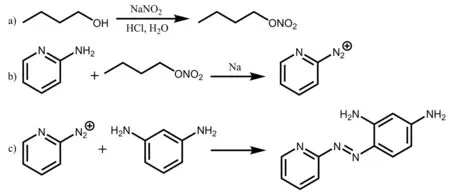
图1 化合物1合成示意图
1.3 光谱测量过程
1.3.1 红外光谱
取用1~2 mg干燥纯净样品粉末,与200 mg的干燥溴化钾粉末,在研钵中混合压片,将所压药品置于光路中进行红外谱图测定,波数范围400~4000 cm-1,整理并记录结果。
1.3.2 紫外光谱
取干燥清洁的10 mL容量瓶,加入10 mg化合物1,用乙醇溶解,待样品完全溶解,定容;将配好的样品溶液稀释至四分之一,备用。取1000 μL乙醇与比色皿中,对机器进行调零;依次加入适量不同pH值的缓冲溶液,测绘吸收曲线,再每次加入10 μL稀释后的样品,重复上诉步骤,整理并记录结果。
化合物1:分别在3 mL pH值1.0,2.0,3.0,4.0,5.0,6.0缓冲溶液加10 μL稀释后的样品,逐次递增10 μL样品,重复6-7组。缓冲溶液组成:pH值=1.0缓冲溶液(10 mL):6.7 mL 0.2mol/L盐酸 + 2.5 mL 0.2 mol/L氯化钾 + 0.8 mL超纯水;pH值=2.0缓冲溶液(10 mL):0.65 mL 0.2 mol/L盐酸+ 2.5 mL 0.2 mol/L氯化钾 + 6.85 mL超纯水;pH值=3.0缓冲溶液(10 mL):2.23 mL 0.1 mol/L盐酸+ 2.5 mL 0.2 mol/L邻苯二甲酸氢钾 + 5.27 mL超纯水;pH值 = 4.0缓冲溶液(10 mL):1.8 mL 0.2 mol/L醋酸钠+ 8.2 mL 0.2 mol/L醋酸;pH值 = 5.0缓冲溶液(10 mL):7.05 mL 0.2 mol/L醋酸钠 + 2.95 mL 0.2 mol/L醋酸;pH值=6.0缓冲溶液:0.56 mL 0.1 mol/L氢氧化钠 + 2.5 mL 0.2 mol/L磷酸二氢钾 + 6.94 mL超纯水。
2 结果与讨论
2.1 重氮化方法对产物1的影响
通常重氮化方法是用亚硝酸钠在稀盐酸存在下与芳胺在低温下反应。但本实验中,由于2-氨基吡啶本身比较特殊,它不能在酸性水溶液中进行重氮化,在酸性溶液中重氮化后生成的重氮盐能与水作用生成相应的吡啶酮,如在盐酸中重氮化则生成氯代吡啶,而得不到重氮盐,这可能是由于吡啶的特殊共振结构所决定的。本文对氨基吡啶的重氮化采用亚硝酸正丁酯,在有机碱醇钠存在下,乙醇溶液中加热回流重氮化,生成重氮酸盐的沉淀用于重氮化反应,再应用于后续的偶联反应[10]。
2.2 红外光谱分析
红外光谱测定结果表明,在波数1450~1650 cm-1范围内归因为在苯环骨架振动,在3400~3500 cm-1范围内为氨基-NH2的伸缩振动峰,红外吸收峰与化合物1的化学结构存在对应,化合物1的红外光谱见图2。
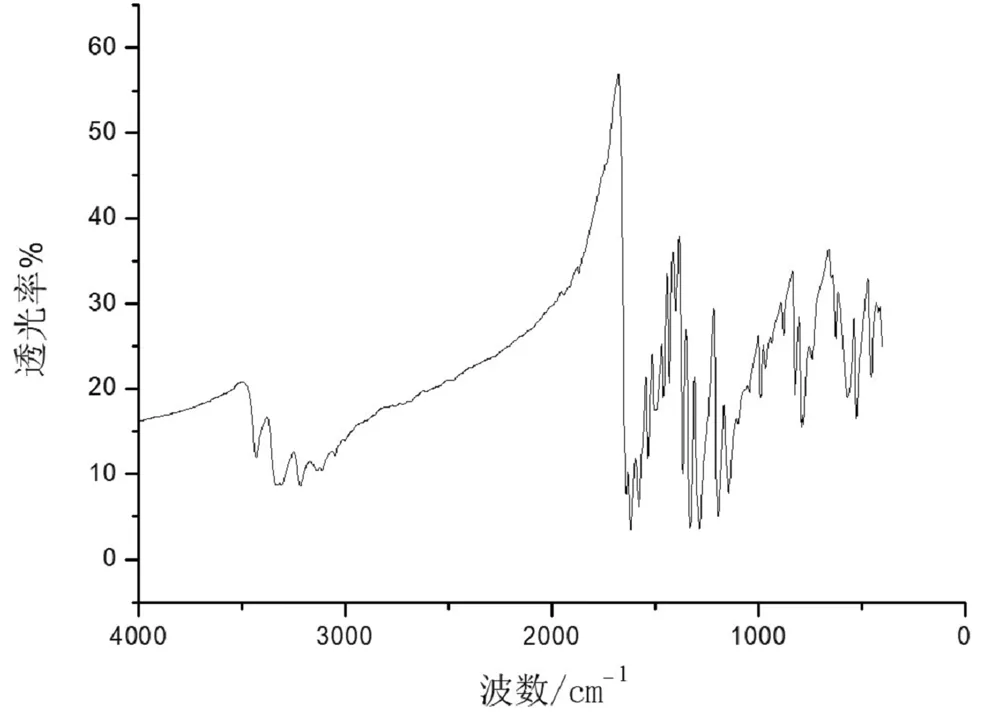
图2 化合物1的红外光谱图
2.3 不同pH值条件下化合物1的紫外光谱
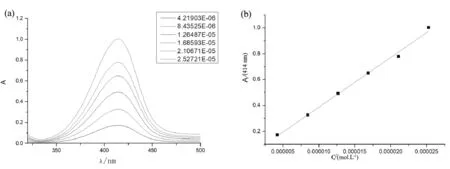
图3 (a) 室温下pH值=1.0溶液中化合物1紫外光谱图;(b) Abs-c图
室温下pH值=1.0溶液中化合物1紫外光谱、Abs-c见图3,紫外光谱可见,pH值=1.0时,化合物1的最大吸光度出现在414 nm处。化合物1的浓度依次为:4.22×10-6,8.44×10-6,1.26×10-5,1.69×10-5,2.11×10-5,2.52×10-5mol/L。在上述浓度范围内,从c-A曲线上可见(图3b),其具有良好的线性关系y = 3.8396×104X + 0.0045,根据朗伯-比尔定律A= εbc,可得出ε=3.84 ×104L/mol·cm,其摩尔吸光系数大,在显色反应中灵敏度高。表1列出不同pH值条件下化合物1的最大吸收峰的峰位和摩尔吸光系数ε值。
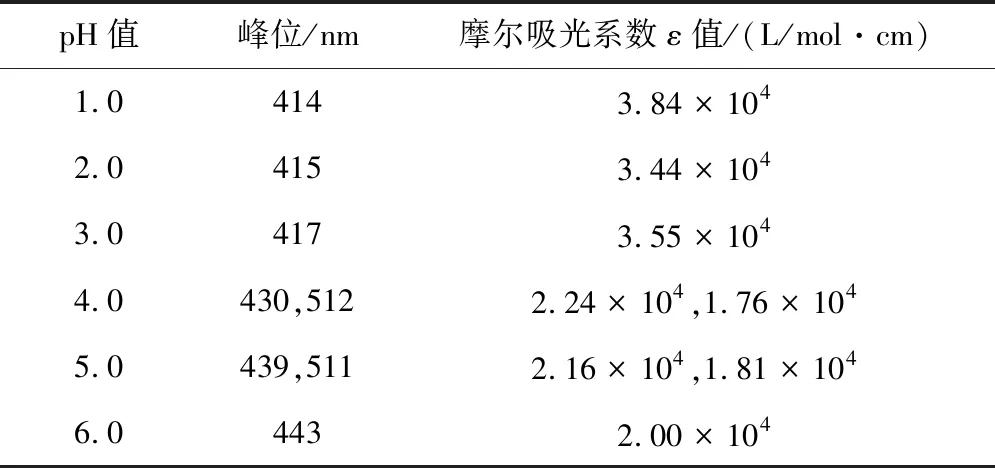
表1 pH值 = 1.0~6.0范围内化合物1紫外光谱数据表
从图4可见,在pH值=1.0~6.0范围内,化合物1的紫外光谱峰形出现变化,吸收峰峰位向长波移动,即红移。
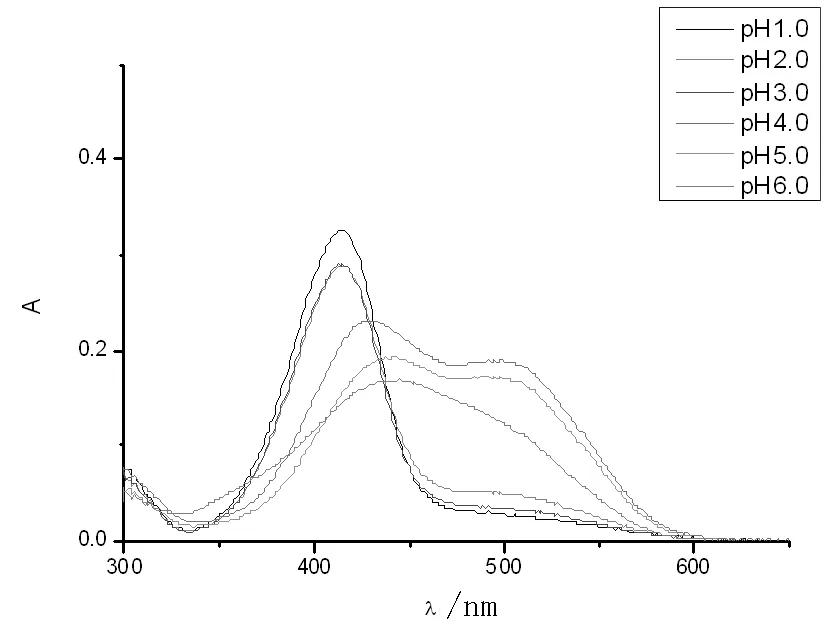
图4 pH值 = 1.0~6.0范围内化合物1(8.44×10-6 mol/L)紫外光谱图
3 结论
本文以2-氨基吡啶,间苯二胺为原料,在亚硝酸正丁酯作用下对2-氨基吡啶进行了重氮化反应,进一步通过偶合反应合成2'-吡啶-间二氨基偶氮苯(化合物1),对重氮试剂制备过程进行分析。利用红外光谱对化合物1进行了结构表征,紫外光谱分析结果表明化合物1具有较大的摩尔吸光系数,在酸性范围内存在异构现象。
