聚苯胺/硫化铜复合材料的制备及其近红外吸收性能
2020-01-10魏海波范俊龙徐光亮
雷 琴, 魏海波, 黄 勇, 范俊龙, 徐光亮
(1. 西南科技大学环境友好能源材料国家重点实验室, 绵阳 621010;2. 西南科技大学材料科学与工程学院, 绵阳 621010)
1 引 言
无机近红外吸收材料,因其较好的吸收性能并且制备简单而备受关注. 硫化物因为可以产生能带跃迁,具有极好的近红外光吸收性能[1]. 其中,硫化铜具有低成本、低细胞毒性. 硫化铜的制备方法主要有:模板法[2]、水热法[3]、微乳液法[4]和超声波合成法[5]. 李璐璐等[6]通过水热法制备具有花状结构的硫化铜,其吸光系数是片状硫化铜的两倍;随后其采用高温液相法制备了Cu9S5纳米晶,在600~1 100 nm近红外区域内有较强的宽吸收. 徐磊等[7]采用新型超声喷雾法制备了粒径为100~200 nm的硫化铜纳米粒子(CuxS,1≤x≤2),在1 400~2 500 nm波段有较强的吸收,且红外透过率低于30%,同时保持了对可见光的高透过性. Tian等[8]采用可控热液路线,辅以聚乙烯吡咯烷酮合成了花状结构硫化铜且在能量密度为0.51 W·cm-2的激光照射(980 nm)下,5 min内样品表面温度可升高17.3 ℃,并将其应用于体内外光热治疗.
聚苯胺具有原料价格低、导电性能佳且可逆、环境稳定性好、合成工艺简易等优点,其吸收峰也容易通过掺杂物带来的电子转移而改变位置,如当聚苯胺上的亚胺基团转变成亚胺盐时,其在近红外区域有明显吸收,这为近红外的研究奠定了基础. 颜海燕等[9]对不同质子酸掺杂聚苯胺进行了系统研究,结果表明其吸收峰确会发生红移. Yang等[10]开发了一类基于聚苯胺的新型光热转换材料,吸收峰的最高点由570 nm转移到了780 nm附近,并通过升温实验和体内肿瘤消融实验证明了其良好的近红外吸能和光热转换效果. 结果表明,跟本征态的聚苯胺亚胺纳米颗粒相比,聚苯胺翠绿亚胺盐纳米颗粒的近红外吸收峰的位置出现了比较明显的红移. 但是,聚苯胺存在还原态、中间态、氧化态且相互之间能够可逆转换,因此,需要进一步研究基于聚苯胺的新型复合近红外吸收材料.
本文拟结合硫化铜和聚苯胺的优势,采用原位聚合法复合制备聚苯胺/硫化铜近红外吸收材料.
2 实验部分
2.1 试 剂
五水硫酸铜(CuSO4·5H2O,99.5%)、硫(S,99.0%)、聚乙烯吡咯烷酮K30(PVP,99.0%)、苯胺(An,AR)、过硫酸铵(APS,AR)、浓盐酸(HCl,AR)、无水乙醇(C2H5OH)产自成都市科隆化学品有限公司,N-甲基吡咯烷酮(NMP,99.0%)产自阿拉丁试剂(上海)有限公司.
2.2 硫化铜的制备
采用溶剂热法制备硫化铜. 实验过程为(以表1第1组实验为例):称量0.25 g的PVP于50 mL烧杯中;然后,加入NMP(15.0 mL)溶解分散,搅拌至溶液澄清透明后,加入1.0 mL(1 mmol·L-1)的CuSO4·5H2O溶液,继续搅拌10 min,得亮绿色透明溶液,移入100 mL聚四氟乙烯反应釜内;然后称取0.032 g(1.0 mmol)硫粉加入聚氟乙烯反应釜内,搅拌10 min后,于160 ℃下反应4 h. 反应结束后,移除上清液,收集下层悬浊液,经离心、高纯水洗涤3次、无水乙醇洗涤2次;最后60 ℃真空干燥8 h,得到黑色硫化铜粉末. 实验示意图、正交实验因素与水平表、L9(34)正交设计实验表如图1、表1、表2所示. 通过正交实验得到最优条件并制备样品.

图1 溶剂热法合成硫化铜示意图Fig.1 Schematic of the solvent thermal synthesis of CuS
表1L9(34)正交设计及实验结果
Tab.1 L9(34) orthogonal design and experimental results
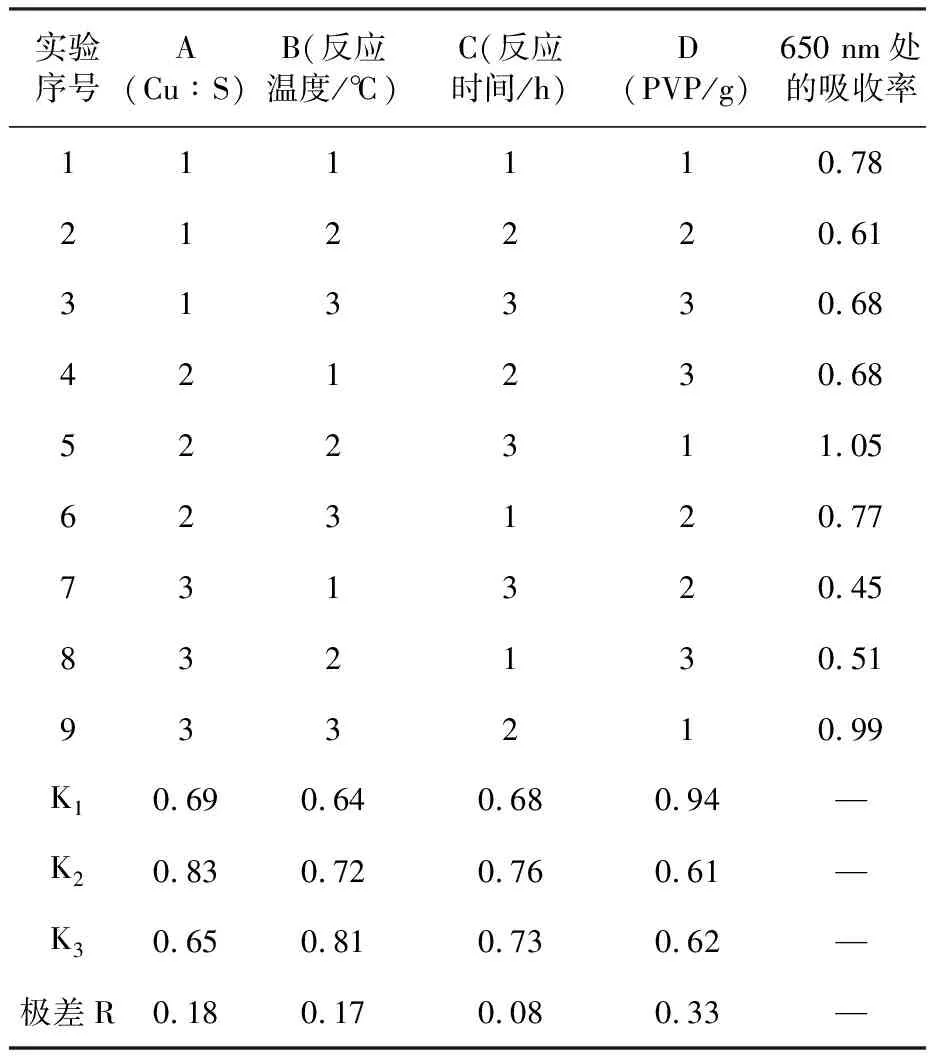
实验序号A(Cu∶S)B(反应温度/℃)C(反应时间/h)D(PVP/g)650 nm处的吸收率111110.78212220.61313330.68421230.68522311.05623120.77731320.45832130.51933210.99K10.690.640.680.94—K20.830.720.760.61—K30.650.810.730.62—极差R0.180.170.080.33—

表2 正交实验因素与水平表
2.3 聚苯胺/硫化铜复合材料的制备
以五水硫酸铜(CuSO4·5H2O)与硫粉(S)为原料通过正交实验得到最优条件制备的硫化铜,分别制备含硫化铜20 wt%、30 wt%、40 wt%、50 wt%的聚苯胺/硫化铜复合材料,制备过程为:分别将硫化铜(0.30、0.45、0.60、0.75g)、苯胺(2.27 mL)和盐酸(50.0 mL,2 mol/L)依次加入250 mL预先用冰水浴降温至0~5 ℃的三口烧瓶内,以350 r·min-1搅拌至温度恒定至0~5 ℃时,滴加预先配制的过硫酸铵盐酸溶液(50.0 mL盐酸与0.037 5 mol过硫酸铵混合液),30 min滴加完成;继续搅拌反应6 h,混合物依次经抽滤、盐酸(0.33 mol/L)、无水乙醇、蒸馏水洗至滤液为中性;将固体产物于真空干燥器(65 ℃)中干燥48 h得复合材料.
2.4 表征分析
物相分析采用X射线衍射仪(荷兰,PANalytic 公司,X’Pert PRO型),Cu靶,Kα辐照,波长λ=1.540 6 Å,管电流I=40 mA,管电压V=40 kV;采用红外光谱仪(美国热电,380FT-IR)分析样品组成结构;采用场发射扫描电镜(德国,Carl zeiss NTS GmbH,UItra55型)分析样品形貌. 采用固体漫反射紫外-可见-近红外光谱(岛津企业管理(中国)有限公司,Solidspec-3700型)分析产物的近红外吸收性能,波长为500~1 500 nm.
3 结果与讨论
3.1 硫化铜的XRD与FT-IR
从XRD谱图可知,图2a(1~9号样品),均在2θ值为27.9°、29.4°、31.8°、32.8°、47.9°、52.6°和59.3°处有明显的衍射峰,表明样品有较好的结晶度,且与标准卡片JCPDS NO.06-0464一致. 同时,27.9°、29.4°、31.8°、32.8°、47.9°、52.6°、59.3°分别归属于101、102、103、006、110、108、116晶面,表明制备的硫化铜为六方靛铜矿结构,且结晶度较高. 但是,当Cu∶S(摩尔比)为1∶4时(图2a,7~9号样品),在23.1°有衍射峰出现,可能是硫过量生成了Cu9S8(标准卡片JCPDS NO.36-0379). 图2b为最优条件下制备的硫化铜样品(10号样品)的XRD图,从图中可以看出其衍射峰位置与图2a一致,同时,其衍射峰强度大且尖锐,说明样品有很好的结晶度且纯度较高,仍然为六方靛铜矿结构.
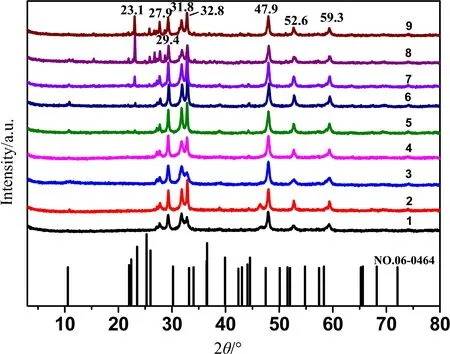
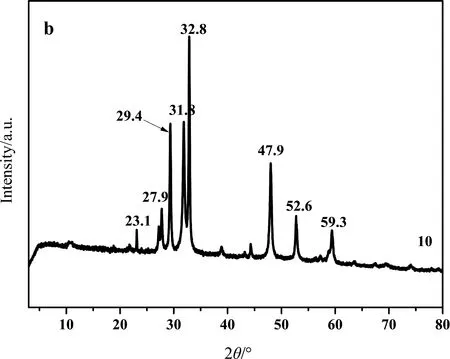
图2 硫化铜的XRD谱图(a:表1实验样品;b:最优条件制备的样品)Fig.2 XRD spectra of CuS (a: samples of Tab.1, b: sample of optimal conditions)
3.2 硫化铜形貌分析
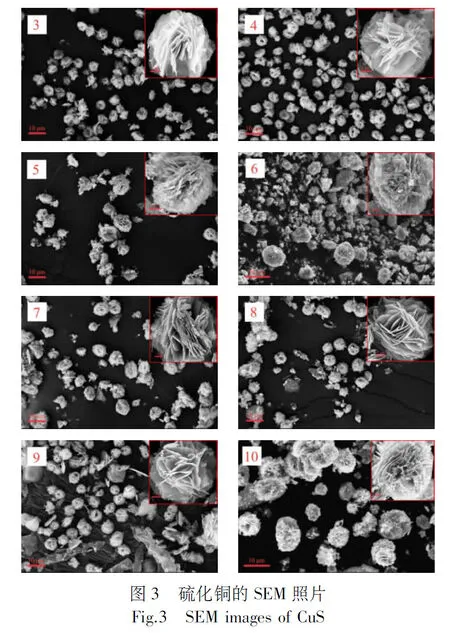
图3为1~10号样品的SEM照片,其中10号为最优条件下制备的硫化铜. 从图可知,采用溶剂热法制备的硫化铜均为花状,平均直径为5~8 μm. 当铜硫摩尔比1∶1时(1~3号样品),当PVP用量、反应时间及反应温度增加时,样品分散性越来越好,且花状结构也越来越均匀.

3.3 硫化铜近红外吸收分析
图4为硫化铜近红外吸收图谱,从图4a中可以看出1~9号样品,均在650 nm时出现吸收;我们通过对650 nm处其吸收强度的计算,得出各因素对吸收强度的影响,进一步确定其最优条件. 其计算结果如表1所示. 由表1中的极差R可以看出,Cu∶S摩尔比(A)、反应温度(B)、反应时间(C)以及PVP用量(D)对硫化铜近红外吸收性能的影响大小关系为:D>A>B>C. 因此,最优的反应条件为A2B3C2D1,即Cu∶S摩尔比为1∶2,反应温度为200 ℃、反应时间为6 h、PVP用量为0.25 g. 同时,从图4a可知,5号样品(A2B2C3D1)的吸收能力(650 nm,1.05 a.u.)均高于其他样品,但是,跟最优条件(图4b)制备的硫化铜(650 nm,1.8 a.u.)相比,近红外吸收强度要弱.
3.4 聚苯胺/硫化铜的FT-IR与XRD
图5为聚苯胺/硫化铜复合材料FT-IR图谱. 由图可知,3 444 cm-1为-N-H-伸缩振动特征吸收峰;1 568 cm-1为醌式结构-N=(C6H4)=N-中的C=N和C=C伸缩振动特征吸收峰;1 486 cm-1为苯环C=C伸缩振动特征吸收峰;1 298 cm-1为-N=(C6H4)=N-中的仲胺(C-N)伸缩振动特征峰;1 115 cm-1为醌环中的特征吸收峰;796 cm-1为C-H面外的弯曲振动的特征吸收峰以及-C6H4-中的C-H的特征吸收峰,与聚苯胺的红外光谱一致[10-12].

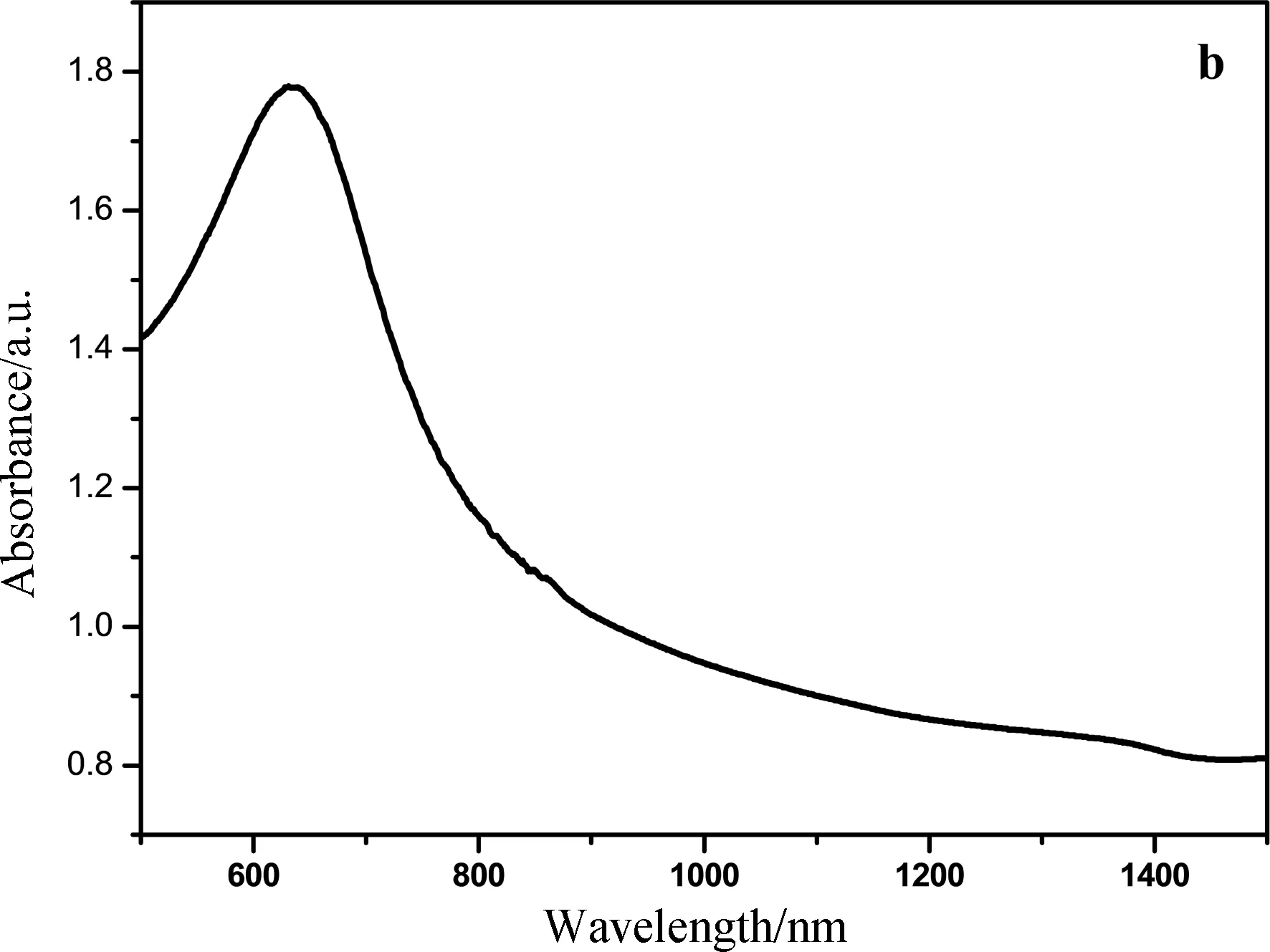
图4 硫化铜近红外吸收图谱(a:表1实验样品; b:最优条件制备的样品)Fig.4 NIR absorption spectra of CuS (a: the samples of Tab. 1, b: sample of optimal conditions)
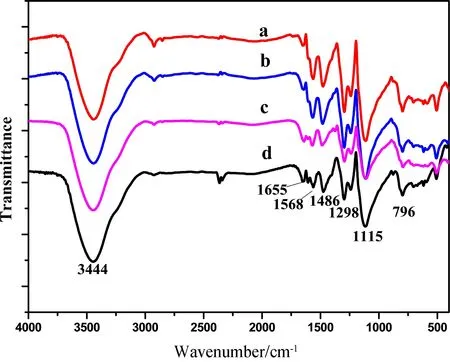
图5 聚苯胺/硫化铜的FT-IR图谱(a: CuS 20 wt%,b: CuS 30 wt%,c: CuS 40 wt%,d: CuS 50 wt%)Fig.5 FT-IR spectra of PANI/CuS composites (a: CuS 20 wt%, b: CuS 30 wt%, c: CuS 40 wt%, d: CuS 50 wt%)
图6为聚苯胺/硫化铜的XRD图谱,图中27.5°、29.4°、31.8°、32.8°、47.8°、52.5°和59.3°处均有较明显的吸收峰,表明样品有较好的结晶度,且与图2中硫化铜的峰位置一致. 8.7°、14.9°、20.9°和25.1°处有弱吸收峰,与聚苯胺的出峰位置一致[13-14],由此表明,通过原位聚合生成了聚苯胺,同时与硫化铜的复合并没有改变硫化铜的组成结构.
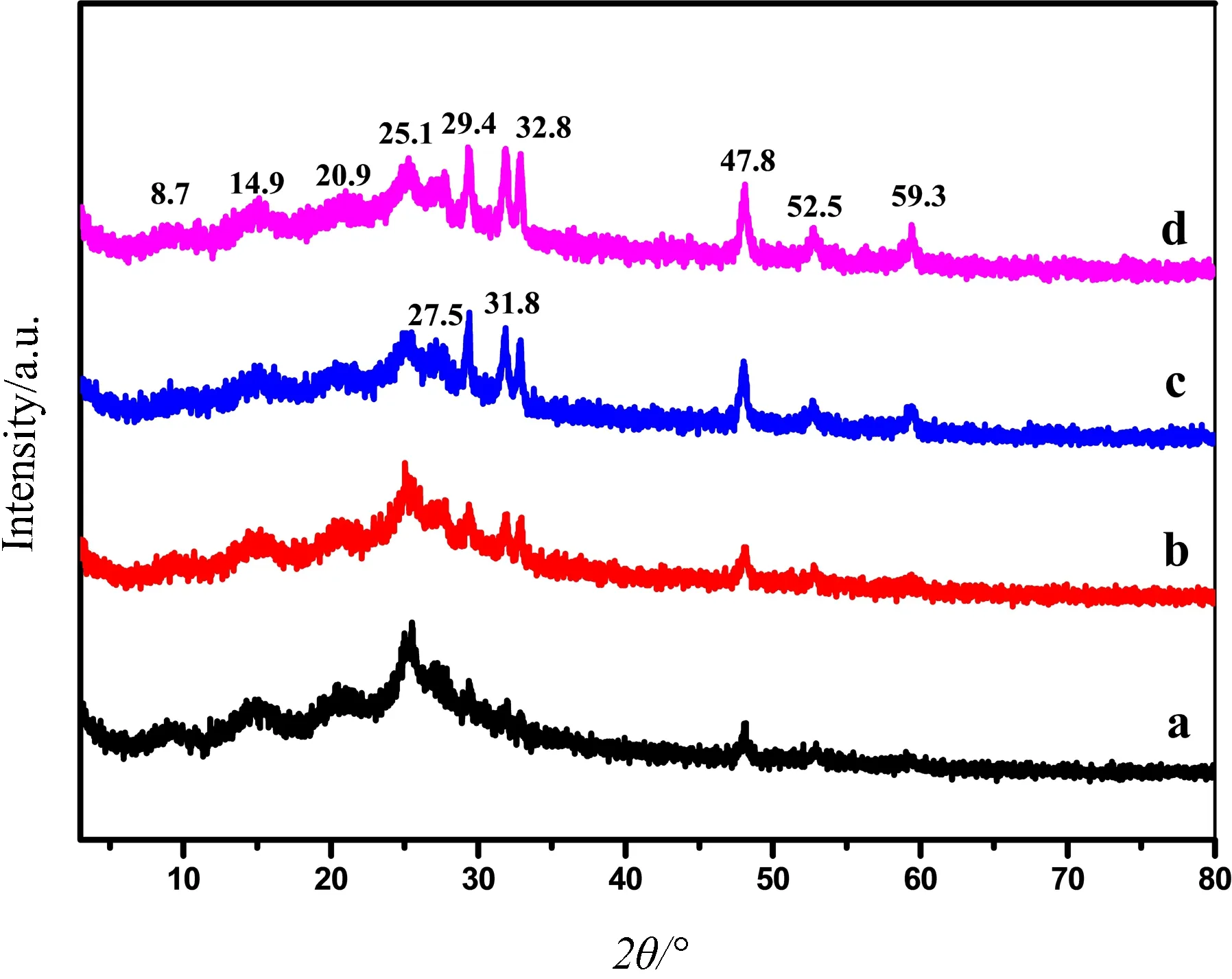
图6 聚苯胺/硫化铜的XRD图谱(a: CuS 20 wt%, b: CuS 30 wt%,c: CuS 40 wt%,d: CuS 50 wt%)Fig.6 XRD spectra of PANI/CuS composites (a: CuS 20 wt%, b: CuS 30 wt%, c: CuS 40 wt%, d: CuS 50 wt%)
3.5 聚苯胺/硫化铜复合材料形貌分析
图7为聚苯胺/硫化铜复合材料SEM照片.

由图7可知,不同硫化铜含量的样品呈现出不规则的纤维状结构,其纤维大小约为200~400 nm. 当硫化铜含量(20 wt%)较低时,复合材料主要表现为团聚的颗粒状(100~200 nm);当硫化铜继续增加到30 wt%时,其颗粒尺寸由100~200 nm减小到50~100 nm,并表现出部分的纤维结构;继续增加硫化铜为40~50 wt%时,其结构主要为纤维絮状物(200~600 nm)组成. 结果表明,硫化铜用量的增加将导致用于聚苯胺包覆的比表面积增加,同时,由于硫化铜直径尺寸较小(5~8 μm),所以聚苯胺包覆后会形成纤维絮状物,且硫化铜用量越多,纤维絮状物就越多.
3.6 聚苯胺/硫化铜复合材料近红外吸收
图8为聚苯胺/硫化铜复合材料的近红外吸收图谱. 随着硫化铜用量的增加,其在近红外的吸收是先增加后降低,在650 nm处为1.49 a.u.(a、CuS 20 wt%)升高到2.12 a.u.(b、CuS 30 wt%)然后降低为1.27 a.u.(d、CuS 50 wt%). 可能是因为聚苯胺与硫化铜之间存在共轭作用,电子可以通过共轭自由移动,导致其吸收增强. 当硫化铜的用量为30 wt%时,其近红外的吸收相对最强,在650 nm处达到2.12 a.u.. 当硫化铜的用量为40~50 wt%时,其吸收降低的原因可能是聚苯胺包覆在硫化铜表面,硫化铜阻碍了聚苯胺的合成,使得聚苯胺的链变短,破坏了原有共轭作用.

图8 聚苯胺/硫化铜复合材料近红外吸收图谱(a: CuS 20wt%,b: CuS 30wt%,c: CuS 40wt%,d: CuS 50wt%,e: 纯CuS)Fig.8 NIR of PANI/CuS composites (a: CuS 20 wt%, b: CuS 30 wt%, c: CuS 40 wt%, d: CuS 50 wt%, e: Net CuS)
4 结 论
本文采用溶剂热法制备了具有花状结构的硫化铜,并利用正交实验法对其制备参数进行了考察,得到最优合成条件为:在1.0 mL CuSO4·5H2O(1.0 mol/L)溶液和0.064 g(2.0 mmol)硫粉(Cu∶S(摩尔比)为1∶2),反应温度为200 ℃、反应时间为6 h、PVP用量为0.25 g. 在最优条件下,成功制备了直径尺寸为5~8 μm的花状硫化铜. 通过近红外吸收性能测试可知,在最优条件下,其650 nm处的近红外性能强度可达1.78 a.u.. 在此基础上,成功采用原位聚合复合法制备了聚苯胺/硫化铜复合材料,且当硫化铜用量为30 wt%时,其近红外吸收性能最佳,在650 nm处可达2.12 a.u.,有望成为良好的光热转换材料.
