南瓜均一多糖的分离纯化及其抗氧化活性的研究
2020-01-04吴艳丽邵珠领张宇王宇亮赵芷萌
吴艳丽,邵珠领,张宇,*,王宇亮,赵芷萌
(1.佳木斯大学药学院,黑龙江佳木斯154007;2.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江哈尔滨150070)
南瓜(Cucurbita moschata Duch),又被称为番瓜、倭瓜、金瓜等,属于葫芦科南瓜属的一年生蔓性草本植物,明代时期传入中国,现在我国各地广泛种植。南瓜亦可代粮食,又可供药用,是传统的药食两用植物,现代研究表明南瓜不仅富含氨基酸、维生素、蛋白质及淀粉等功能性成分,而且含有多种人体所需的锌、铁、硒等微量元素[1-3],其中南瓜多糖是南瓜中重要的活性成分之一,具有较高的医药保健作用。
南瓜多糖作为一种天然提取产物,不仅具有降血糖、抗肿瘤、抗病毒以及免疫调节等多种生物活性,而且无毒副作用,有着广泛的开发前景[4-5]。王艳玲等[6]以水为提取溶液,采用正交设计试验的方法,确定了微波辅助提取南瓜多糖的最佳工艺。王传栋等[7]通过动物和细胞实验研究发现,南瓜多糖不仅具有抑制肿瘤生长的作用,还可提高红细胞的免疫吸附功能。目前对南瓜多糖的研究主要集中在优化南瓜多糖的提取工艺、探究多糖对高血糖高血脂的辅助治疗及其作用机制、延缓和控制肿瘤生长、增强细胞免疫功能等方面[8-11],尽管已有对南瓜多糖抗氧化活性的报道[12],但并未就其构效关系进行更深入的研究,特别是对南瓜均一多糖的抗氧化活性与其结构之间的关系研究较少。
因此,本试验以新鲜南瓜为原材料,通过提取、分离纯化得到5 种均一多糖,通过测定其分子量、单糖组成,研究其与抗氧化活性之间的关系,为南瓜多糖抗氧化活性构效关系的研究提供科学依据,并对新型天然抗氧化剂的开发利用提供新的研究方向。
1 材料与方法
1.1 材料与试剂
新鲜成熟南瓜:黑龙江省佳木斯市农贸市场,经佳木斯大学药物化学教研室张宇教授鉴定为葫芦科南瓜;AB-8 大孔吸附树脂:东鸿化工有限公司;DEAE Cellulose-52 纤维素:英国 Whatman 公司;Sephadex G-100 葡聚糖凝胶:美国GE Healthcare 公司;单糖标准品:中国食品药品检定研究院;右旋糖苷葡聚糖标准品、DPPH:美国 Sigma 公司;抗坏血酸(VC):南京建成生物工程研究所;三蒸水:佳木斯大学药学院实验室自制。其他试剂均为国产分析纯。
1.2 仪器与设备
FA2004 型分析天平:上海恒平仪器有限公司;UV757 型紫外分光光度计:上海精密科学仪器有限公司;HH-2 电热恒温水浴锅:余姚市远东数控仪器厂;LC-5510 高效液相色谱仪配备紫外检测器:北京东西分析仪器有限公司;UM4800 蒸发光散射检测器:上海通微分析技术有限公司。
1.3 试验方法
1.3.1 南瓜预处理
将新鲜成熟南瓜洗净,去皮、去瓤、去籽,切成薄片后置于70 ℃烘箱中,12 h 后取出粉碎,过60 目筛,采用索氏提取法将粉碎后的南瓜粉用适量的95%乙醇80 ℃加热回流提取4 h,提取液过滤,滤渣于60 ℃烘箱中过夜干燥,得到预处理后的南瓜粉,装于自封袋内,放于干燥器中备用。
1.3.2 南瓜多糖的提取
称取一定量预处理后的南瓜粉,加入10 倍体积的蒸馏水,混合均匀后,在70 ℃、200 W 的超声波下提取30 min,提取液过滤离心弃去沉淀,上清液减压浓缩,加入95 %乙醇,使乙醇体积分数达到80 %,搅拌均匀后于4 ℃冰箱中静置过夜,离心(25℃,4 000 r/min,10 min)收集沉淀,沉淀加适量蒸馏水复溶后,再次减压浓缩,真空冷冻干燥24 h,即得南瓜粗多糖。按以下公式计算南瓜粗多糖得率。

式中:m 为南瓜粗多糖质量,g;M 为预处理后南瓜粉质量,g。
取50 g 南瓜粗多糖配成10%的多糖溶液,采用Sevag 法脱蛋白[13],重复操作6 次,合并多糖溶液减压浓缩至一定体积流水透析48 h,透析袋内液体减压浓缩后真空冷冻干燥24 h,既得除蛋白后的南瓜多糖。称5 g 脱蛋白后的多糖溶于100 mL 三蒸水中,25 ℃条件下4 000 r/min 离心10 min 后取上清液在已准备好的AB-8 大孔树脂柱上进行上样,吸附24 h 后用三蒸水进行洗脱,采用α-萘酚-硫酸法进行终点检测,合并洗脱液,减压浓缩、透析、冷冻干燥,即得脱色除杂后的南瓜多糖(Cucurbita moschata Duch polysaccharide,CMP)[14]。
1.3.3 南瓜多糖的分离纯化
取 2 g CMP 溶于 100 mL 三蒸水中,离心(25 ℃,4 000 r/min,10 min)后取上清液在已备好的DEAE Cellulose-52 色谱柱上进行分离,吸附12 h 后分别用0.1、0.2、0.3、0.4、0.5 mol/L 的 NaCl 溶液进行洗脱,用自动接样器收集洗脱液,流速为1 mL/min,5 mL/管,采用苯酚-硫酸法测定紫外吸光度值(490 nm),绘制洗脱曲线。根据洗脱曲线分段合并,减压浓缩后蒸馏水透析48 h,透析袋内液体浓缩、冷冻干燥[15]。
分别称取经DEAE Cellulose-52 色谱柱分离得到的各组分0.3 g,溶于50 mL 蒸馏水中,离心后取上清液沿壁上样于已备好的Sephadex G-100 色谱柱,吸附12 h 后用三蒸水洗脱,流速为0.5 mL/min,5 mL/管,采用苯酚-硫酸法隔管测490 nm 处的紫外吸光度值,绘制洗脱曲线,合并单一组分,减压浓缩后蒸馏水透析48 h,冷冻干燥[16]。
1.3.4 南瓜多糖纯度检验及分子量测定
色谱条件:仪器:LC5510 高效液相色谱仪;检测器:UM4800 蒸发光检测器;色谱柱:Waters UltrahydrogelTM水溶性凝胶柱(7.8×300 mm);流动相:三蒸水;流速:0.8 mL/min;漂移管温度:40 ℃;柱温:30 ℃;进样量:10 μL。
分别精密称取10 mg 不同分子量(5 000、12 000、25 000、50 000、80 000、150 000 Da 和 270 000 Da)的右旋糖酐葡聚糖标准品,加三蒸水定容于5 mL 容量瓶中,配置成浓度为2 mg/mL 的标准品溶液,过0.45 μm的水相微孔滤膜,取10 μL 按上述色谱条件进行高效液相色谱(high performance liquid chromatography,HPLC)分析,以色谱峰的保留时间(T)为横坐标,以标准品的分子量对数值(logMw)为纵坐标,得线性回归方程。分别称取10 mg 经Sephadex G-100 凝胶柱色谱纯化得到的 CMP-A1、CMP-A2、CMP-B、CMP-C1 及CMP-D2 5 个组分,配制成2 mg/mL 的多糖样品溶液,按上述方法操作,检验其纯度,并记录得到单一对称峰的保留时间,将其代入回归方程,即得南瓜多糖的相对分子质量Mw。
1.3.5 南瓜均一多糖的单糖组成分析
色谱条件为LC5510 高效液相色谱仪,色谱柱:ODS C18色谱柱(150 mm×4.6 mm,5 μm);流速:0.7 mL/min;流动相:0.1 mol/L 磷酸盐缓冲溶液-乙腈 83 ∶17(体积比);柱温:30 ℃;检测器:紫外检测器;检测波长:254 nm。
取单糖对照品(甘露糖Man、鼠李糖Rha、葡萄糖醛酸GlcA、半乳糖醛酸GalA、葡萄糖Glc、半乳糖Gal、木糖Xyl、阿拉伯糖Ara、岩藻糖Fuc)用三蒸水配制成浓度为40 mmol/L 的标准品单糖混合溶液。采用1-苯基-3-甲基-5-吡唑啉酮(5-methyl-2-phenyl-1,2-dihydropyrazol-3-one ,PMP)柱前衍生法[17],取标准单糖混合液1 mL 与0.5 mL 0.3 mol/L 的NaOH 溶液和0.5 mL 0.5 mol/L 的PMP 甲醇溶液涡旋混匀;于70 ℃水浴中反应 1 h,取出冷却至25 ℃,加0.5 mL 0.3 mol/L 的 HCL溶液终止反应,加2 mL 三氯甲烷萃取3 次,弃氯仿层。水相过0.45 μm 微孔滤膜后,取10 μL 按上述色谱条件进行HPLC 分析,并将水相稀释成7 种不同摩尔浓度(35、30、25、20、15、10、5 mmol/L) 的标准品混合溶液,进行HPLC 分析,以峰面积为纵坐标,摩尔浓度为横坐标进行线性分析,得回归方程。
分别取10 mg 南瓜均一多糖于安瓿瓶中,加4 mol/L 的三氟乙酸(trifluoroacetic acid,TFA)4 mL,溶解后密封,121 ℃水解2 h,冷却至25 ℃后加入甲醇溶液反复洗涤旋干以除去多余的TFA,加入1.5 mL 三蒸水使其溶解,离心取上清液,然后按上述PMP 法柱前衍生后进行HPLC 分析。
1.3.6 体外抗氧化活性研究
1.3.6.1 南瓜均一多糖对DPPH 自由基的清除作用
取2 mL 不同浓度的南瓜均一多糖溶液于具塞试管中,加入0.2 mmol/L 的DPPH-乙醇溶液2 mL,以蒸馏水作空白试验,并以相同浓度的VC溶液作为阳性对照,25 ℃避光反应30 min,于517 nm 波长处测定吸光度值,平行3 次试验取平均值[18]。南瓜均一多糖对DPPH自由基的清除率按式(1)计算。

式中:A1为多糖溶液+DPPH 溶液的吸光度值;A2为多糖溶液+无水乙醇的吸光度值;A0为蒸馏水+DPPH 溶液的吸光度值。
1.3.6.2 南瓜均一多糖对羟基自由基的清除作用
参照黄琼等[19]的水杨酸比色法并改进,取1 mL 不同浓度的南瓜均一多糖溶液于10 mL 试管中,加入0.5 mL 9 mmol/L 的 FeSO4溶液和 0.5 mL 9 mmol/L 水杨酸-乙醇溶液,最后加入0.5 mL 8.8 mmol/L 的H2O2试剂启动反应,振荡混匀后置于37 ℃的水浴中反应30 min,冷却至25 ℃,空白组以同等体积的蒸馏水代替样品液测定吸光值,以VC为阳性对照,在510 nm 处测定吸光值,每个样品重复3次试验取平均值。羟基自由基的清除率按式(2)计算。

式中:A1为多糖+水杨酸-乙醇+FeSO4+H2O2的吸光度值;A2为多糖+水杨酸-乙醇+蒸馏水+H2O2的吸光度值;A0为蒸馏水+水杨酸-乙醇+FeSO4+H2O2的吸光度值。
1.3.7 数据分析
所得试验数据采用SPSS 21.0 进行统计学分析,多组间比较采用方差分析,p<0.05 表示差异显著,具有统计学意义;p<0.01 表示差异极显著,具有统计学意义。
2 结果与分析
2.1 南瓜多糖的提取分离及纯化结果
2.1.1 南瓜多糖的提取结果
以新鲜南瓜为原材料,采用超声波辅助提取法一共提取3 kg 预处理后的南瓜粉,共得到347.62 g 南瓜粗多糖,得率为11.59%。
2.1.2 DEAE Cellulose-52 纤维素柱色谱分离结果
南瓜多糖(CMP)经DEAE Cellulose-52 纤维素柱色谱进行分离,采用不同浓度的NaCl 溶液进行洗脱,得到以洗脱管数-吸光度值绘制的洗脱曲线,见图1。

图1 DEAE Cellulose-52 色谱柱洗脱曲线Fig.1 Elution curve of pumpkin polysaccharide polysaccharides by DEAE Cellulose-52
根据洗脱曲线进行分段合并,每段减压浓缩,透析,冷冻干燥,得到6 个组分,分别命名为Fr.a1、Fr.a2、Fr.b、Fr.c、Fr.d、Fr.e。
2.1.3 SephadexG-100 凝胶柱色谱纯化结果
选择主要组分 Fr.a1、Fr.a2、Fr.b、Fr.c、Fr.d 过Sephadex G-100 凝胶柱色谱进一步分离纯化,得到7个组分,洗脱曲线如图2 所示。


图2 SephadexG-100 凝胶柱色谱洗脱曲线Fig.2 Elution curve of pumpkin polysaccharide polysaccharides by SephadexG-100
分段合并单一的对称峰,各部分浓缩、透析、冷冻干燥,分别命名为 CMP-A1、CMP-A2、CMP-B、CMPC1、CMP-C2、CMP-D1、CMP-D2,本文选择含量较大的5 个组分 CMP-A1、CMP-A2、CMP-B、CMP-C1、CMPD2 为进一步研究对象。
2.2 多糖纯度检验及分子量测定结果
南瓜均一多糖高效液相色谱图见图3。
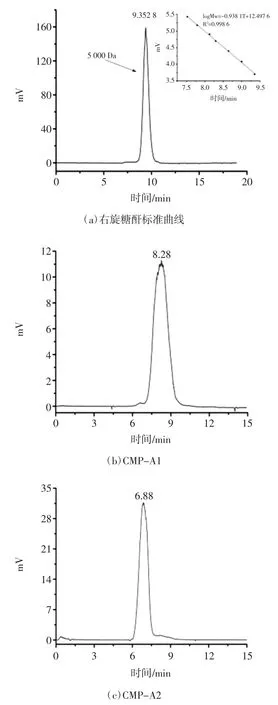

图3 南瓜均一多糖高效液相色谱图Fig.3 HPGPC chromatograms of pumpkin homogeneous polysaccharide
采用HPLC 法测得经AB-8 大孔吸附树脂柱、DEAE Cellulose-52 纤维素柱和Sephadex G-100 凝胶柱色谱分离纯化得到的CMP-A1、CMP-A2、CMP-B、CMP-C1、CMP-D2 5 种南瓜多糖均呈现单一的对称峰,且无杂质峰,可证明其为均一多糖(见图3b~图3f)。由HPLC 法测得右旋糖苷葡聚糖标准曲线为logMw=-0.938 1T+12.497 6,R2=0.998 6(见图 3a)。将各样品保留时间代入回归方程得其分子量大小,见表1。
由表1 可知南瓜均一多糖的分子量范围较大,在几千到几百万之间,其大小依次为CMP-A2>CMP-B>CMP-C1>CMP-A1>CMP-D2。
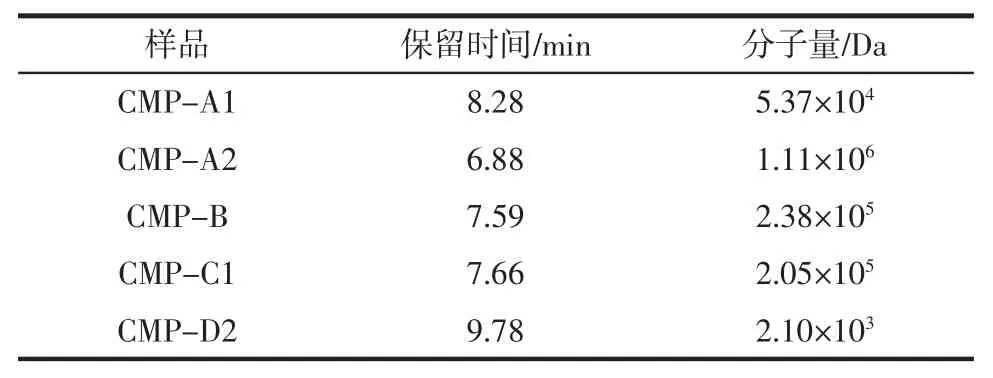
表1 南瓜均一多糖的保留时间和分子量Table 1 Retention time and molecular weight of pumpkin homogeneous polysaccharide
2.3 多糖的单糖组成测定结果
南瓜均一多糖样品单糖组成的HPLC 图见图4。

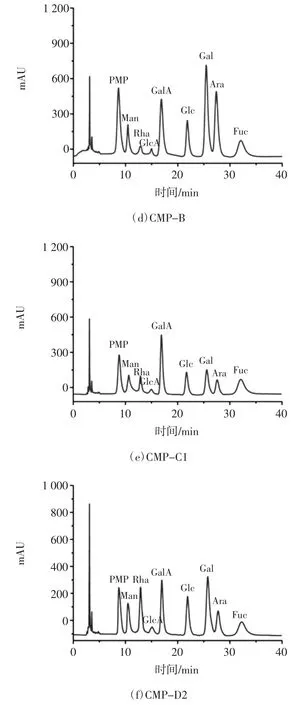
图4 南瓜均一多糖样品单糖组成的HPLC 图Fig.4 The HPLC chromatograms of component monosaccharides of pumpkin homogeneous polysaccharide
混合标准单糖经PMP 柱前衍生后进行HPLC 分析,可得到9 种单糖的保留时间和峰面积(见图4a),并对其进行定量分析。CMP-A1、CMP-A2、CMP-B、CMP-C1 及CMP-D2 5 种南瓜均一多糖经TFA 水解并衍生后,进行 HPLC 测定(见图 4b~4f),将 5 种南瓜均一多糖的HPLC 色谱图与混合单糖标准品的HPLC 色谱图进行对照,可知,CMP-A1 由 Rha、Glc、Gal、Ara 组成,其摩尔比为 5.36 ∶47.51 ∶1.05 ∶1.00,不含糖醛酸;CMP-A2 由 GlcA、Glc、Gal、Ara 组成,其摩尔比为1.00 ∶2.93 ∶2.51 ∶1.96,糖醛酸所占摩尔比例为 11.90%;CMP-B 由 Man、Rha、GlcA、GalA、Glc、Gal、Ara、Fuc 组成,其摩尔比为 4.78 ∶1.67 ∶1.00 ∶9.81 ∶6.78 ∶17.96 ∶13.63 ∶8.22,糖醛酸所占摩尔比例为 16.93%;CMP-C1由 Man、Rha、GlcA、GalA、Glc、Gal、Ara、Fuc 组成,其摩尔比为 2.79 ∶2.31 ∶1.00 ∶8.52 ∶4.18 ∶4.64 ∶3.79 ∶7.16,糖醛酸所占摩尔比例为27.67 %;CMP-D2 由Man、Rha、GlcA、GalA、Glc、Gal、Ara、Fuc 组成,其摩尔比为4.89 ∶5.97 ∶1.00 ∶6.23 ∶5.68 ∶9.76 ∶4.85 ∶5.42,糖醛酸所占摩尔比例为16.51%。比较5 种南瓜均一多糖的糖醛酸含量,其大小依次为CMP-C1>CMP-B>CMPD2>CMP-A2>CMP-A1。
2.4 南瓜均一多糖体外抗氧化活性测定结果
2.4.1 多糖对DPPH 自由基清除作用的测定结果
南瓜均一多糖对DPPH 自由基的清除作用见图5。

图5 南瓜均一多糖对DPPH 自由基的清除作用Fig.5 DPPH radical scavenging activities of pumpkin homogeneous polysaccharide
通过测定517 nm 波长处的吸光度并计算,由图5可知,5 种南瓜均一多糖对DPPH 自由基均有一定的清除作用,且随着质量浓度的增大其清除率逐渐增强,当多糖浓度为 4 mg/mL 时,CMP-A1、CMP-A2、CMP-B、CMP-C1、CMP-D2 及 VC对 DPPH 自由基的清除率分别为(41.45±1.57)%、(50.89±1.21)%、(58.73±1.02)%、(68.94±1.59)%、(59.78±2.03)%、(80.21±1.97)%。通过方差分析,可知CMP-B 和CMP-D2 对DPPH 自由基的清除作用具有差异性,但差异不明显,无统计学意义(p>0.05),其他各组两两相比,对DPPH自由基的清除作用均有极显著性差异(p<0.01)。通过曲线拟合函数,计算得到 CMP-A2、CMP-B、CMP-C1、CMP-D2 及 VC对 DPPH 自由基的半抑制浓度(IC50)分别为(3.74±0.05)、(2.61±0.12)、(1.78±0.03)、(2.45±0.08)、(0.93±0.02)mg/mL,CMP-A1 对 DPPH 自由基的清除率较低,在试验浓度范围内未达到IC50,通过比较IC50的大小可知,5 种南瓜均一多糖及VC对DPPH 自由基清除能力的强弱依次为:VC>CMP-C1>CMP-D2>CMP-B>CMP-A2>CMP-A1。CMP-C1 与 CMP-B 相比,两者的分子量比较接近,CMP-C1 的糖醛酸含量远远大于CMP-B 的糖醛酸含量,CMP-C1 对DPPH 自由基的清除率比CMP-B 高出10.21%;CMP-D2 与CMP-B相比,两者糖醛酸含量相近,CMP-D2 的分子量显著小于CMP-B 的分子量,但CMP-D2 对DPPH 自由基的清除率仅比CMP-B 高出1.05%。以上结果表明,南瓜多糖的糖醛酸含量对DPPH 自由基的清除作用影响较大,糖醛酸含量越高,其抗氧化活性越大;而分子量大小对其影响较小。
2.4.2 多糖对羟基自由基清除作用的测定
南瓜均一多糖对羟基自由基的清除作用见图6。

图6 南瓜均一多糖对羟基自由基的清除作用Fig.6 ·OH radical scavenging activities of pumpkin homogeneous polysaccharide
由图6 可知,5 种南瓜均一多糖对羟基自由基均具有较强的清除能力,且呈剂量依存关系,多糖质量浓度越大,对羟基自由基的清除率越强。当多糖浓度为 4 mg/mL 时,CMP-A1、CMP-A2、CMP-B、CMP-C1、CMP-D2 及VC对羟基自由基的清除率分别为(56.78±2.16)%,(63.52±1.97)%,(71.32±1.71)%,(82.35±1.68)%,(73.28±1.03)%,(95.04±2.25)%。方差分析结果表明,CMP-B 和CMP-D2 对羟基自由基的清除作用具有显著性差异(p<0.05),其他各组两两相比,对羟基自由基的清除作用均具有极显著性差异(p<0.01)。拟合曲线方程,计算得 CMP-A1、CMP-A2、CMP-B、CMPC1、CMP-D2 及 VC对羟基自由基的 IC50分别为(3.32±0.14)mg/mL、(2.73±0.12)mg/mL、(2.01±0.08)mg/mL、(0.87 ±0.05) mg/mL、(1.68 ±0.09) mg/mL、(0.13 ±0.02)mg/mL,由 IC50可知,5 种南瓜均一多糖及 VC对羟基自由基的清除能力,由强到弱依次为:VC>CMPC1>CMP-D2>CMP-B>CMP-A2>CMP-A1。CMP-C1 与CMP-B 相比,两者的分子量大小相近,CMP-C1 的糖醛酸含量明显高于CMP-B,CMP-C1 对羟基自由基的清除率比CMP-B 高出 11.03 %;CMP-D2 与 CMP-B相比,两者的糖醛酸含量基本相等,CMP-D2 的分子量明显小于CMP-B,但CMP-D2 对羟基自由基的清除率仅比CMP-B 高出1.96%。以上结果表明,多糖的糖醛酸含量对羟基自由基的清除作用影响较大,而分子量大小对其影响较小。
3 结论
采用超声辅助法提取南瓜多糖,其粗多糖得率为11.59%,脱蛋白脱色后,经纤维素DEAE Cellulose-52及凝胶Sephadex G-100 柱色谱分离纯化得到CMPA1、CMP-A2、CMP-B、CMP-C1、CMP-D2 5 种多糖组分,采用高效液相色谱法鉴定为南瓜均一多糖,其分子量分别为(5.37×104)、(1.11×106)、(2.38×105)、(2.05×105)、(2.10×103)Da,糖醛酸所占摩尔比例分别为 0%、11.90%、16.93%、27.67%、16.51%。通过 DPPH 法和水杨酸比色法检测南瓜均一多糖的抗氧化活性,结果表明,5 种南瓜均一多糖在(0.5~4.0)mg/mL 浓度范围内对DPPH 及羟基自由基均有不同程度的清除作用,其清除率随质量浓度的增大而增大。
通过分析5 种南瓜均一多糖抗氧化活性与其分子量大小、糖醛酸含量之间的关系发现:多糖的糖醛酸含量对其抗氧化活性影响较大,糖醛酸含量越高,其抗氧化活性越强,其作用机制可能是由于多糖中的糖醛酸基团可以激活异头碳上的氢原子,提高氢原子的供给能力,从而引起更强的抗氧化活性[20]。而分子量大小对其抗氧化活性的影响较小,相比高分子量的多糖,低分子量的多糖抗氧化活性更强一些,可能是由于低分子量的多糖糖链较短,结构比较简单,更易暴露出游离的羟基基团,羟基基团有利于自由基的清除,从而提高多糖的抗氧化活性[21]。该结果可为南瓜多糖构效关系的研究提供相关参考依据,为天然抗氧化产品的原料筛选及其开发利用提供新方向。
