NaCl胁迫对大豆生理特征的影响
2019-12-30于磊刘宗林徐宗艺屈申杨少彤
于磊 刘宗林 徐宗艺 屈申 杨少彤


摘要 [目的]对大豆在不同浓度的NaCl盐胁迫下的生理指标进行测定与分析。[方法]以大豆幼苗为研究材料,设置NaCl浓度梯度,对大豆幼苗施加NaCl盐胁迫,测定其丙二醛含量、SOD活性、POD活性、游离脯氨酸含量、叶绿素含量、电导率等生理指标。[结果]在盐浓度递增的情况下,丙二醛含量呈递增趋势;SOD先增后减,在盐浓度125 mmol/L时达到峰值;POD先平缓后递增;游离脯氨酸含量整体呈递增趋势;叶绿素含量整体呈递增趋势,增长较缓慢,最终趋于稳定;电导率变化没有规律可循,在125 mmol/L时达到峰值。[结论]NaCl盐胁迫会影响大豆的生理指标,说明大豆植株的生理状况随生长环境的改变而改变,大豆植株对不断变化的环境具有一定的适应能力。
关键词 大豆;盐胁迫;丙二醛;POD;叶绿素
中图分类号 Q945 文献标识码 A
文章编号 0517-6611(2019)24-0039-03
doi:10.3969/j.issn.0517-6611.2019.24.013
Physiological Characteristics of Soybean under NaCl Stress
YU Lei1,2,LIU Zong-lin1,XU Zong-yi1 et al (1.School of Life Sciences,Northeast Forestry University,Harbin,Heilongjiang 150040;2.State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin,Heilongjiang 150040)
Abstract [Objective]The physiological indexes of soybean under different NaCl stress were measured and analyzed.[Method]With soybean seedlings as research materials,NaCl concentration gradient was designed.After applying NaCl salt stress to soybean seedlings,the physiological indexes such as malondialdehyde content,SOD,POD,free proline content,chlorophyll content and electrical conductivity were measured.[Result]Through the determination of physiological indexes of soybean seedlings,the content of malondialdehyde increased in the case of increasing salt concentration;the SOD value increased first and then decreased,and reached the peak value when the salt concentration was 125 mmol/L;the POD value increased first and then increased;the content of proline showed an increasing trend;the overall chlorophyll content showed an increasing trend,the growth was slow firstly and finally stabilized;the conductivity change did not follow the law,reaching a peak at 125 mmol/L.[Conclusion]NaCl salt stress can affect the physiological indexes of soybean,indicating that the physiological condition of soybean plants varies with the change of growth environment,and soybean plants have certain adaptability to environmental change.
Key words Glycine max(Linn.) Merr;Salt stress;Malondialdehyde;POD;Chlorophyll
基金項目 大学生创新训练课题(201810225127)。
作者简介
于磊(1992—),男,山东莱阳人,博士研究生,研究方向:林木遗传育种;刘宗林(1998—),男,山东烟台人,从事植物生理研究;刘宗林和于磊为共同第一作者。
收稿日期 2019-06-14;修回日期 2019-06-25
大豆通称黄豆,是双子叶植物纲、豆科、大豆属的一年生草本植物,其茎直立、粗壮,密被褐色长硬毛。大豆中国重要粮食作物之一,是1种种子含有丰富植物蛋白质的作物。大豆可以用来榨取豆油,制作各种豆制品以及酿造酱油。
盐胁迫对植物的种子萌发、生长发育以及基因表达都会造成不同程度的影响,会影响植物的生理状态。渗透调节能耗、碳同化量减少和维持生长能耗增加等原因,多数植物在盐胁迫下生长发育会受到显著抑制[1];叶绿素酶活性提高导致叶绿素的降解,因此许多植物在盐胁迫下光合色素含量降低[2],但是低浓度的盐胁迫可以促进植物体内光合色素含量的增加[5-6];在盐胁迫条件下,植物细胞内产生大量的活性氧自由基,打破了正常情况下自由基产生与清除的动态平衡,使膜脂双分子层过氧化,产生大量的丙二醛,并造成细胞膜结构破坏和电解质大量渗漏,使植物生理失调[3-4];盐分能增加细胞膜透性,使脂质过氧化作用变强,最终导致膜系统的破坏[7];当遭受盐胁迫时,植物常常通过抗氧化系统中的酶类和非酶类抗氧化物质之间的协同作用来抵御盐胁迫引起的氧化胁迫[9];盐胁迫下,细胞可以通过积累一些物质,如脯氨酸、多胺、可溶性糖等来调节细胞内的渗透势,维持水分平衡,还可以保护细胞内许多重要代谢活动所需的酶类活性[8];植物在逆境中为了抵抗伤害,常常通过盐胁迫应答基因的作用产生渗透调节物质脯氨酸,以保持原生质与环境的渗透平衡,增加蛋白质的可溶性,保持生物大分子结构的稳定性以维持细胞正常的渗透势[10]。
该研究对大豆幼苗进行不同浓度梯度的NaCl溶液胁迫进行处理,进而对不同处理大豆幼苗的丙二醛含量、SOD活性、POD活性、游离脯氨酸含量、叶绿素含量、电导率等生理指标进行测定和比较分析,研究不同浓度NaCl胁迫对大豆植株生长和一些生理指标的影响,旨在探究大豆的耐盐性,并初步阐明其适应盐胁迫的生理机制,为今后在盐碱地的推广种植和促进大豆的产业发展提供实验依据。
1 材料与方法
1.1 试验材料 以大豆种子自然萌发而得的长出三出复叶的大豆幼苗为试验材料,试验所用药品有不同浓度的NaCl盐溶液;10%三氧乙酸(TCA)、0.6%硫代巴比妥酸(TBA);3%碱基水杨酸、2.5%酸性茚三酮显色液、脯氨酸标准溶液;80% 丙酮;磷酸缓冲液;0.013 mol/L甲硫氨酸溶液、氮蓝四唑、核黄素。
1.2 试验方法
对大豆幼苗分别施加0、50、75、100、125、150 mmol/L的NaCl盐溶液进行胁迫处理,每组处理设置2个重复,盐胁迫处理7 d后,取每组处理的三出复叶,进行生理指标的测定。
1.2.1 丙二醛含量的测定。①取植物材料用液氮迅速研磨成粉,取0.5 g左右材料,置于5 mL離心管内;②加入5 mL 10%的三氯乙酸,提取30 min后,10 000 r/min离心15 min;③取上清液2 mL,加入2 mL 0.6%TBA,混匀,在100 ℃沸水浴中加热15 min,冷却后再测量;④分别测定600、532和450 nm处的吸光值,以2 mL TCA代替提取液为对照组。
1.2.2 游离脯氨酸含量的测定。
①提取:剪碎叶片0.2 g置于大试管中,加入5 mL 3%碱基水杨酸溶液,用保鲜膜封口,于沸水浴中浸提10 min;②取出试管,待冷却至室温后,吸取上清液2 mL,加2 mL冰乙酸、2 mL水和4 mL显色液,于沸水浴中加热40 min,取出冷却后向各管加入5 mL甲苯充分振荡,以萃取红色物质。静置待分层后吸取甲苯层样品,在520 nm的波长下,以甲苯为对照进行比色;③记录光密度值,从标准曲线中查出测定液中脯氨酸浓度,依据公式计算样品中脯氨酸含量。
1.2.3 叶绿素含量的测定。取新鲜叶片0.2 g,把叶片剪碎置研钵中,加入80% 丙酮研成匀浆,继续研磨,至组织变白无绿色,离心并过滤,用80% 丙酮定容至25 mL,将叶绿素丙酮提取液分别在波长645、663 nm下测定吸光度,以80% 丙酮为空白,共3次重复。
1.2.4 POD值的测定。
取2只比色杯,一只比色杯加入3 mL反应混合液和1 mL磷酸缓冲液混匀作为校零对照,另一只比色杯加入3 mL反应混合液和1 mL酶液,立即秒表计时。于分光光度计470 nm波长下测量,每隔1 min读数1次,以每分钟OD值的变化来表示酶活性大小。
1.2.5 SOD值的测定。
①取植物材料0.5 g,用磷酸缓冲液迅速研磨成粉,置于7 mL离心管内;
②加入5 mL磷酸缓冲液,提取30 min后,在4 ℃下1 000 r/min离心15 min;
③取上清液0.1 mL置于试管中,加反应液及0.3 mL核黄素,于30 ℃、4级光照培养箱内反应7~8 min;
④另取2支试管,加入0.1 mL缓冲液、3.8 mL反应液、0.3 mL核黄素,一支试管置于黑暗处作为调零,另一支作为对照组,与试验组一起进行照光处理。
1.2.6 相对电导率的测定。取每组处理的叶片,尽量保证每组样品的一致性,每组叶片都用打孔器打9个叶盘没入20 mL ddH2O中,10 min后用DDS-11A型电导率仪测定电导率,记为R1;将溶液置于沸水浴中加热30 min,待其冷却后测定其电导率,记为R2。
2 结果与分析
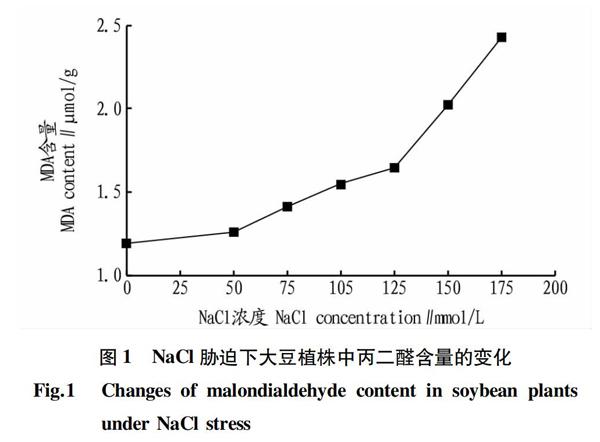
2.1 NaCl浓度对丙二醛含量的影响 随着NaCl浓度的增加,大豆植株叶片的丙二醛含量逐渐增加,且在125 mmol/L NaCl胁迫后丙二醛含量的增加变得更加显著(图1),而丙二醛会造成细胞膜结构的破坏,因此丙二醛含量越大,盐胁迫对大豆植株的危害越大。
2.2 NaCl浓度对游离脯氨酸含量的影响
随着NaCl浓度的增加,大豆植株叶片的游离脯氨酸含量整体呈递增趋势,且在100 mmol/L NaCl胁迫后游离脯氨酸含量的增加变得更加显著(图2),推测大豆植株通过大量合成脯氨酸,使细胞渗透势降低,进而增强植株抗盐性,以适应盐胁迫环境。
2.3 NaCl浓度对叶绿素含量的影响
随着NaCl浓度的增加,大豆植株叶片的叶绿素含量整体呈递增趋势,但增长趋势较缓慢(图3),推测大豆植株通过适当合成叶绿素来增强植株光合作用,提高合成植物生长必须物质的效率,帮助大豆适应盐胁迫环境。
2.4 NaCl浓度对POD活性的影响 随着NaCl浓度的增加,大豆植株叶片的POD酶活性呈先减后增的趋势,在75 mmol/L NaCl胁迫值时达到最低值,其后酶活增长十分明显(图4),推测大豆植株通过增强POD酶活性的方式清除过氧化物,帮助大豆适应高盐环境。
2.5 NaCl浓度对SOD活性的影响 随着NaCl浓度的增加,大豆植株叶片的SOD酶活性呈先增后减的趋势,在125 mmol/L NaCl胁迫值时达到峰值,其后酶活缓慢降低(图5),推测大豆植株通过增强SOD酶活性的方式清除过氧化物帮助大豆抵御低盐逆环境,但过高盐浓度环境会降低SOD酶活性,阻碍过氧化物的清除,降低大豆耐盐能力。
3 结论与讨论
植物对环境作出的反应既受基因的控制,又受个体所处的生存条件和生理生长状况的制约[11],由于碳同化量减少、渗透调节能耗和维持生长能耗增加等原因,多数植物在盐胁迫下生长发育会受到显著抑制[1]。该研究结果显示,大豆植株中各生理指标都有明显变化,推测大豆植株可通过改变生理状况来适应盐胁迫环境。
叶片光合色素含量直接反映了植物的光合能力[12]。该研究结果显示,大豆植株叶绿素含量缓慢增长,未呈下降趋势,推测大豆植株可能通过合成叶绿素增强光合作用,以此抵御盐胁迫环境。但整体未呈下降趋势,也可能是因为处理浓度不够,在后续的试验中可以增大NaCl浓度,验证大豆植株在高盐环境中的叶绿素含量变化。
植物在盐胁迫条件下,细胞内产生大量的活性氧自由基,打破了正常情况下维持的自由基产生与清除的动态平衡,使膜脂双分子层过氧化,产生大量的丙二醛,并造成细胞膜结构破坏,电解质大量渗漏,使植物生理失调[3-4];SOD和POD能够分别清除O2-和H2O2[13-15]。该研究结果显示,NaCl胁迫处理后大豆叶片MDA含量显著提高,并且随着盐浓度的升高,MDA含量增长幅度越大;同时,POD和SOD酶活性明显提高。推测盐胁迫导致细胞内自由基大量产生,造成了大豆的膜脂过氧化伤害,同时诱导体内酶的抗氧化物质发挥作用,以增强细胞的抗氧化能力而清除体内的自由基,降低膜脂过氧化的程度,这与徐宁等[16]的研究结果一致。
植物在遭受盐胁迫后,其细胞膜透性会增加,胞内电解质随之外渗,因此导致植物细胞浸提液电导率增大[17]。在后续的试驗中会分析与完善盐胁迫下大豆植株电导率数据,以便进一步丰富大豆抵御盐胁迫的生理指标数据。
有研究认为,盐胁迫下游离脯氨酸含量变化与植物抗盐性存在正相关关系[18-19],该研究大豆植株中游离脯氨酸含量随盐浓度的增加而增加。推测在盐胁迫处理下,游离脯氨酸成为主要的渗透调节物质来维持渗透平衡,以减缓盐分对大豆植株的侵害。
该研究通过对NaCl胁迫处理下的大豆植株进行生理指标的测定,归纳大豆植株在盐胁迫处理下的生理状况,推测大豆植株可以在低盐环境中进行栽植。为了进一步研究大豆的抗盐能力,可以采用复合盐进行盐胁迫试验。该研究为大豆在自然盐环境中的大量种植提供数据参考,为培育新型良种转基因大豆提供参考依据,并丰富了逆境生物学理论。
参考文献
[1]陈晓亚,汤章城.植物生理与分子生物学[M].3版.北京:高等教育出版社,2007:533-551.
[2]束胜,郭世荣,孙锦,等.盐胁迫下植物光合作用的研究进展[J].中国蔬菜,2012(18):53-61.
[3]PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:A review[J].Ecotoxicology and enviro nmental safety,2005,60(3):324-349.
[4]PARVAIZ A,SATYAWATI S.Salt stress and phyto-biochemical response of plans-A review[J].Plant soil environnment,2008,54(3):89-99.
[5]周琦,圣倩倩,祝遵凌.欧洲鹅耳枥幼苗对盐胁迫的生长及生理响应[J].水土保持通报,2015,35(3):88-94.
[6]GORHAM J,LUCHLI A,LEIDI O.Plant responses to salinity[M]//STEWART J M,OOSTERHUIS D M,HEITHOLT J J,et al.Physiology of cotton.Dordrecht:Springer Netherlands,2010:129-141.
[7]张洁明,孙景宽,刘宝玉,等.盐胁迫对荆条、白蜡、沙枣种子萌发的影响[J].植物研究,2006,26(5):595-599.
[8]史军辉,王新英,刘茂秀.NaCl胁迫对胡杨幼苗叶生理生化指标的影响[J].新疆农业科学,2012,49(11):2022-2028.
[9]DEINLEIN U,STEPHAN A B,HORIE T,et al.Plant salt-tolerance mechanisms[J].Trends Plant Sci,2014,19(6):371-379.
[10]MATYSIK J,ALIA B,BHALU B,et al.Molecular mechanisms of quenching of reactive oxygen species by proline under stress in plants[J].Current science,2002,82(5):525-532.
[11]邱收.几个萱草属植物的耐盐性研究[D].长沙:湖南农业大学,2008.
[12]NXELE X,KLEIN A,NDIMBA B K.Drought and salinity stress alters ROS accumulation,water retention,and osmolyte content in sorghum plants[J].South African journal of botany,2017,108:261-266.
[13]窦俊辉,喻树迅,范术丽,等.SOD与植物胁迫抗性[J].分子植物育种,2010,8(2):359-364.
[14]CAVALCANTI F R,LIMA J P M S,FERREIRA-SILVA S L,et al.Roots and leaves display contrasting oxidative response during salt stress and recovery in cowpea[J].Journal of plant physiology,2007,164:591-600.
[15]ABDEL-HALIEM M E F,HEGAZY H S,HASSAN N S,et al.Effect of silica ions and nano silica on rice plants under salinity stress[J].Ecological engineering,2017,99:282-289.
[16]徐宁,曹娜,王闯,等.NaCl胁迫对野生和栽培品种高粱种子萌发和幼苗生理特性的影响[J].江苏农业科学,2018,46(18):55-57,67.
[17]薛腾笑,任子蓓,任士福.NaCl胁迫对美国金钟连翘生理特性的影响[J].江苏农业科学,2018,46(11):104-108.
[18]PETRUSA L M,WINICOV I.Proline status in salt-tolerant and salt-sensitive alfalfa cell lines and plants in response to NaCl[J].Plant Physiol Biochem,1997,35(4):303-310.
[19]傅秀云,崔光泉,林昶.冬小麦耐盐力与脯氨酸含量的关系[J].山东农业科学,1988(2):5-7,26.
