细胞衰老的机制概述
2019-12-27冯春艳陈旭远周海城
冯春艳 陈旭远 林 闯 周海城
(1 东北师范大学教育学部 长春 130024; 2 吉林省实验中学 长春 130022)
衰老的细胞通常具备核膜内折、染色质收缩、脂褐质增多、膜结构改变、物质运输功能降低、细胞器结构和功能异常等特征,而这些相对于健康的细胞而言都是损伤,也就是说细胞衰老是损伤通过时间的累积而使之熵变再经过自然选择的结果。目前,对细胞衰老原因的讨论主要集中在氧化应激产生自由基、端粒缩短、DNA损伤反应(DDR)、胰岛素/IGF-1代谢异常、细胞自噬异常这几个方面。从各种衰老机制的发生序列和损伤累积的视角来看,自由基和端粒缩短对细胞的损伤是衰老的伊始,DDR和胰岛素/IGF-1代谢途径是稀释损伤的信号转导通路,细胞自噬则是清除损伤的过程。
1 细胞损伤: 衰老伊始
当外界压力因素,如辐射、紫外线、重金属作用于细胞时,细胞中的DNA、蛋白质、膜结构或细胞器可能会受到损伤。这些因应激反应产生的变化不断增加,成为“损伤累积”,进而导致有机体无序性的增加,即熵增。任何生物都存在着产生有缺陷产品的风险,细胞代谢过程中产生自由基等有毒的副产物,如氧在正常的代谢过程中产生包括过氧化物、超氧化物等活性氧(ROS),应激条件下ROS会增多,进而损害脂质、核酸、蛋白质和细胞器,触发相应修复反应[1]。
端粒是存在于真核生物染色体两端高度保守的非编码重复DNA序列。端粒DNA与Shelterin蛋白(包括TRF1、 TRF2、 Rap1、 TIN2、 TPP1、 POT1)一起存在于真核染色体的末端形成“帽”,从某种意义上来看,端粒是在用重复序列封闭每条染色体,保护染色体免受缩短造成的损害[2],同时也能够避免染色体之间错乱的融合。研究发现: 随着细胞复制次数的增加,端粒DNA就会缩短一截,使细胞复制达到海弗利克极限(Hayflick limitation),最终导致细胞衰老和死亡。端粒长度与潜在的寿命变化有关,端粒的缩短会使染色体对辐射的敏感度增加,从而增加了变异的可能性[3]。端粒酶可以阻止端粒丢失,但端粒酶在大多数体细胞组织中都处于失活状态。从生命进化的视角来看,端粒的缩短、细胞的衰老都是最终所选择下来的生存机制,细胞衰老虽然限制了细胞分裂的次数,但避免了细胞无限分裂成为癌细胞。
2 稀释损伤: 信号转导
当细胞受到损伤之时,细胞内便会启动DNA的受损修复机制、蛋白质等分子结构的修饰以稀释损伤。损伤稀释可以抵消有害变化的累积,特别是当细胞分裂非常迅速并且它们获得的损伤相对温和时[4]。当损伤变得难以稀释时,损伤就会更容易附着到某个细胞结构上,从而随着细胞分裂而不对称的分散它们[5]。通常来说,在转录水平通过高度保守的信号转导途径是协调许多基因激活以延长寿命的关键[6]。当前研究中对细胞内损伤稀释的机制主要包括DDR和胰岛素/IGF-1信号转导通路。
2.1 DDR信号转导通路 DDR是一个由众多蛋白质构成的网络信号转导路径,能够感应由不同刺激引发的细胞损伤,阻滞细胞周期的信号转导通路。当DNA损伤发生时就会启动DDR,引发激酶级联增强反应,通过效应器p53、细胞分裂周期蛋白25(cell division cycle 25, CDC25)、染色体结构维持蛋白1(structural maintenance of chromosomes proteins 1, SMC1)等使细胞周期停滞,DNA损伤修复通路活化,细胞衰老或死亡[7]。
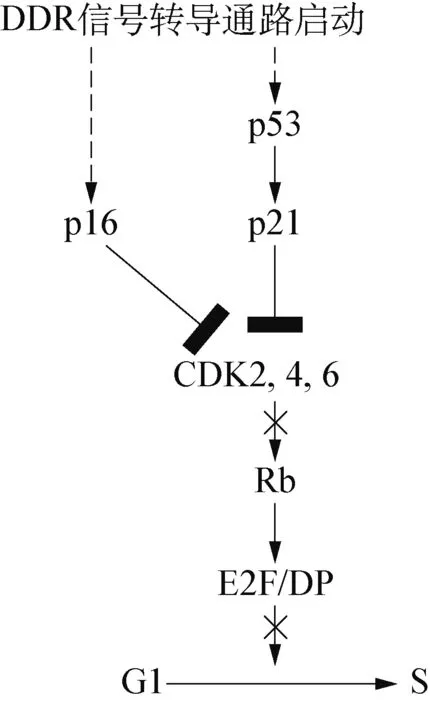
图1 DDR信号转导通路
细胞内的p21是由Cdknla编码的细胞周期调控产物,是转录因子p53基因的下游产物。当DDR发生时,诱导p53的表达,p53通过识别失去功能的端粒,继而诱导p21的表达,p21使得若干cyclin依赖性的激酶(CDK),如CDK2、 CDK4、 CDK6等失活,从而阻止Rb蛋白的磷酸化,Rb蛋白不能与E2F分离,E2F处于持续失活状态,不能起始G1/S转换过程中若干关键因子的转录,导致细胞周期停滞在G1/S期,最终引发细胞衰老(图1)[8]。除了p21抑制CDK磷酸化的路径外,在一些研究中表明p16也能抑制CDK4和CDK6的活性,并且DDR能够独立激活p16基因的表达[9]。当DNA受损或DNA复制造成端粒缩短时,就会被机体识别为DNA双链断裂(DNA double-strand breaks, DSBs)损伤,启动DDR,阻滞细胞周期在G1/S期,导致细胞衰老或死亡,还可能在表现型上发生改变,如个体衰老、疾病产生等。
2.2 胰岛素/IGF-1途径 近些年的研究发现,影响动物衰老的一个重要的代谢途径是胰岛素/IGF-1。IGF-1又被称为胰岛素样生长因子1,由肝脏产生,调节DNA的合成、刺激全身细胞生长[10]。胰岛素/IGF-1信号(IIS)是生长和代谢的核心,在秀丽隐杆线虫中,IIS的减少增加了抗逆性和寿命。有研究显示胰岛素/IGF-1途径感知营养素、饮食限制和降低IIS被认为是促进蛋白水解、延缓细胞损伤累积的重要途径。改变胰岛素/IGF-1代谢途径可导致细胞或生物体代谢状态的全局变化,在已有大量损伤的前提下,通过减慢代谢来改变总体损伤累积速率。研究表明通过胰岛素/IGF-1样受体途径发出信号是许多生物衰老的重要原因[11]。长寿命的IIS突变体在整个生命过程中显示出非常低的蛋白质合成和降解水平,这种突变体寿命的延长强烈依赖于自噬途径。
3 清除损伤: 细胞自噬
自噬是细胞维持内部稳态的一种方式,也是保证细胞长寿的重要机制之一,细胞内损伤的蛋白质、细胞器、脂质如果不能被自噬所清除,就无法为细胞代谢活动和新原料的存储提供场所。自噬分为巨自噬(macroautophagy, MA)、微自噬(microautophagy)、伴侣蛋白介导自噬(chaperone-mediated autophagy, CMA)三种,巨自噬指的是损伤的细胞器形成自噬体最后被溶酶体降解,微自噬指的是溶酶体直接吸收细胞溶质并将其分解,分子伴侣介导的自噬(CMA)则是特定蛋白被靶向运输到溶酶体[12]。在CMA中,热休克蛋HSC70、Hsp90和小的热休克蛋白家族作为分子伴侣参与自噬过程,HSC70识别带有KFERQ序列的可溶性胞质蛋白底物,引导底物进入溶酶体。如果HSC70受损,其执行的自噬功能就会降低,细胞衰老的风险就会增加。同样,如果衰老的线粒体不能顺利被自噬,将会使细胞处于高浓度的有毒物质(包括ROS)的风险之中,影响细胞的代谢和寿命。研究发现有缺陷的线粒体很少自噬,从而ATP产生减少,细胞分解代谢机制崩溃,最终细胞衰老和死亡[13]。一般细胞自噬功能降低会引起各器官功能衰退、机体老化及相关疾病发生,增强细胞自噬功能可延缓衰老。所以,衰老细胞器的自噬是减弱氧化应激反应对细胞结构造成伤害的过程,也是细胞内稳态得以维持的重要机制。
当细胞受到损伤之初,如果衰老细胞通过细胞凋亡去除,则很难看出衰老细胞如何导致长期损伤。如果生物体不能进行及时地迭代更新或稀释损伤的话,细胞内损伤就会累积。一旦细胞内的损伤继续累积,就必然会对细胞产生有害的影响,并可能累及其他细胞;如若无法通过细胞自噬及时清除损伤,那么最终将会导致生物体衰老或者疾病。
